| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Reglarea procesului de diviziune
Diviziunea celulara normala este corelata cu procesul de replicare a cromosomului bacterian. Exista un raport temporal strict intre replicarea ADN si diviziunea celulei. Corelatia este esentiala, deoarece astfel este prevenita producerea celulelor anucleate. Rata diviziunii celulare este controlata, in primul rand, de rata sintezei ADN. Nucleoidul exercita "putere de veto" asupra diviziunii celulei, ceea ce inseamna ca nucleoidul nereplicat sau nesegregat dupa replicare, reprezinta o bariera fizica pentru procesul diviziunii celulare.
In celulele care cresc cu o rata normala sau scazuta, sinteza ADN se desfasoara pe durata a 2/3 din timpul de generatie. La o tulpina de E.coli cu timpul de generatie de 60 de minute, pentru sinteza ADN sunt necesare 40 de minute. In culturile care cresc mai lent, sinteza ADN dureaza mai mult, dar necesita tot 2/3 din timpul de generatie. In astfel de culturi, o celula tanara rezultata printr-un proces de diviziune contine un singur cromosom. In celulele care cresc pe medii optime, rata de crestere este mare si diviziunea celulei se face la intervale scurte de timp.
Timpul de generatie (intervalul dintre doua diviziuni) este mai scurt decat timpul necesar pentru replicarea moleculei de ADN. ADN se replica mai lent decat timpul necesar desfasurarii unui ciclu de diviziune. Celula bacteriana compenseaza decalajul creat, initiind un al II-lea ciclu de replicare a ADN, inainte de incheierea ciclului anterior. Astfel, in celulele care cresc rapid, pe molecula de ADN sunt prezente la un moment dat, cateva puncte de replicare. Numarul lor depinde de rata de crestere a celulei. Cand copiile de ADN sunt distribuite in celulele fiice, ele poarta regiuni deja replicate. Ca urmare, informatia genetica localizata in apropierea situsului de origine a replicarii se gaseste intr-un numar mai mare de copii, decat aceea localizata aproape de punctul terminal al replicarii cromosomului. Deoarece cantitatea de ADN/unitatea de masa celulara ramane constanta, celulele care cresc repede sunt mai mari.
La eucariote, sinteza ADN se initiaza simultan pe toti cromosomii setului. Pe fiecare cromosom exista un numar de situsuri separate, la care sinteza incepe simultan.
Segregarea cromosomilor
La bacterii, incheierea replicarii cromosomului este semnalul disocierii sale de membrana si astfel este posibila repartizarea cromosomilor fii in cele doua celule surori. Mecanismul segregarii (distributiei) celor doi cromosomi nu este cunoscut. Se pare ca rolul esential in acest proces revine structurilor mezosomale. Clivarea structurii mezosomale este corelata in timp, cu replicarea cromosomului. Fiecare dintre cei doi cromosomi ramane legat de cate o structura mezosomala. Cresterea membranei plasmatice in spatiul dintre cei doi mezosomi asigura deplasarea acestora spre polii celulei. Fiecare dintre cele doua celule surori va mosteni un cromosom legat de propriul mezosom. Dar invelisurile celulei cresc in special prin intercalare la situsuri multiple.
Rezultatele autoradiografice sugereaza ca originile replicarii celor doi cromosomi se indeparteaza in cursul replicarii, ajung la polii celulei si raman acolo pentru cea mai mare parte a ciclului. Dar replisomul pare a fi localizat la centrul celulei, probabil atasat de membrana celulei, ceea ce sugereaza ca pentru un nou ciclu de replicare, originea trebuie sa revina spre centrul celulei.
Segregarea celor doi cromosomi in celulele fiice merge paralel cu replicarea. Cei doi cromosomi se deplaseaza chiar in timpul replicarii. Secventele de nucleotide adiacente situsului de origine a replicarii reprezinta situsuri de legare pentru proteinele ce participa la separarea ADN (fig. 44).
Pe masura ce ADN trece prin replisom, pierde supraspiralizarea si trece in stare relaxata. Dupa incheierea replicarii, cromosomii se recondenseaza separat si se deplaseaza spre pozitiile 1/4 si respectiv 3/4 ale celulei. Un rol important in condensarea ADN are proteina Muk B, componenta a familiei proteinelor care mentin structura cromosomului (SMC). Fiecare dintre proteinele familiei, prin cele doua extremitati active se leaga la doua situsuri distante ale ADN si le apropie printr-un mecanism de balama, dependent de ATP.
Proteinele ce se leaga de ADN nu isi intalnesc situsurile de actiune prin difuzie libera in celula, ci prin legare la un situs de intrare si alunecare pe molecula de ADN pana la locul de actiune.
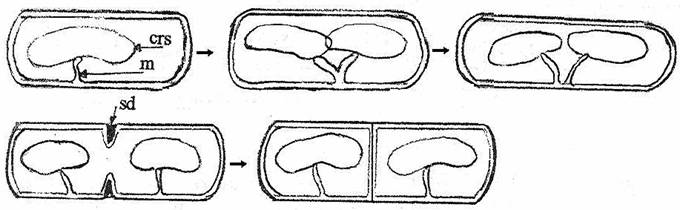
Fig. 44. Ilustrarea schematica a mecanismului segregarii cromosomilor in celulele surori rezultate dupa diviziune (cr = cromosom ; m = mezosom ; sd = sept de diviziune).
Dinamica (evolutia) unei culturi bacteriene
Cultura bacteriana este rezultatul cresterii si multiplicarii intr-un mediu lichid sau solid, a unei mici cantitati initiale de celule, care constituie inoculul.
Microorganismele se cultiva in mai multe scopuri:
izolarea si identificarea lor;
mentinerea viabilitatii lor in colectie;
studiul sensibilitatii la antibiotice in laboratorul clinic sau in scopul cercetarii;
in scop industrial pentru obtinerea biomasei, a unor produsi de biosinteza sau de fermentatie.
Exista doua modalitati de cultivare a microorganismelor si tot atatea tipuri de culturi:
culturile bacteriene discontinui se obtin prin cultivarea in mediul nutritiv lichid sau solidificat, ce nu se reinoieste;
culturile bacteriene continui se obtin prin cultivarea in mediu lichid reinoit permanent, cu o anumita rata.
In mod curent, in laborator se obtin culturi bacteriene discontinui, intr-un volum fix de mediu lichid sau solidificat, nereinoit. Odata cu cresterea culturii bacteriene, compozitia chimica a mediului se modifica: scade cantitatea de substante nutritive si se acumuleaza cataboliti, care pot fi toxici.
Intr-o cultura discontinua, numarul de celule viabile variaza continuu. Ritmul de diviziune este conditionat de concentratia nutrientilor: este foarte inalt in faza initiala a evolutiei culturii, cand mediul ofera condttii optime, dar diminua treptat, pana la 0, pe masura epuizarii nutrientilor si a acumularii catabolitilor.
Intr-o cultura discontinua, ciclul celular este sincron numai in primele cicluri de diviziune celulara Curand apar decalaje si ritmul diviziunii devine asincron. Diferite grupe de celule se gasesc in faze diferite ale ciclului de crestere si multiplicare. Varsta celulelor unei culturi discontinui este diferita. Numarul de generatii celulare este limitat.
Analiza evolutiei numarului de celule intr-o cultura discontinua se poate face pe o curba de crestere, trasata in coordonate semilogaritmice. Panta curbei reflecta valoarea ratei de crestere, variabila in timp. Curba relecta variatiile numarului de celule si implicit a masei celulare, in functie de timp.
In raport cu variatiile ratei de crestere, pe curba se disting 6 momente:
l) Faza de latenta (de lag sau de crestere 0) este greu de delimitat de faza urmatoare (fig. 45). Are o durata foarte variabila: poate sa fie foarte scurta (chiar inexistenta) sau sa dureze cateva ore. Numarul celulelor ramane neschimbat, egal cu cel din inocul sau poate chiar sa scada usor. Este caracterizata printr-o intensa activitate celulara. In cursul acestei faze, celulele se pregatesc pentru procesele de multiplicare care vor urma.
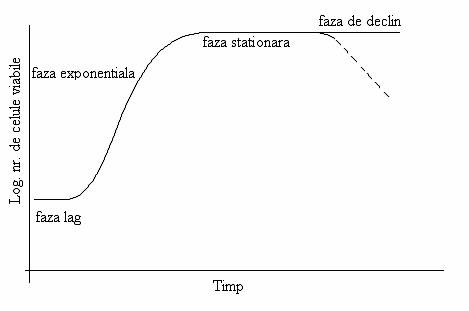
Fig. 45. Curba ideala de crestere a unei culturi stationare. Linia continua reprezinta numarul total de celule, iar linia discontinua ilustreaza numarul celulelor viabile.
Timpul de latenta este lung (1-3 ore) pentru inoculul bacterian care provine dintr-un mediu complex, ce contine numerosi compusi organici, insamantat intr-un mediu sintetic minimal. Latenta corespunde timpului necesar sintezei enzimelor celulare pentru biosinteza metabolitilor esentiali. Latenta este de asemenea indelungata, dupa inocularea unui mediu sintetic minimal, cu un numar mic de celule care provin din acelasi mediu. In acest caz, bacteriile sunt adaptate fiziologic la mediul de crestere, dar cresterea intarzie, deoarece anumite componente toxice (de exemplu, ionii metalici) nu au fost neutralizate.
Timpul de latenta depinde de starea fiziologica a celulelor din inocul: celulele aflate in faza stationara se adapteaza usor la un mediu diferit. Daca inoculul provine dintr-o cultura aflata in faza de declin, alterarea proceselor fiziologice se reflecta in cresterea perioadei de latenta. Timpul de latenta nu influenteaza durata celorlalte faze de evolutie a unei culturi.
De cele mai multe ori, celulele bacteriene se adapteaza la noile conditii de mediu datorita plasticitatii fenotipice, in cadrul aceleiasi norme genetice. Uneori, adaptarea unei culturi la noile conditii de mediu se poate datora selectiei unei populatii mutante si timpul de lag este lung. In acest caz, in inocul se gaseste o proportie foarte mica de celule mutante, capabile sa metabolizeze aceste surse. Din punct de vedere genetic, mutantele sunt diferite de restul celulelor. Din aceasta cauza, perioada de lag este foarte lunga. Masa celulara a culturii va deveni vizibila numai dupa ce celulele mutante s-au multiplicat intr-o masura suficienta pentru a constitui o proportie semnificativa a inoculului. In acest caz, perioada de lag este aparenta si nu reala, deoarece celulele mutante capabile sa creasca, se multiplica exponential cu mult inainte ca rezultatul multiplicarii sa se evidentieze prin cresterea masei celulare.
Perioada de lag este foarte scurta sau chiar absenta, daca inoculul este transferat pe un mediu identic. Celulele poseda deja, echipamentul necesar metabolizarii mediului respectiv.
2) Faza de initiere a cresterii este un interval scurt de timp, in care celulele bacteriene cresc si se divid cu un ritm care creste progresiv. Este faza de accelerare a ritmului de crestere.
3) Faza de crestere exponentiala. Cresterea numarului celulelor bacteriene se face cu o rata exponentiala(geometrica)constanta. Ritmul de diviziune este maxim. Mortalitatea celulara este practic nula. Dupa fiecare diviziune, numarul celulelor se dubleaza. Daca Xo este numarul de celule/ml la inceputul fazei de crestere exponentiala, numarul de celule se dubleaza succesiv astfel:
dupa o diviziune: X1 = 2 x Xo;
dupa doua diviziuni: X2 = 22 x Xo
dupa n diviziuni: Xn = 2n x X0.
Expresia se poate scrie: logXn = log Xo + n log 2.
Cresterea unei culturi bacteriene se realizeaza intr-un interval de timp dependent de timpul de generatie sau timpul de dublare a numarului de celule.
Timpul de generatie este intervalul necesar pentru ca o celula tanara rezultata din diviziune, sa creasca si sa se divida si se masoara in intervalul de timp dintre doua diviziuni.
La bacterii, timpul de generatie se exprima in minute sau ore: la B. subtilis, B. megatherium - 9-l0 min; la E. coli - 20 min; la Lactobacillus - l00 min; la levuri -60-l20 min; la parameci - 600 min; la Amoeba - l400 min; la M. tuberculosis - l600 min; la T. pallidum - 2000 min.
Durata timpului de generatie este diferita de la o specie la alta si este controlata genetic. In functie de conditiile de mediu, timpii de generatie sunt diferiti pentru aceiasi linie bacteriana. Intr-un mediu optim, timpul de generatie al unei specii se scurteaza, dar creste mult in conditii modificate de mediu.
In culturile bacteriene aerobe stationare, in mediul lichid, numarul maxim de celule care se acumuleaza in aceasta faza este de 200 milioane/ml. In conditii de agitare, contactul cu nutrientii este favorizat si se realizeaza densitati de l0-20 de ori mai mari.
Pentru o celula cu timpul de generatie de 20 de min., dupa l32 de diviziuni exponentiale (in mai putin de 48 de ore)va produce 2,2 x 1043 celule progene cu o greutate de 2,2 x l031 g, mult mai mare decat greutatea planetei. Aceasta capacitate de diviziune ramane numai potentiala si se realizeaza numai pentru intervale foarte scurte de timp, deoarece conditiile de mediu devin foarte rapid limitante. Multiplicarea foarte rapida a celulelor bacteriene este o strategie a supravietuirii. In conditii nefavorabile, multiplicarea este nula.
In cursul fazei de crestere logaritmica, celulele prezinta cateva particularitati: sunt uniforme ca marime si putin mai mari fata de dimensiunile tipice speciei respective. Se coloreaza omogen deoarece nu contin incluzii si sunt intens bazofile.
Intr-o celula care creste, circa 80% din ARN total este ARN ribosomal, iar restul este reprezentat, in cea mai mare parte de ARNt. ARNm, desi indeplineste functia de sinteza a proteinelor, are o proportie foarte mica din ARN total, deoarece functioneaza pentru cateva cicluri ale sintezei proteice, dupa care, fiind instabil, este degradat.
4) Faza de incetinire a cresterii se caracterizeaza prin diminuarea pregresiva a ritmului de diviziune. Este o faza scurta si la sfarsitul ei, celulele au incetat sa se multiplice si sa creasca.
5) Faza stationara (sau de crestere maximala) este caracterizata prin faptul ca numarul total de celule ramane constant, celulele nu se divid, dar numarul celor viabile diminua treptat. Celulele unei culturi in faza stationara nu cresc, nu se divid si sunt considerate ca tipice pentru specia respectiva: dimensiunile lor sunt normale (mai mici decat cele din faza precedenta), se coloreaza normal si pe baza comportamentului lor in coloratia Gram sunt atribuite grupului Gram pozitive sau Gram negative. In celule apar substante de rezerva, vacuole spori.
Faza stationara corespunde platoului curbei de crestere. Durata ei este variabila: in mediile sintetice este scurta.
Oprirea cresterii este datorata epuizarii unui compus nutritiv esential, denumit limitant al cresterii. Daca componentele minerale ale mediului sunt in exces, compusul limitant este de obicei energetic. In cazul bacteriilor auxotrofe, in prezenta componentelor minerale si energetice, oprirea cresterii se datoreaza epuizarii unui factor de crestere.
6) Faza de declin a culturii este ilustrata grafic de panta descendenta a curbei. Masa celulara scade progresiv datorita fenomenului de liza. Cu o rata similara scade numarul celulelor viabile. Cele care nu sporuleaza, mor si se lizeaza. Morfologia celulelor este alterata. Intr-o cultura de bacili apar forme atipice: sferice, filamentoase, ramificate. Celulele contin substante de rezerva, vacuole. Afinitatea pentru colorantii bazici diminua treptat, odata cu scaderea cantitatii de ARN. Sunt celule imbatranite. Numarul lor diminua treptat, iar pentru speciile nesporulate tinde repede spre 0 si cultura se sterilizeaza.
Cresterea coloniala. Bacteriile diseminate individual sau ca grupari elementare pe suprafata sau in masa unui mediu nutritiv agarizat, se divid si formeaza o colonie bacteriana. Fiecare colonie, izolata spatial de vecinele sale, constituie o clona celulara. Numarul celulelor intr-o colonie depinde de talia celulelor si de rata lor de crestere. Numai celulele situate la periferia coloniei, in contact cu mediul nutritiv sunt metabolic active.
Daca dupa fiecare diviziune, cele doua celule surori se separa complet, colonia va lua o forma regulata: sferica sau de lentila biconvexa, pentru cea inclusa in grosimea gelozei si o forma bombata, neteda, pentru cea de pe suprafata agarului. Acestea sunt colonii S(Smooth).
Daca celulele surori adera unele de altele, aspectul coloniei devine neregulat, cu suprafata incretita, rugoasa, proprie coloniei de tip R (Rough).
Masurarea cresterii se face prin determinari cantitative a doi parametri: masa celulara si numarul de celule. Ambele masuratori se raporteaza la un volum fix de mediu, de exemplu la 1 ml. Masa celulara si numarul de celule nu sunt in mod necesare echivalente pentru ca masa celulelor individuale poate sa varieze, masa totala a celulelor creste continuu, iar cresterea numarului de celule este discontinua in cazul culturilor sincrone. De obicei, multiplicarea intr-o populatie mare de celule este asincrona si in aceste conditii cresterea masei celulare si a numarului de celule sunt echivalente.
Metoda directa de masurare a masei celulare este determinarea greutatii uscate a celulelor intr-un volum fix de cultura. In timpul cresterii compozitia chimica a materialului celular ramane constanta.
Masa celulara se poate determina prin metode indirecte: masurarea continutului in C, N sau in proteine.
Metodele indirecte mai sensibile pentru estimarea masei celulare sunt determinarile cantitative ale unei enzime particulare sau rata unui proces metabolic cum este respiratia sau fermentatia(de exemplu, rata producerii de acid lactic este folosita ca parametru al cresterii bacteriilor lactice).
Metoda optima pentru masurarea masei celulare a unei culturi bacteriene este cea optica,
ce consta in determinarea cantitatii de lumina dispersata de o suspensie celulara. Capacitatea de dispersie a luminii este proportionala cu densitatea suspensiei celulare. Cand o raza de lumina trece prin suspensie, reducerea cantitatii de lumina transmisa permite masurarea densitatii celulare.
Raportul dintre masa de celule in suspensie si densitatea sa optica, pentru un organism dat, se face empiric prin masurarea directa a greutatii uscate a celulelor intr-o proba cu o densitate optica data.
Determinarea numarului de celule se poate face microscopic, numarand celulele intr-un volum determinat. Calculul se face cu ajutorul camerelor de numarat. Astfel se determina numarul total de celule dintr-o sauspensie.
Numararea automata a celulelor se face cu un instrument electronic (coulter counter). O cantitate de suspensie este trecuta printr-un orificiu foarte fin. Detectarea celulelor se bazeaza pe diferentele de conductivitate electrica intre celula si mediul de suspensie. Se inregistreaza numarul de celule/unitate de volum. Metoda se utilizeaza pentru numararea celulelor mari (protozoare, alge), dar numararea celulelor mici (bacterii) este dificila, deoarece orificiul trebuie sa fie foarte mic, iar mediul nu trebuie sa contina particule neanimate mici, care pot fi usor inregistrate ca celule bacteriene.
Numararea microorganismelor unicelulare se face prin metoda cultivarii (plate count), pentru ca celulele viabile separate spatial una de alta prin dispersie pe sau intr-un mediu agarizat, prin crestere dau colonii vizibile macroscopic. Metoda permite numai calculul celulelor viabile, deoarece determina numai celulele care cresc si se divid pe un mediu de cultivare.
Culturi continui
Bacteriile prelevate in faza exponentiala sau in faza stationara si transferate pe un mediu identic se divid fara faza de latenta. Aceasta observatie a stat la baza realizarii sistemelor de cultura continua, in care bacteriile se multiplica cu o rata constanta, intr-un mediu reinoit cu o rata constanta.
Culturile continui se realizeaza in chemostat sau in turbidostat.
Functionarea chemostatului se bazeaza pe principiul dilutiei continue a suspensiei de celule, la un volum constant (fig. 46). Mediul proaspat de crestere este adaugat cu o rata constanta in recipientul de cultivare. Cu aceiasi rata, suspensia celulara este recoltata printr-un sifon de "supraplin", astfel incat volumul de mediu din recipient ramane constant. Compozitia mediului nutritiv din chemostat nu este optima, dar se pastreaza constanta si conditioneaza rata de crestere a microorganismelor, care nu este maximala. Chemostatul permite controlul densitatii celulelor si a ratei de crestere a culturii, in functie de rata reinoirii mediului, precum si modelarea cresterii microorganismelor in mediile naturale.
Turbidostatul se bazeaza pe principiul mentinerii constante a densitatii celulare (turbiditatii) in mediul nutritiv, inregistrata permanent de o celula fotoelectrica. Cand densitatea celulara creste, celula fotoelectrica emite un semnal, rezultatul fiind deschiderea unei valve prin care mediul proaspat este trimis in recipientul de crestere. De aici, suspensia este recoltata prin mecanismul de "preaplin".
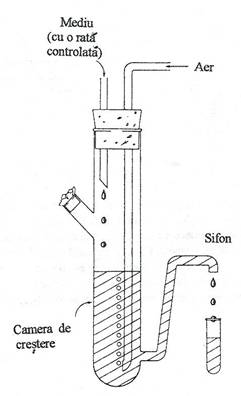
Fig. 46. Reprezentarea schematica a unui chemostat.
Densitatea optica a suspensiei este cu atat mai mare cu cat lungimea de unda a luminii este mai mica. Pentru a evidentia absorbtia, masurarea se face cu o sursa de lumina, cu lungimea de unda mai mare de 490 nm.
Cresterea diauxica. In mediile nutritive care contin doua surse glucidice se observa doua tipuri de crestere:
uneori, curba de crestere este similara celei clasice, obtinuta cu o singura sursa glucidica;
alteori, curba de crestere are o denivelare. Faza exponentiala observata in prima parte este urmata de un platou si o a II-a faza exponentiala, care debuteaza dupa perioada de latenta a platoului intermediar. Fenomenul a fost descris de J. Monod, (1942) la E. coli, crescuta pe un mediu care contine glucoza si lactoza (fig. 47).
Cresterea culturii are loc in doua faze exponentiale distincte: una corespunzatoare cresterii pe glucoza, iar cea de a II-a, corespunzatoare cresterii pe lactoza. In prima faza este utilizata glucoza. Urmeaza o perioada de lag de circa 4 ore si apoi a doua faza de crestere, in cursul careia celulele metabolizeaza lactoza.
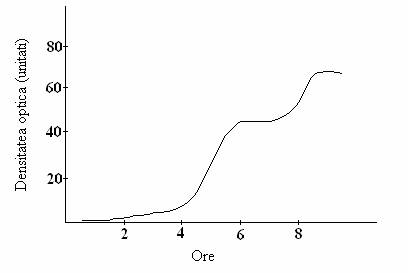
Fig 47. Cresterea diauxica a culturii de B. Subtilis pe mediu cu glucoza si arabinoza. Glucoza este utilizata in prima perioada de crestere si arabinoza in cea de a doua. Incetarea temporara a cresterii dupa 5 ore (marcata intre 2 sageti) reflecta utilizarea completa a glucozei si corespunde perioadei in care are loc sinteza enzimelor necesare pentru utilizarea arabinozei
(dupa Monod, 1958).
Fenomenul diauxiei apare numai pentru zaharuri metabolizabile de catre enzimele inductibile, si nu se manifesta cand mediul contine un amestec de zaharuri metabolizabile sub actiunea enzimelor constitutive.
Perioada de latenta care urmeaza primei cresteri logaritmice corespunde timpului necesar sintezei enzimelor inductibile.
Cea mai neta crestere diauxica este data de amestecul de glucoza sau manitol (grupul A), cu arabinoza, xiloza, sorbitol, maltoza sau lactoza (grupul B). Substraturile de tip A inhiba sinteza enzimelor inductibile ce catabolizeaza substraturile din grupul B (fenomenul represiei catabolice).
Starea fiziologica a bacteriilor in conditii naturale este mult diferita de aceea a bacteriilor cultivate. Chiar in cele mai productive medii aquatice, bacteriile trec alternativ prin starea de eutrofie si cea de infometare si scurtele perioade de crestere rapida sunt intrerupte de perioade de non-crestere. In mediile aquatice, starea normala a bacteriilor corespunde fazei stationare a curbei tipice a evolutiei unei culturi bacteriene.
Trecerea de la faza exponentiala la faza stationara este asociata cu schimbari ample ale morfologiei celulare, ale ratei sintezei macromoleculelor si degradarii, cu modificari ale peretelui celular.
Dupa un interval al starii fara crestere, celulele pot sa intre intr-o stare de latenta metabolica, cu pastrarea viabilitatii, dar cu pierderea capacitatii de a fi cultivate pe medii minimale.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1974
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved