| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Respiratia carbonatului( Reducerea respiratorie a CO2)
Carbonatul (CO2 sau HCO3-) este unul din cei mai abundenti anioni anorganici in natura. CO2 este produsul metabolismului organismelor heterotrofe. Apa marii este o solutie de carbonat, tamponata cu diferite saruri.
Unele bacterii folosesc CO2 ca acceptor de e- in respiratia anaeroba. Dintre bacteriile care reduc CO2, cele mai importante sunt metanogenele. Donorul de e- este H2. Metanogenele cresc in conditii de chimiolitotrofie, intr-un mediu mineral si o atmosfera gazoasa formata din amestec de CO2 si H2. O parte a CO2 este asimilat, adica este folosit pentru sinteza compusilor celulari, dar nu este fixat pe calea reductiva a ciclului Calvin, ci printr-un alt set de reactii specifice grupului. O alta parte a CO2 este redusa la CH4. Metanogenele sunt frecvente in mediile naturale, deoarece in reactia de oxidare a H2, cuplata cu reducerea carbonatului, se elibereaza o cantitate relativ mare de energie:
![]()
Alte bacterii care reduc CO2 sunt acetogenele (Cl. aceticum, Acetobacter woodii). Ele produc acetat din CO2 si H2, dupa reactia:
![]()
Cand cresc intr-un mediu care contine o atmosfera formata din amestecul de H2 si O2,, atat metanogenele cat si acetogenele sunt chimiolitotrofe si sunt strict anaerobe. Ambele grupe se dezvolta si ca heterotrofe pe medii organice.
Fermentatia
Denumirea de "fermentatie" vine de la latinescul fervere, care inseamna "a fierbe" si semnifica degajarea, uneori abundenta, a CO2 in timpul fermentatiei si ii confera aspectul de "fierbere'.
Fermentatia este un proces catabolic producator de energie in absenta O2, in care compusii organici au rolul de donori si de acceptori de electroni. Compusii chimici care indeplinesc aceste functii sunt, de regula, metaboliti derivati dintr-un substrat fermentabil(de exemplu, un glucid). Procesele redox se produc in absenta oricarui acceptor terminal de electroni.
Studiul stiintific al fermentatiilor a fost initiat de L. Pasteur. In perioada l857-l875, el a demonstrat ca procesele de transformare biochimica a unor substraturi sunt consecinta "vietii fara aer" a unor microorganisme, cu rolul de fermenti.
Fermentatia poate fi definita ca un ansamblu de reactii biochimice anaerobe de oxidare si de reducere care furnizeaza celulei energia necesara prin mecanismul fosforilarilor la nivelul substratului, care au loc in citoplasma.
Functia energetica majora sau unica a fermentatiei este producerea ATP. ATP rezulta prin transferul grupelor fosfat, din intermediarii fosforilati cu potential energetic inalt, ce se formeaza in timpul degradarii substratului.
Fermentatiile se desfasoara in conditii anaerobe. La microorganismele strict anaerobe si la cele aerobe facultativ-anaerobe, in prezenta O2, caile fermentative sunt represate. Cele strict anaerobe nu se dezvolta, iar cele facultativ-anaerobe isi schimba calea metabolica de producere a energiei, de la fermentatie la respiratie. Numai bacteriile lactice constituie o exceptie: O2 nu modifica modul lor de a produce energie, astfel incat fermentatia continua chiar in prezenta O2. Efectul inhibitor al O2 asupra fermentatiei, la microorganismele facultativ anaerobe ar fi datorat inactivarii uneia din enzimele cheie ale caii Embden-Meyerhof, fosfofructokinaza.
La microorganismele aerobe-facultativ anaerobe, inhibitia fermentatiei in aerobioza poarta denumirea de efect Pasteur* si se manifesta prin diminuarea neta a cantitatii produselor de fermentatie, precum si prin cresterea randamentului energetic ce se reflecta in producerea unui volum net superior de biomasa pentru aceiasi cantitate de substrat consumat.
O celula facultativ-anaeroba metabolizeaza glucoza pe cale aeroba sau anaeroba. In anaerobie, glucoza este degradata la lactat, rata degradarii fiind mult mai mare decat in conditii aerobe. Diferenta se datoreaza randamentului mai mic de sinteza a ATP/molecula, in timpul glicolizei: se produc 2 molecule de ATP/molecula, iar in aerobioza se sintetizeaza 36 molecule de ATP. In anaerobie, pentru sinteza aceleiasi mase celulare este necesara de 18 ori mai multa glucoza.
Daca suspensia celulara anaeroba se oxigeneaza, rata de consum a glucozei scade foarte mult, iar acumularea lactatului scade pana spre 0. Fenomenul inhibarii consumului de glucoza si stoparea acumularii lactatului in prezenta O2 se numeste efect Pasteur. Efectul s-a descoperit pentru fermentatia alcoolica, dar este o caracteristica a tuturor celulelor facultative, inclusiv a celulelor musculare.
Substraturile fermentabile sunt compusi organici diversi: glucide sau compusi inruditi (acizi organici, alcooli), aminoacizi, amine, purine, pirimidine. In procesul fermentatiei, anumiti compusi organici, de obicei doi metaboliti diferiti, derivati dintr-un substrat fermentabil au rolul de donor si respectiv, de acceptor de e-.
In procesul fermentativ este mentinut echilibrul redox. Nivelul mediu de oxidare a produselor finale este egal cu al produsului fermentabil: din glucoza rezulta atat metaboliti oxidabili cat si reductibili.
Degradarea substratului in fermentatie este incompleta si de aceea se elibereaza o cantitate mult mai mica de energie decat in procesul de respiratie, in cursul careia oxidarea substratului este completa.
Procesele de fermentatie sunt initiate de fosforilari la nivelul substratului. Rezultatul lor este sinteza ATP, dar si a altor compusi cu o legatura bogata in energie, cel mai important fiind acetil-CoA (fig. 58).
Diferenta esentiala intre metabolismul aerob si anaerob consta in soarta acidului piruvic si a NADH. In metabolismul aerob, NADH este oxidat in catena transportoare de e-, cu sinteza ATP prin fosforilare oxidativa, iar in anaerobioza NADH este folosit in reducerea anaeroba a compusilor organici.
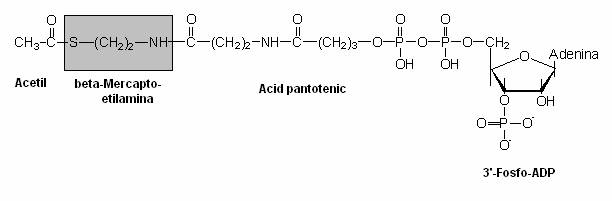
Fig. 58. Structura moleculara a acetil - CoA.
Fermentatia glucidelor
Glucidele sunt cele mai importante substraturi fermentabile. Bacteriile fermenteaza polizaharide (amidonul, celuloza, pectina, chitina), dizaharide (lactoza, maltoza, zaharoza), hexoze (glucoza, fructoza, galactoza), pentoze (arabinoza, xiloza), acizi derivati din zaharuri (acidul gluconic si glucuronic), polialcooli (manitol, glicerol).
Fermentatia diferitelor glucide are loc in una sau in cateva etape specificice, urmate de o etapa nespecifica. In etapa nespecifica intervin unele dintre enzimele implicate in fermentatia glucozei.
Glucoza este fermentata, virtual, de toate bacteriile anaerobe. Fermentatia ei este cel mai cunoscut proces fermentativ si este initiat printr-o reactie de fosforilare, in urma careia rezulta glucozo-6 fosfatul. Procesul poate fi considerat ca decurge in doua etape:
in prima etapa se desfasoara reactiile de oxidare a glucozei. Rezultatul lor este formarea intermediarului central al metabolismului fermentativ al glucidelor - acidul piruvic. Acest compus este mai oxidat decat glucoza si diferenta de potential redox este stocata in piridin-nucleotidele reduse;
in etapa a II-a au loc reactii de reducere a compusilor intermediari, prin care se formeaza mai multe produse finale.
Glucoza este oxidata pe una din urmatoarele 4 cai:
calea Embden-Meyerhoff-Parnas (EMP, denumita si calea hexozo-difosfatului sau a glicolizei);
calea hexozo-monofosfatului (HMP, denumita si calea pentozo-fosfatului);
calea fosfocetolazei
calea Entner-Doudoroff
Calea EMP este calea majora de degradare a glucozei, la cele mai multe organisme, precum si in celulele vegetale si animale (fig. 59). Este o cale integral anaeroba. Ea cuprinde o secventa de l0 reactii enzimatice, prin care o molecula de glucoza este degradata la doua molecule de piruvat, fara participarea O2 molecular.
Glucoza este fosforilata la glucozo-6 fosfat, in cursul procesului de transport membranar, sau intracelular, sub actiunea unei kinaze citoplasmatice, cu consum de ATP. Glucozo-6 fosfatul este izomerizat la fructozo-6 fosfat, iar acesta, sub actiunea fosfofructokinazei este convertit la fructozo-1,6 difosfat.
Reactia caracteristica a caii EMP este scindarea fructozo-1,6 difosfatului, ceea ce justifica denumirea de calea hexozo-difosfatului.
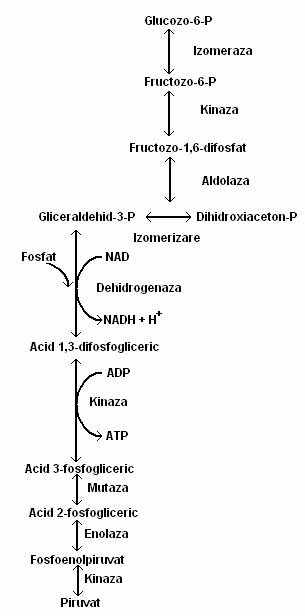
Fig. 59. Calea Embden-Meyerhoff-Parnas (calea glicolizei) de degradare a glucozei la piruvat.
Fructozo-1,6 difosfatul este scindat sub actiunea aldolazei si rezulta un amestec de triozo-fosfati (aldehida-3 fosfoglicerica si dihidroxiaceton-1 fosfat), reversibil interconvertibili. Numai gliceraldehid-3P poate fi degradat pe calea glicolizei. Intr-o prima etapa, gliceraldehid-3 P este oxidat, cu reducerea NAD+ si se formeaza doua molecule de acid 1,3 difosfogliceric. Printr-o serie de reactii, acidul l,3 difosfogliceric este convertit la piruvat:
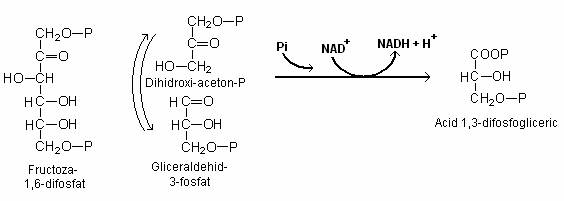
Reactia de clivare a fructozo-1,6 difosfatului si formarea 3-fosfogliceroil-fosfatului. Se esterifica fosfatul anorganic si se reduce NAD+.
In aceasta reactie, aldehida 3-fosfoglicerica este oxidata si adusa la nivelul de oxidare al gruparii -COOH. Este o reactie exergonica. Nu rezulta acidul fosfogliceric liber, ci o anhidrida mixta a gruparii -COOH a acidului 3-fosfogliceric si a acidului fosforic, adica 3- fosfogliceroil-fosfatul, un compus macroergic care conserva E potentiala a oxidarii gruparii aldehidice la acid.
In etapa urmatoare, 3-fosfogliceroil-fosfatul, transfera gruparea fosfat la ADP si se sintetizeaza ATP.
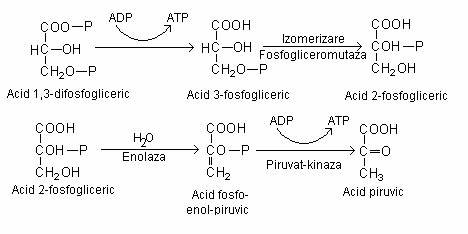
Conversia celor doua molecule de acid l,3-difosfogliceric la doua molecule de acid piruvic si regenerarea ATP.
Calea EMP nu explica modul in care pentozele pot fi folosite ca sursa de energie si nici formarea ribozei, necesara biosintezei acizilor nucleici.
Fosforilarile in anaerobioza sunt putin numeroase, deoarece se produc numai in reactiile de dehidrogenare a substratului, neexistand catena de respiratie. De exemplu, in fermentatia glucozei, fosforilarea are loc in doua etape :
prin conversia gliceraldehid- 3 P sub actiunea NAD
prin conversia fosfoenol-piruvatului la piruvat. Se sintetizeaza doua molecule de ATP. Reactiile de reducere a intermediarilor oxidati la produse finale (de exemplu, reducerea piruvatului la lactat) nu produc energie. Unele reactii de reducere sunt chiar consumatoare de ATP (de exemplu, formarea acidului piruvic). Producerea limitata de energie in procesele fermentative explica randamentul totdeauna inferior al cresterii in anaerobioza, comparativ cu acela al procesului respirator.
Piruvatul este intermediarul oxidat cel mai frecvent al diferitelor cai catabolice. Uneori se formeaza acetil-CoA.
Reactiile de reducere a compusului oxidat intermediar (piruvatul) conduc la formarea diferitelor produse finale, fie unice, fie in amestec, pe baza carora se diferentiaza bacteriile fermentative. In cazul in care rezulta un amestec de produse finale, acestea au grade diferite de oxidare, de la CO2 pana la alcool (mai redus decat glucoza), trecand prin nivele intermediare de oxidare a cetonelor si aldehidelor.
Produsele finale ale fermentatiei nu pot fi degradate in anaerobioza. Proportia lor in amestec influenteaza in mod direct valoarea pH a mediului la sfarsitul procesului. Analiza cantitativa a produselor finale ale unei fermentatii este utila pentru caracterizarea unor grupe taxonomice.
Glucoza este fermentata, virtual, de toate bacteriile anaerobe.
Fermentatia lactica
Fermentatia lactica este procesul biologic prin care microorganismele catabolizeaza glucoza din mediu si o tranasforma in acid lactic. In cantitate mica, acidul lactic este produsul de catabolism a unui numar mare de microorganisme, dar unele bacterii furnizeaza acidul lactic, ca produs principal al metabolizarii glucidelor.
Bacteriile lactice se impart in doua categorii:
a) bacteriile homofermentative produc numai acid lactic ca produs final al procesului fermentativ: Lactobacillus delbrueckii, L. bulgaricus. L. acidophilus, L. casei, L. plantarum, Streptococcus lactis, S. cremoris, S. thermophilus;
b) bacteriile heterofermentative produc, pe langa acid lactic, cantitati mari ale altor produse finale (CO2, etanol, acid acetic, glicerina, manita, in functie de specie): L. brevis, L. lycopersici, Leuconostoc mesenteroides, L. dextranicum, L. citrovorum.
Cantitati mari de acid lactic sunt produse de unii fungi filamentosi (Rhizopus), dar pentru producerea industriala a acidului lactic se folosesc bacteriile lactice.
Bacteriile lactice sunt Gram pozitive, nesporulate, anaerobe-aerotolerante sau microaerofile, mobile, nepatogene si cresc in mediu acid.
Acidul lactic (a-hidroxipropionic) contine un atom de carbon asimetric si de aceea poate exista sub doua forme optic active: izomerii D(-) si L (+):
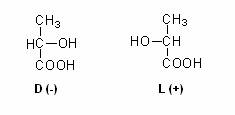
Lactat-dehidrogenaza este stereospecifica. Izomerul rezultat din fermentatie depinde de natura dehidrogenazei lactice. Bacteriile homofermentative si Rhizopus oryzae (dintre fungii filamentosi) contin L-lactat-dehidrogenaza si produc lactat (L+). Cele heterofermentative contin o D-lactat-dehidrogenaza si formeaza acid D(-) lactic. Bacteriile lactice produc acid lactic optic inactiv, adica amestecul racemic al formelor D(-) si L(+). Racemizarea se datoreaza actiunii enzimei racemaza, existenta la majoritatea bacteriilor lactice. Activitatea racemazei depinde de concentratia de acid nicotinic din mediu, un factor de crestere esential pentru bacteriile lactice. In general, bacteriile lactice necesita prezenta in mediu, a vitaminelor grupului B si a unor aminoacizi, care au rolul de factori de crestere.
Diferentele dintre bacteriile homofermentative si heterofermentative sunt determinate de prezenta sau de absenta aldolazei, enzima cu rol esential in glicoliza. Bacteriile homofermentative au aldolaza si cliveaza hexozodifosfatul la triozofosfati, iar in echipamentul enzimatic al celor heterofermentative, aldolaza lipseste.
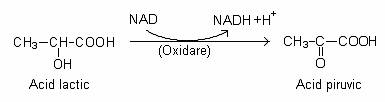
Din punct de vedere biochimic, fermentatia lactica este cea mai simpla: piruvatul, furnizat pe calea EMP este redusa direct, fara decarboxilare, sub actiunea NAD+ - lactat-dehidrogenazei, la lactat.
In acest proces fermentativ, acidul lactic este produsul final unic sau dominant cantitativ. In functie de proportia produselor finale ale fermentatiei se disting trei tipuri de microorganisme:
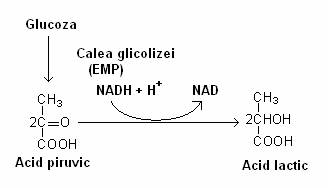
a) Microorganisme homofermentative (lactobacili, streptococi, unii fungi, unele protozoare). Acidul lactic este produsul unic al fermentatiei. Dintr-un mol de glucoza se formeaza doi moli de lactat. Acelasi set de reactii are loc in celula musculara, in conditii de hipoxie:
Glucoza degradata pe calea glicolizei:
b) Microorganisme heterofermentative (unele specii de Lactobacillus, Peptococcus) realizeaza o fermentatie heterolactica. Procesul incepe pe calea hexozo-monofosfatului(HMP) si se continua pe calea fosfocetolazei.
Calea HMP este o varianta a caii glicolitice, activa la unele bacterii, pentru utilizarea hexozelor, pentozelor si a altor glucide. Este o cale de "ocolire" a caii glicolitice si de aceea se mai numeste "suntul HMP" sau calea pentozo-fosfatului, calea fosfogluconatului sau calea Warburg-Dickens-Horecker. Aceasta cale furnizeaza unitati pentozice care sunt convertite la intermediari ai caii glicolitice si la acid piruvic.
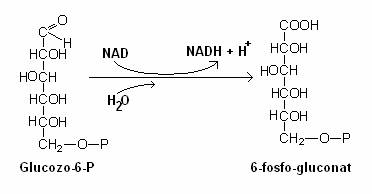
Prima reactie a suntului HMP este fosforilarea glucozei, ca si in calea glicolizei. Glucozo-6 fosfatul este oxidat la acid-6 fosfogluconic.
Acidul fosfogluconic este decarboxilat la ribulozo-5-fosfat:
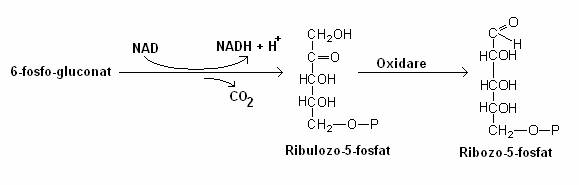
Ribozo-5 fosfatul este utilizat pentru sinteza acizilor nucleici, pentru glicoliza etc.
Calea fosfocetolazei este o cale fermentativa restransa la bacteriile heterolactice. Este o varianta a caii hexozo-monofosfatului, cu care are in comun primele trei reactii ce conduc la formarea ribulozo-5 fosfatului. Acesta este izomerizat la xilulozo-5 fosfat. Fosfocetolaza, enzima caracteristica a caii, cliveaza xilulozo-5 fosfatul, la aldehida-3 fosfoglicerica si acetil fosfat.
Aldehida-3 fosfoglicerica este metabolizata pe calea EMP, pana la piruvat si in final la lactat, iar acetil-fosfatul este redus in doua trepte succesive, la etanol.
In fermentatia heterolactica se formeaza cantitati echimolare de CO2, etanol si lactat (fig. 60).
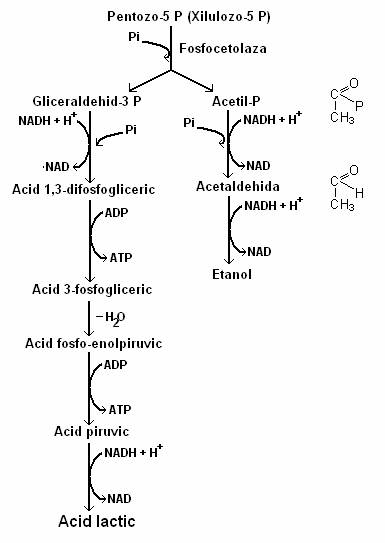
Fig. 60. Fermentatia heterolactica bacteriana pe calea fosfocetolazei. Produsele finale sunt CO2, acidul lactic si etanolul.
Etanolul se formeaza din acetil-fosfat, prin doua reduceri succesive care echilibreaza cele doua oxidari ce au loc in reactia de conversie a glucozo-6 P la pentozo-P si CO2. Produsele finale ale fermentatiei sunt etanolul, lactatul si CO2.
c) Microorganisme aceto-lactice. Bacteriile din g. Bifidobacterium, intr-o fermentatie mixta aceto-lactica (fig. 61) produc un amestec de acizi lactic si acetic, dupa reactia:
![]()
Glucoza este fosforilata si convertita la fructozo-6 fosfat, ca si in calea glicolitica EMP. Fructozo-6 fosfatul este clivat intr-o reactie de fosforilare cu fosfat anorganic, intr-o molecula de acetil-fosfat si eritrozo-4 fosfat. Reactia eritrozo-4 fosfatului, cu o molecula de fructozo-6 fosfat initiaza o serie complexa de rearanjari moleculare, din care rezulta gliceraldehid-3 fosfat si acetil-fosfat:
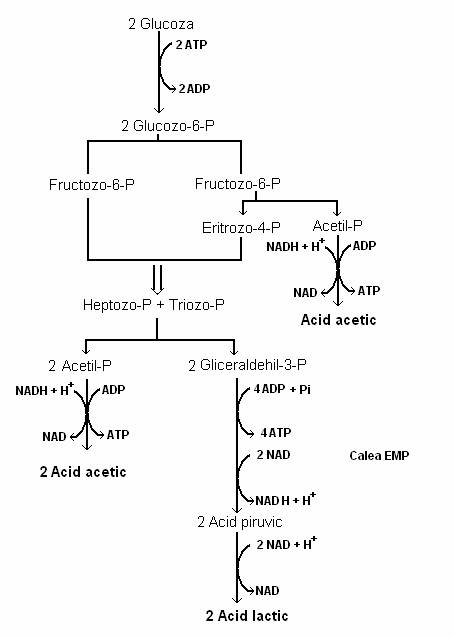
Fig. 61. Fermentatia acetolactica a glucozei la Bifidobacterium
Fermentatia alcoolica produsa de levuri
Fermentatia alcoolica este foarte asemanatoare celei lactice, diferenta fiind numai cu privire la transformarile acidului piruvic. Cea mai mare parte a etanolului produs in natura si in industrie rezulta prin catabolizarea anaeroba a glucozei si a altor zaharuri de catre S. cerevisiae (fig. 62).
Levurile catabolizeaza glucoza pe calea EMP. Dintr-o molecula de glucoza se formeaza doua molecule de piruvat, care nu este convertit la acetil-CoA, ca in metabolismul aerob si nici redus la acid lactic, ci sub actiunea piruvat-decarboxilazei, o enzima cheie in fermentatia alcoolica, este decarboxilat la acetaldehida. Acetaldehida este redusa de NAD-reductaza, la etanol.
Productia neta de ATP in fermentatia alcoolica este de doua molecule, pentru fiecare molecula de glucoza, mult mai putin decat in catabolizarea aeroba.
Prin transferul celulelor in conditii anaerobe, rata degradarii glucozei se intensifica de 3-4 ori. Transferul invers este insotit de diminuarea ratei de catabolizare a glucozei si oprirea fermentatiei alcoolice. Fenomenul poarta denumirea de "efect Pasteur".
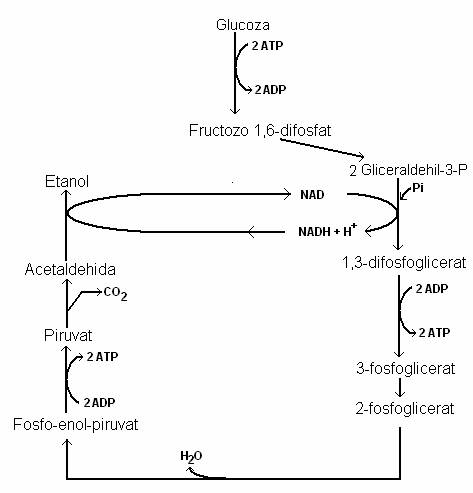
Fig. 62. Fermentatia glucozei produsa de levuri. Rezulta etanol si CO2.
Fermentatia alcoolica bacteriana
O alta cale a fermentatiei alcoolice este aceea care se desfasoara in celulele bacteriene saprobionte anaerobe, aerotolerante, ce apartin g. Zymomonas. Glucoza este catabolizata pe calea Entner-Doudoroff (ED) (fig. 63).
Calea ED a fost descoperita la Pseudomonas saccharophila si la Zymomonas mobilis, dar este functionala si la unii viermi paraziti.
Primul intermediar al caii este glucozo-6 P, care este oxidat, ca si pe calea HMP, la 6-fosfo-gluconat.
Prin reactia de dehidrogenare, 6-fosfo-gluconatul formeaza un compus intermediar -
2-ceto-3-dezoxi-6-fosfo-gluconatul, care este scindat sub actiunea aldolazei, la piruvat si aldehida-3-fosfoglicerica.
Aldehida-3-fosfoglicerica poate fi catabolizata de enzimele caii EMP si rezulta piruvat sau de enzimele caii HMP si se formeaza precursori pentru biosinteza ADN, ARN, a vitaminelor, aminoacizilor aromatici etc. Calea functioneaza si la Rhizobium. Lipseste la bacteriile Gram pozitive, cu exceptia unora din g. Nocardia.
Bacteriile din g. Zymomonas metabolizeaza piruvatul prin decarboxilare, deoarece au o enzima rara la bacterii - piruvat-decarboxilaza. Pe aceasta cale, dintr-o molecula de glucoza se formeaza doua molecule de etanol si doua molecule de CO2.
Multe bacterii lactice, enterobacterii si clostridii formeaza cantitati mari de piruvat in procesul fermentatiei, dar nu au piruvat-decarboxilaza pentru producerea acetaldehidei.
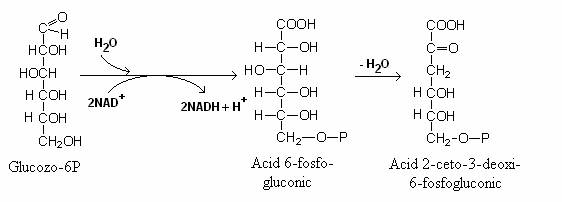
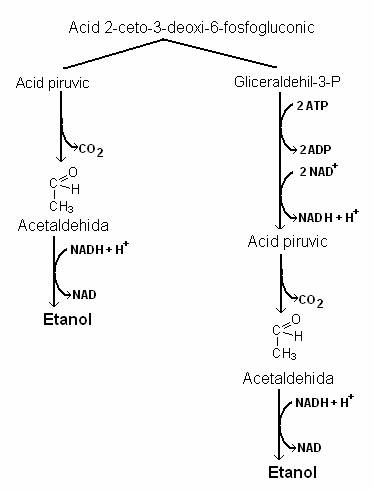
Fig. 63. Fermentatia alcoolica bacteriana (g. Zymomonas). Se formeaza 2 molecule de CO2 si 2 molecule de etanol.
Fermentatiile acide
La cele mai multe bacterii, catabolizarea glucozei la acid piruvic se desfasoara pe calea EMP.
Exista cateva tipuri de fermentatii, care se deosebesc de fermentatia homolactica, prin reactia de reducere a piruvatului, deoarece numai o parte a acestui intermediar este redusa direct la lactat, dar majoritatea moleculelor sale sunt supuse unei reactii de decarboxilare, sub actiunea piruvat decarboxilazei. Se formeaza acetaldehida, care este oxidata in trepte succesive, rezultatul fiind un amestec de produse de fermentatie in care predomina acizii.
Echilibrul cantitativ al produselor finale depinde de echipamentul enzimatic al speciei bacteriene, dar si de un mcanism general de reglare a metabolismului bacterian, in functie de pH-ul mediului de crestere. Daca pH-ul scade sub un anumit nivel, datorita producerii initiale a acizilor tari (acetic, lactic), metabolismul bacterian este reglat spre producerea acizilor mai slabi (propionic, butiric) si in anumite cazuri, a corpilor cetonici (butanediol) sau a alcoolilor (etanol, butanol).
Cele mai multe fermentatii bacteriene sunt acide. In functie de raportul cantitativ al produselor finale se disting urmatoarele tipuri:
Fermentatia acida mixta (fig 64) este caracteristica a unui numar mare de enterobacterii negative pentru reactia Voges-Proskauer. In varianta sa cea mai simpla, fermentatia acida mixta este rezultatul a doua serii principale de reactii:
reducerea directa a piruvatului la lactat
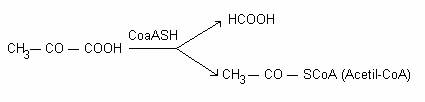
clivarea piruvatului la formiat si acetil, in prezenta CoA.
Reactia este catalizata de formiat-piruvat-liaza:
Unele grupari acetil din acetil-CoA sunt reduse de doua ori: la acetaldehida si la etanol. Reactia este catalizata de o alcool-dehidrogenaza, legata de CoA:
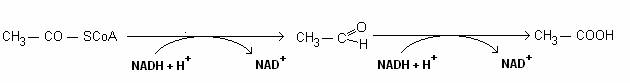
Alte grupari acetil, care nu sunt necesare pentru oxidarea NADH pot fi folosite pentru a furniza ATP suplimentar. Fosfotransacetilaza catalizeaza transferul reversibil al acetatului, de la acetil-CoA, la fosfat, cu formarea acetil-fosfatului:
![]()
Intr-o reactie reversibila, acetokinaza transfera fosfatul de la acetil-P, la ADP pentru a forma ATP si elibereaza acetatul:
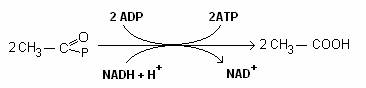
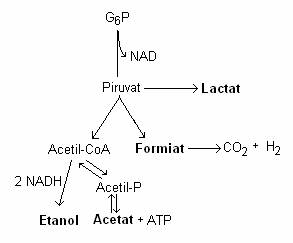
Fig. 64. Produsele finale derivate din piruvat prin fermentatie acida mixta.
Produsele finale ale fermentatiei acide mixte sunt: lactatul, acetatul, etanolul si formiatul. Consecutiv clivarii formiatului, la multe enterobacterii (E. coli), din fermentatia glucozei rezulta gaze (CO2, H2). Daca din echipamentul enzimatic lipseste formiat-liaza, fermentatia se produce fara gaze.
Unele enterobacterii, in special cele care au formiat-dehidrogenaza, produc o cantitate mica de acid succinic, in prezenta ATP, prin reactia de condensare a unei molecule de CO2 cu o molecula de piruvat. Reactia este catalizata de piruvat-feredoxin-oxidoreductaza.
Proportia produselor finale ale fermentatiei depinde de conditiile de cultivare. PH-ul mediului scade datorita acumularii acizilor rezultati in fermentatie.
Fermentatia butirica
Fermentatia butirica este caracteristica, dar nu exclusiva, bacteriilor zaharolitice din g. Clostridium (fig. 65).
Butiratul se formeaza pe o cale metabolica ce incepe cu clivarea piruvatului, in prezenta CoA, in acetil-CoA, CO2 si H2. CO2 si H2 se formeaza direct, fara faza intermediara a acidului formic:
![]()
Doua molecule de acetil-CoA se condenseaza si formeaza aceto-acetil-CoA. Aceto-acetil-CoA este redusa la butirat, dupa urmatoarea reactie:
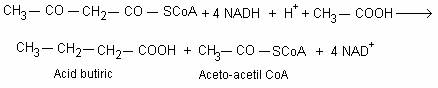
O proportie variabila a moleculelor de acetil-CoA este hidrolizata la acetat si regenereaza CoA.
Unele specii ale g. Clostridium pot forma alte produse de fermentatie: alcooli (butanol, etanol, izopropanol) si acetona, ce rezulta prin reducerea acizilor formati in fermentatie.
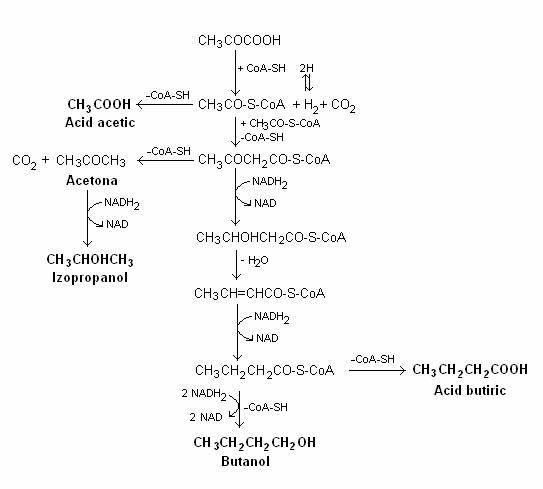
Fig. 65. Fermentatia butirica
Conversia piruvatului la acetil-CoA implica sistemul enzimatic al piruvat-feredoxin-oxidoreductazei (PFO), o enzima ce catalizeaza oxidarea piruvatului pentru a forma acetil-CoA si CO2. Feredoxina este un transportor de e-, care ii poate dona unei hidrogenaze, cu formarea H2.
Feredoxinele sunt proteine cu Fe si S, care functioneaza si in alte reactii: fixarea N2, fotosinteza. PFO catalizeaza o reactie rapida de schimb intre CO2 si gruparea COOH a piruvatului, reactie ce poate fi folosita pentru a diferentia PFO de alte enzime de clivare a piruvatului. In conditii reducatoare, reactia poate fi reversata, permitand sinteza piruvatului din acetat si CO2.
PFO are un rol important in procesele de oxido-reducere ale bacteriilor anaerobe (Clostridium). Enzima permite reutilizarea H2 ca potential reducator, avand rol de hidrogenaza de inglobare. Are un potential redox foarte mic, asemanator cu al H2 (-0,42 V). Functia de hidrogenaza de inglobare a PFO catalizeaza reducerea produselor primare acide ale fermentatiei mixte, rezultate din acidul piruvic, la molecule neutre: prin reducerea aceto-acetilului rezulta butanol, prin decarboxilarea aceto-acetil-CoA se formeaza acetona, iar prin reducerea acetonei rezulta izopropanol.
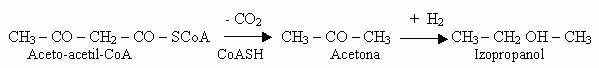
Recircularea H2 si utilizarea sa ca potential reducator pastreaza echilibrul redox al mediului de crestere a acestor bacterii.
Fermentatia butanediolului
Fermentatia butanediolului (2,3 butan-glicol) este produsa de unele enterobacterii (Vibrio, Aeromonas), de unele specii de Bacillus si de unele bacterii lactice (Streptococcus cremoris, Lactobacillus cremoris).
Pe langa sistemul enzimatic al fermentatiei acide mixte, ele au si setul de enzime al fermentatiei particulare, denumita butanediolica sau butilen-glicolica, care furnizeaza ca produs final, o molecula neutra de 2,3-butanediol. Aceasta cale metabolica intra in actiune dupa ce pH-ul mediului de crestere scade sub 6.
Reactia cheie a acestei cai este cea de condensare a doua molecule de piruvat, prin decarboxilare si eliberare a acidului formic. Rezulta diacetilul, care este redus la acetoina (acetil-metil-carbinol).
Prin reducerea acetoinei se formeaza butanediolul, dupa urmatoarea reactie globala:
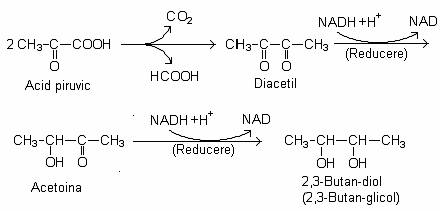
Diacetilul si acetoina dau aroma caracteristica untului. Diacetilul se formeaza din lapte (l g/l). Citratul este scindat in acetat si oxalo-acetat. Oxalo-acetatul este decarboxilat la piruvat.
La enterobacterii, butanediolul se formeaza pe calea acetolactatului. Doua molecule de piruvat se condenseaza printr-o reactie de decarboxilare si se formeaza acetolactatul:
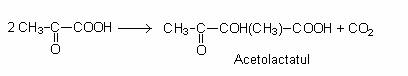
Acetolactatul este decarboxilat sub actiunea aceto-lactat-decarboxilazei si se formeaza acetoina, care este redusa la butanediol.
Calea fermentatiei butanediolice se evidentiaza prin reactia Voges-Proskauer* si prin valoarea relativ ridicata a pH.
*Reactia Voges-Proskauer evidentiaza capacitatea unor microorganisme de a produce prin fermentatia glucozei, acetil-metil-carbinol(acetoina), care in prezenta alcalilor este oxidat la diacetil. Diacetilul se combina cu arginina, creatina sau cu creatinina din mediu si determina aparitia culorii rosii.
Fermentatia acidului propionic
Acidul propionic este produs pe cale fermentativa de un grup de bacterii nesporulate din g. Propionibacterium. Ele pot fermenta acidul lactic (produsul final al altor fermentatii bacteriene) (fig. 66). Se formeaza acid propionic, acid acetic si CO2. Aceasta cale de fermentatie permite generarea ATP prin metabolizarea acidului lactic sau a acidului piruvic, rezultat pe calea glicolizei:
O parte din acidul piruvic este oxidat la CO2 si acetil-CoA. Acetil-CoA este utilizata pentru sinteza ATP si a acetil-P, care ulterior este redus la acid acetic. O alta parte a acidului piruvic este carboxilat la acid oxalo-acetic:
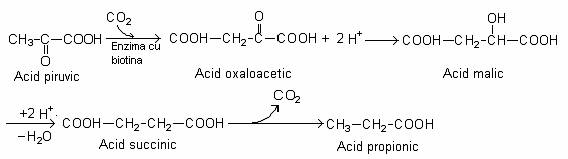
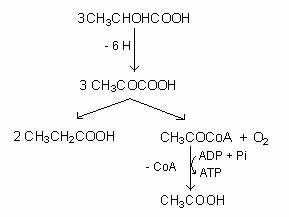
Fig. 66. Reprezentarea schematica a fermentatiei acidului lactic la acid propionic.
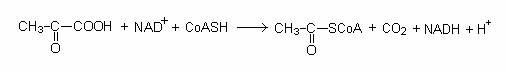
Catabolismul piruvatului
Piruvatul este catabolizat pe cale aeroba sau anaeroba. Microorganismele strict aerobe sau cele facultative, in prezenta O2 realizeaza decarboxilarea oxidativa a piruvatului si formeaza acetil-coenzima A, care intra in ciclul Krebs, la nivelul oxalo-acetatului:
Daca oxalo-acetatul nu se formeaza cu o rata corespunzatoare (datorita faptului ca intermediarii ciclului Krebs, acidul alfa-cetoglutaric si acidul succinic sunt precursorii altor constituienti), mentinerea ciclului este posibila prin sinteza suplimentara a acidului oxalo-acetic, prin carboxilarea piruvatului sau a acidului fosfo-enol-piruvic:
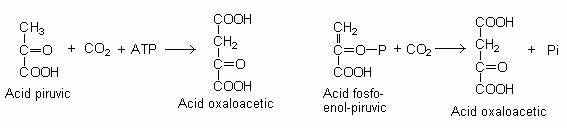
In anaerobioza, piruvatul este decarboxilat sub actiunea piruvat-decarboxilazei si se formeaza acetaldehida si CO2, redusa ulterior la etanol, de catre bacteriile din g. Zymomonas:
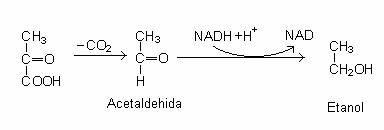
Piruvat-decarboxilaza poate fi asociata cu un sistem transportor de electroni, pana la CO2.
Catabolismul lipidelor
Trigliceridele sunt hidrolizate la glicerol si acizi grasi, sub actiunea exo- sau endolipazelor. Aceste enzime sunt produse de mucegaiuri (A. flavus, P. roqueforti, Rhizopus sp., Geotrichum), la levuri (Candida lipolytica, Torulopsis, S. cerevisiae), la bacterii (Serratia liquefaciens, Ps. aeruginosa, Alcaligenes sp., S. aureus).
Glicerolul intra in calea glicolizei, la nivelul dihidroxi-aceton-fosfatului, trecand prin dihidroxi-acetona sau prin glicerol fosfat (fig. 67). Ulterior, aceste produse sunt degradate pe calea glicolizei. Procesul este anaerob.
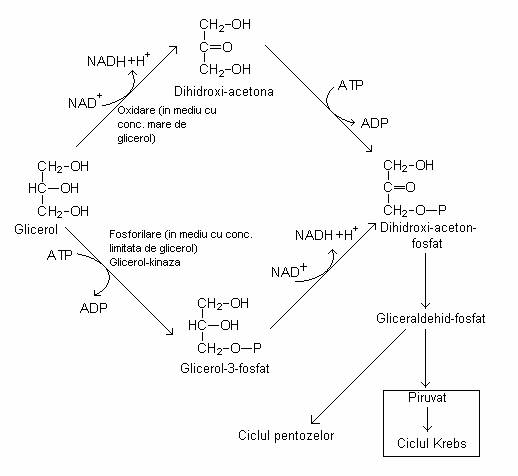
Fig. 67. Caile de catabolizare a glicerolului
Catabolismul glicerolului
Acizii grasi sunt activati de ATP in prezenta CoA si se formeaza acil-CoA. Acesta este oxidat la carbonul beta si prin hidroliza rezulta acetil-CoA, care este mai scurt decat cel initial cu doi atomi de carbon.
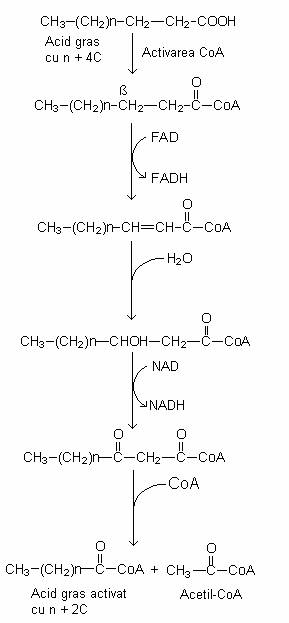
Fig. 68. Mecanismul beta-oxidarii unui acid gras care duce la formarea succesiva a acetil-CoA (cu 2 atomi de C).
Catabolizarea compusilor organici azotati
Numeroase bacterii (in special din g. Clostridium si Bacillus) secreta exoproteaze care scindeaza lanturile polipeptidice in fragmente de cativa aminoacizi. Sinteza enzimelor proteolitice este represata daca in mediu se adauga hidrolizat de proteine sau amestec de aminoacizi. Peptidazele hidrolizeaza polipeptidele si le transforma in aminoacizi. In functie de modul de actiune asupra lantului polipeptidic, peptidazele sunt de doua tipuri: endopeptidaze si exopeptidaze. La randul lor, exopeptidazele sunt de doua categorii :
- aminopeptidaze, cele care incep actiunea lor la extremitatea NH2 libera a polipeptidului. Activitatea lor depinde de prezenta ionilor metalici ;
- carboxipeptidaze, cele a caror actiune se initiaza la extremitatea COOH libera a polipeptidului.
Actiunea acestor enzime are ca efect formarea di- si tripeptidelor, ulterior hidrolizate in aminoacizi.
Majoritatea bacteriilor oxideaza putin sau deloc aminoacizii. Ele sunt mult mai active in sinteza decat in degradarea lor, in special in faza de crestere rapida. Unele bacterii pot degrada aminoacizii, in special daca acestia sunt unica sursa de C in mediu. La plantele superioare, ca si la bacterii, dominanta este sinteza, deoarece ca si bacteriile, tind sa creasca continuu.
Exista doua cai principale de catabolizare a aminoacizilor :
prin dezaminare
prin decarboxilare
Dezaminazele microorganismelor sunt foarte diverse. Ele cuprind enzime oxidative si neoxidative. Rezultatul dezaminarii oxidative este formarea iminoacidului, care este apoi hidrolizat in acid α- cetonic si NH3:
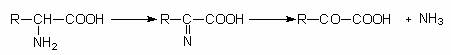
Dezaminarea neoxidativa poate fi de trei feluri:
dezaminare desaturanta, cu formarea acidului nesaturat si a NH3;
dezaminare reductiva, ce consta in reducerea aminoacizilor la acidul saturat corespunzator si formarea NH3;
dezaminare prin deshidratare, o cale exclusiva a microorganismelor pentru aminoacizii hidroxilati. Se formeaza acidul cetonic si NH3;
Un tip special de dezaminare este dezaminarea cuplata (reactia Stickland) (fig. 69). Reactia se numeste dezaminare cuplata, deoarece necesita cel putin o pereche de aminoacizi complementari, unul fiind oxidat, iar celalalt avand rolul de acceptor de electroni.
Reactia globala a dezaminarii cuplate este urmatoarea:
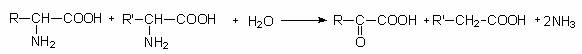
Aminoacidul donor este oxidat sub actiunea unei NAD-dehidrogenaze. Rezultatul reactiei este dezaminarea celor doi aminoacizi. Acidul alfa-cetonic este decarboxilat secundar, reactie in cursul careia se produce fosforilarea la nivelul substratului (pentru o pereche de aminoacizi se sintetizeaza o molecula de ATP).
Un exemplu tipic este fermentatia alaninei si a glicinei, dupa reactia globala:
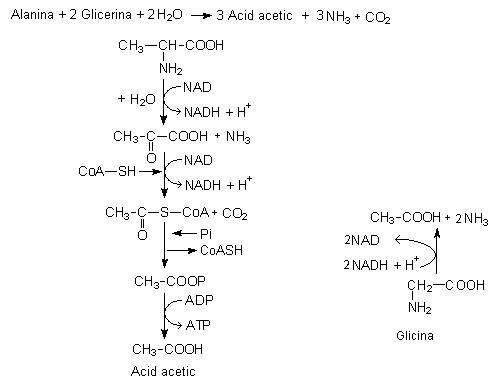
Fig. 69. Mecanismul reactiei Stickland, ca modalitate a metabolismului fermentativ producator de energie. L-alanina are rol de donor de electroni , iar glicina de acceptor. Ambele sunt convertite la acid acetic.
Dupa comportamentul lor in reactia Stickland, aminoacizii se impart in trei grupe: reducatori, oxidanti si cei care se comporta ca reducatori sau oxidanti, in functie de conditiile de mediu.
Reactia de dezaminare cuplata este catalizata de numeroase bacterii anaerobe (de exemplu, Clostridium).
Decarboxilarea aminoacizilor este o cale de catabolizare comuna multor microorganisme, proteolitice sau neproteolitice. Se formeaza CO2 si o amina:
![]()
Un mediu acid favorizeaza biosinteza decarboxilazelor si pH creste, datorita producerii NH3, ureii, aminelor, iar intr-un mediu alcalin este stimulata sinteza dezaminazelor si pH scade.
Unele bacterii isi obtin energia prin catabolizarea unui singur aminoacid (arginina), pe cai fermentative foarte specifice si complexe sau prin fermentarea unor compusi aminati (purine, pirimidine).
Catabolismul compusilor aromatici
In raport cu capacitatea de a metaboliza compusii aromatici, bacteriile se impart in trei categorii:
cele care nu degradeaza astfel de compusi;
cele care realizeaza o degradare incompleta (de exemplu, enterobacteriile). E. coli scindeaza triptofanul la indol si piruvat, sub actiunea unei triptpofanaze, fara sa deschida ciclul benzenic sau pirolic. Reactia de evidentiere a indolului in mediile nutritive peptonate este un test de identificare a enterobacteriilor, utilizat frecvent (fig. 70);
bacteriile care metabolizeaza complet compusii aromatici, prin ruperea structurilor ciclice. Reactia de clivare a moleculelor ciclice este generatoare de energie.
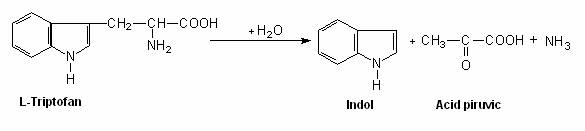
Fig. 70. Reactia de degradare a triptofanului de catre E. coli.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4980
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved