| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Legile gazelor perfecte sunt valabile numai la limita presiunilor mici. Toate gazele reale manifesta abateri de la aceste legi care depind de natura gazului. In cazul gazelor reale nu se poate da o ecuatie care sa descrie comportamentul tuturor gazelor si trebuie determinata ecuatia de stare a fiecarui gaz.
Luand diferite gaze reale si reprezentand grafic valoarea produsului pV in functie de presiune, nu se obtin drepte orizontale conform legii Boyle-Mariotte, ci drepte inclinate fata de axa abscisei in domeniul presiunilor mici (fig. 2.4.).
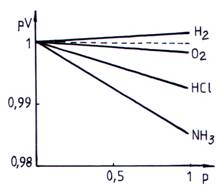
Fig. 2.4. Abaterile gazelor reale de la legea Boyle-Mariotte
La presiune constanta volumul gazelor reale nu variaza cu temperatura dupa legea Gay-Lussac, coeficientul de dilatare in volum fiind o functie de presiune si de natura gazului.
O imagine clara asupra comportarii gazelor reale se obtine daca se reprezinta grafic izotermele unui gaz la diferite temperaturi.
Un astfel de grafic in coordonate pV - p este prezentat in fig. 2.5. si arata influenta presiunii si a temperaturii asupra comportarii CO2.
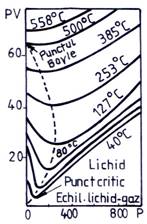
Fig. 2.5. Izotermele CO2 in diagrama pV - p
Se observa din fig. 2.5. ca toate izotermele trec printr-un minim. Inainte de a atinge minimul, pV este mai mic decat valoarea corespunzatoare legii gazelor perfecte si in acest domeniu gazul este mai compresibil decat un gaz perfect, iar dupa minim gazul este mai putin compresibil decat cere legea Boyle-Mariotte. Daca se unesc minimele izotermelor (cu linie punctata) se obtine o curba de forma parabolica ce intersecteaza axa ordonatei intr-un punct deasupra caruia pV creste monoton cu presiunea, incepand de la presiune nula. Izoterma care porneste de la acest punct are tangenta paralela cu axa abscisei in punctul p = 0. La aceasta temperatura numita temperatura Boyle, exista un domeniu de presiune in care gazul respecta legea Boyle-Mariotte.
La comprimarea gazelor reale exista posibilitatea ca gazul sa se condenseze si sa se transforme in lichid. Fenomenul de lichefiere poate avea loc numai sub o anumita temperatura numita temperatura critica (Tc). Sub aceasta temperatura substantele pot exista in stare gazoasa numai pana la o anumita presiune la care incepe condensarea lor.
Punctul critic (P) reprezinta punctul de inflexiune al izotermei p-V corespunzatoare temperaturii critice. Presiunea necesara pentru a lichefia gazul la temperatura critica este presiunea critica (pc), iar volumul ocupat de un mol de substanta in conditii critice este volumul critic (Vc).
Cele 3 marimi, Tc, pc si Vc se numesc parametrii critici ai unei substante.
Fig. 2.6. prezinta izotermele CO2 in diagrama p V.
Izoterma temperaturii critice (31,1C) prezinta un punct de inflexiune P la Vc si pc. Curba punctata de delimitare a regiunii a III-a este numita curba de saturatie. Aceasta curba delimiteaza domeniul eterogen (regiunea III) in care coexista cele doua faze (gaz si lichid), maximul acestei curbe fiind punctul critic. Domeniul cuprins intre ramura ascendenta a curbei de saturatie si izoterma care trece prin punctul critic (regiunea II) corespunde lichidului omogen, iar domeniul cuprins intre ramura descendenta a curbei de saturatie si aceeasi izoterma (regiunea I) corespunde gazului omogen.
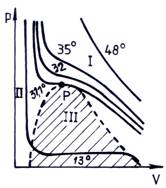
Fig. 2.6. Izotermele CO2 in diagrama p V
Abaterile gazelor reale de la legile gazelor perfecte pot fi caracterizate si cu ajutorul diagramelor de compresibilitate. In aceste diagrame se reprezinta factorul de compresibilitate (z) in functie de presiune, pentru diferite temperaturi.
Factorul de compresibilitate se defineste prin ecuatia:
![]() (2.55)
(2.55)
unde: Vm = volumul molar.
Pentru gazele perfecte, z = 1 in orice conditii, iar pentru gazele reale, z ≠ 1. Din diagrama de compresibilitate prezentata in fig. 2.7. se observa pe curbele z-p, existenta unui minim in domeniul presiunilor mici. La presiuni mici, toate gazele reale au z < 1 si Vreal < Vperfect, adica sunt mai compresibile decat gazele perfecte deoarece fortele de atractie depasesc fortele de respingere intermoleculare. La presiuni mari pentru toate gazele si la orice temperatura, z > 1, ceea ce inseamna Vreal > Vperfect, gazul real fiind mai putin compresibil decat gazul perfect, cand fortele de respingere depasesc fortele de atractie intermoleculare.
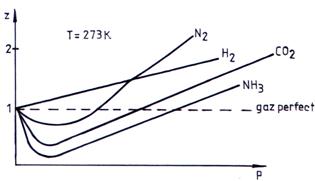
Fig. 2.7. Diagrama de compresibilitate a unor gaze la 273 K
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1625
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved