| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Analiza speciilor chimice prezente in apa este adesea dificila. Studiul proceselor chimice care au loc in ape nu este usor, chiar si in conditii controlate ca cele din laborator.
In comparatie cu fenomenele ce se desfasoara in conditii controlate in laborator, fenomenele chimice care au loc in apele naturale sunt mult mai greu de interpretat. Sistemele pe care le reprezinta apele naturale sunt foarte complexe si o descriere a chimismului acestora trebuie sa tina cont de multe variabile.
In sistemele acvatice, pe langa apa mai se gasesc, minerale, substante organice, gaze dizolvate si organisme. Ca orice sistem deschis, apele naturale au intrari si iesiri variabile de materie si energie. De aceea, exceptand unele cazuri putin frecvente, nu se realizeaza un echilibru real al conditiilor, desi o stare de quasi stationaritate a sistemelor acvatice poate fi adesea atinsa.
Natura speciilor chimice din apa este, de asemenea, puternic influentata de actiunea organismelor - in special bacterii si alge. Astfel, o descriere exacta a proceselor chimice desfasurate in apele naturale, care sa se bazeze pe valori ale constantelor de echilibru ale reactiilor acido-bazice, de solubilizare si complexare, potential redox, pH si alti parametrii chimici nu este posibila. De aceea, sistemul trebuie sa fie descris prin modele simplificate, adesea bazate pe conceptul de echilibru chimic. Aceste modele, desi nu foarte exacte si pe deplin realiste pot conduce la generalizari necesare intelegerii naturii proceselor chimice ce au loc in ape precum si la posibilitatea descrierii unor sisteme acvatice.
Pentru a intelege fenomenul de poluare trebuie mai intai sa se dobandeasca notiuni fundamentale despre fenomenele chimice care au loc in ape.
Procesele chimice acvatice implica reactii familiare chimistilor, cum sunt reactiile acido-bazice, solubilizarea, reactii de oxido-reducere si de complexare. Nu trebuie uitat insa ca procesele biologice joaca un rol cheie in chimia apelor naturale. De exemplu, algele prin intermediul procesului de fotosinteza pot genera o crestere a pH-lui apei datorata consumului de CO2 si astfel convertii ionii HCO3- in ioni CO32- care reactioneaza cu Ca2+ solubilizat in apa avand drept rezultat precipitarea carbonatului de calciu.
In cele ce urmeaza se va discuta preponderent despre mai multe specii chimice prezente in mod natural in apa, dar care in exces pot deveni poluanti.
GAZE IN APA
Principalele gaze dizolvate in apa sunt oxigenul si dioxidul de carbon, gaze ce sunt cruciale pentru viata acvatica.
Solubilitatea gazelor in apa se calculeaza cu ajutorul Legii lui Henry care stipuleaza ca: solubilitatea unui gaz intr-un lichid este proportionala cu presiunea partiala a acelui gaz in contact cu lichidul.
Fara un nivel apreciabil de oxigen dizolvat in apa numeroase tipuri de organisme acvatice nu pot supravietuii. Oxigenul dizolvat este consumat in procesul de degradare al substantelor organice din apa si de aceea, multi pesti mor din cauza lipsei de oxigen si nu datorita toxicitatii directe exercitate de poluanti.
Oxigenul este produs din activitatea de fotosinteza, dar acest proces nu are eficienta necesara, deoarece o parte din oxigenul produs ziua este consumat noaptea tot de catre alge in procesul lor metabolic. De asemenea, la sfarsitul ciclului lor de viata, degradarea biomasei algelor se face tot cu consum de oxigen.
In consecinta, cea mai mare cantitate de oxigen provine din atmosfera, abilitatea apelor naturale de a se reoxigena fiind o caracteristica importanta.
Solubilitatea oxigenului in apa depinde de temperatura apei prin ecuatia Clausius - Clapeyron:
unde:
R - ct. universala a gazelor = 1,987 cal.grd-1.mol-1 ΔH - entalpia [cal.mol-1]
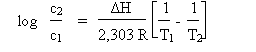
de presiunea partiala a oxigenului din atmosfera prin legea lui Henry:
![]()
[X(aq)] = KPX
la 250C: KO2 = 1,28.10-3 KCO2
= 3,38.10-2 KN2 = 6,48.10-4
unde:
[X(aq)]- concentratia gazului in mediu apos
PX - presiunea partiala a gazului la interfata
K - ct. lui Henry [mol.L-1.atm-1]
particulara fiecarui gaz pentru o temperatura specifica
si de continutul de saruri din apa.
Astfel la
Este important sa se faca diferenta intre solubilitatea oxigenului, care este concentratia maxima de oxigen dizolvata la echilibru si concentratia de oxigen din apa, care in general nu este o concentratie de echilibru si este limitata de mai multi factori.
Daca materia organica de origine biologica o reprezentam prin formula procesul de descompunere al acesteia poate fi scris:
+ O2 → CO2 + H2O
Dintr-un scurt calcul se poate observa ca oxigenul ce poate fi dizolvat la 250C intr-un litru de apa ajunge doar pentru degradarea a 7-8 mg materie organica.
Odata cu cresterea temperaturii, creste cantitatea de oxigen consumat de catre organisme si in acelasi timp are loc o scadere a solubilitatii oxigenului in apa (14,7 mgL-1 la 00C - 7,03 mgL-1 la 350C). Aceasta poate conduce la un deficit sever de oxigen in sistemul acvatic.
Dioxidul de carbon provine din aer si in urma activitatii bacteriene care descompune materia organica.
Datorita caracterului sau acid, este mult mai complicat sa se calculeze solubilitatea dioxidului de carbon in apa decat cea a gazelor nereactive (O2 ; N2). In acest caz trebuie sa se tina cont de interactia CO2 cu diverse specii chimice.
Concentratia CO2 in atmosfera variaza functie de locatie si de sezon. Iar in ultima vreme aceasta este in crestere cu aproximativ 1 ppm (volum) pe an.
Se va considera ca valoare medie 350 ppm (0,035%) in aer uscat. In aceste conditii la 250C concentratia CO2 in apa este de 1,146x 10-5M.
In apa are loc echilibrul:
![]() CO2(aq) + H2O H2CO3
CO2(aq) + H2O H2CO3
Insa, constanta de echilibru pentru aceasta reactie este de doar 2x10-3 (la o temperatura de 250C), deci doar o mica fractie a dioxidului de carbon se gaseste sub forma de acid carbonic.
In apa exista un echilibru intre speciile CO2 - HCO3- - CO32-, care pate fi descris de ecuatiile:
![]() CO2 + H2O HCO3- + H+
CO2 + H2O HCO3- + H+
![]() HCO3- CO32- + H+
HCO3- CO32- + H+
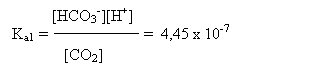
pKa1 = 6,35
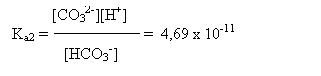
pKa2 = 10,33
(unde pKa = -logKa)
Specia predominanta in apa, formata la dizolvarea dioxidului de carbon este deci functie de pH (Fig. 1).
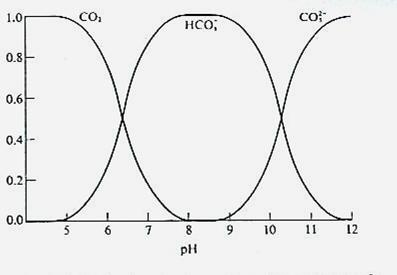
Figura 1. Diagrama de distributie a speciilor CO2 - HCO3- - CO32- in apa
Fractiile CO2 - HCO3- - CO32- pot fi descrise ca:
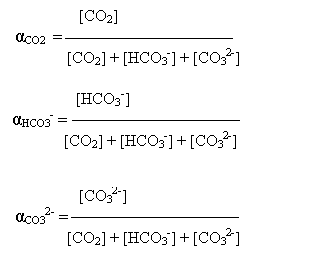
Daca se introduc in aceste expresii relatiile pentru Ka1 si Ka2 rezulta:
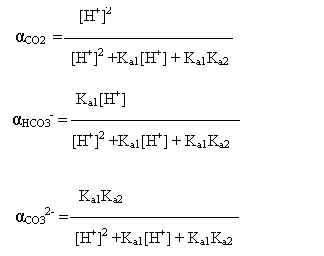
Reiese ca:
pentru valori ale pH-lui semnificativ mai mici decat pKa1, αCO2 devine egala cu 1- specia predominanta va fi CO2
cand pH = pKa1 , αCO2 = αHCO3-
cand pH = (pKa1 + pKa2), αHCO3- = 0,98
cand pH = pKa2, αHCO3- = αCO32-
la pH-uri semnificativ peste valoarea pKa2 αCO32- = 1
Aciditatea este capacitatea apelor de a neutraliza ionii HO-. Analog alcalinitatea este capacitatea apelor de a neutraliza H+. Aproape toate apele naturale prezinta alcalinitate, apele acide nu sunt in mod frecvent intalnite, decat in cazul unor poluari severe.
Aciditatea este generata in special de prezenta unor acizi slabi ca: CO2, H2S, proteine, acizi grasi, ioni metalici cu caracter acid, in speta Fe3+.
Aciditatea este mai greu de determinat decat alcalinitatea, deoarece aceasta e este datorata in principal contributiei a doua specii care pot fi usor pierdute din sistem: CO2 si H2S, ceea ce face ca prelevarea si conservarea probelor sa fie dificila.
Din punct de vedere al poluarii, acizii tari precum, H2SO4 si HCl, sunt principalii generatori de aciditate. Un exemplu de ape reziduale puternic acide, sunt apele de mina.
In timp ce aciditatea totala este determinata prin titrare cu baze in prezenta fenolftaleinei (pH final 8,2), aciditatea data de acizii minerali se determina prin titrare cu baze in prezenta de metiloranj (pH final 4,3).
Unii ioni metalici hidratati pot contribuii si ei la caracterul acid al apei , de exemplu:
Al(H2O)63+ ↔ Al(H2O)5OH2+ + H+
Exista o serie de ape reziduale industriale, in special din industria metalurgica, care contin ioni metalici cu caracter acid. Cunoasterea aciditati pentru astfel de ape reziduale este necesara pentru a calcula cantitatea de reactivi chimici (var sau alte substante) necesara neutralizarii.
Capacitatea apelor de a accepta protoni poarta denumirea de alcalinitate. Cunoasterea alcalinitatii unei ape este importanta atat din punct de vedere al proceselor chimice si biologice din apele naturale cat si pentru procesul de tratare al apelor. O apa puternic alcalina are adesea un pH ridicat si contine, in general, cantitati insemnate de minerale dizolvate.
Aceste caracteristici sunt importante cand este vorba de utilizarea apelor pentru boilere, schimbatoare de caldura, in industria alimentara sau in retele de distributie a apei potabile.
Alcalinitatea are rol de tampon de pH si resursa de carbon anorganic - confera apei caracter de suport al dezvoltarii algelor si a altor forme de viata acvatica. Valoarea alcalinitatii este utilizata de catre biologi ca masura a fertilitatii.
Speciile bazice responsabile pentru alcalinitate sunt, in general, ionii: bicarbonat, carbonat si hidroxil.
HCO3- + H+ → CO2 + H2O
CO32- + H+ → HCO3-
HO- + H+ → H2O
Alte specii care pot contribuii la alcalinitate, dar in masura mai mica, sunt: amoniacul si bazele conjugate ale acidului fosforic, silicic, boric si ale acizilor organici.
Alcalinitatea este exprimata fie ca acid consumat in titrarea in prezenta de fenolftaleina - pH la care HCO3- este specia carbonata predominanta (pH = 8,3), fie ca alcalinitate totala, corespunzatoare titrarii cu acid in prezenta de metiloranj (pH = 4,3), cand ambele specii bicarbonat si carbonat sunt convertite in CO2.
Este important sa se faca distinctia intre bazicitate ridicata, manifestata printr-un pH ridicat si alcalinitate ridicata, tradusa prin capacitatea de a accepta H+. Astfel, pH-ul este un factor intensiv in timp ce alcalinitatea este un factor capacitiv. Aceasta poate fi ilustrata comparand o solutie 10-3 M de NaOH cu o solutie 10-1M de NaHCO3. Solutia de hidroxid de sodiu este puternic bazica avand un pH de 11, dar 1 L din aceasta solutie va fi neutralizata de 10-3 mol de acid clorhidric. Solutia de bicarbonat de sodiu are un pH de 8,34, mult mai scazut decat cel al solutiei de hidroxid, dar, un litru din solutia de bicarbonat va fi neutralizat de 10-1 mol acid, deci alcalinitatea este de 100 de ori mai mare decat in cazul solutiei mai bazice de NaOH.
Aplicatie- tratarea apei cu sulfat de aluminiu ca coagulant :
Al(H2O)63+ + 3HO- → Al(OH)3 (s) + 6 H2O
In practica (inginerie), alcalinitatea este frecvent exprimata ca mg CaCO3 /L. Aceasta exprimare poate crea uneori confuzii, fiind preferabil sa se exprime in echivalenti /L (chimie) (pentru CaCO3 E = M/2).
Apele naturale sunt caracterizate, in general, printr-o alcalinitate [alc] = 10-3 eq/L, ceea ce se traduce prin faptul ca un litru de apa este neutralizat de 10-3 mol acid.
Contributia diverselor specii la alcalinitate depinde de pH.
De exemplu:
- Pentru o apa cu pH = 7, [HO-] este prea mica pentru avea o contributie semnificativa asupra alcalinitatii. Mai mult, dupa cum s-a aratat anterior, la pH = 7 [HCO3] >> [CO32-]. In consecinta, in acest caz alcalinitatea este datorata ionului bicarbonat, [HCO3-] = 10-3 M.
Substituind in expresia lui Ka1 reiese ca la pH =7 si [HCO3-] = 10-3 M, valoarea lui [CO2(aq)] este 2,25.10-4M, mai mare decat valoarea care rezulta din echilibrul dioxidului de carbon in apa si aer, dar care poate fi atinsa rapid datorita prezentei dioxidului de carbon rezultat in urma activitatii bacteriene din apa si sedimente.
- Pentru o apa care are o alcalinitate de 10-3 eq/L la pH = 10, atat HO- cat si CO32- sunt prezenti in concentratii semnificative comparabile cu cea a HCO3- .
[alc] = [HCO3-] + 2[CO32-] + [HO-] = 10-3
Concentratia CO32- este multiplicata cu 2 pentru ca fiecare ion CO32- poate neutraliza 2 ioni H+.
Pentru a determina concentratiile celor 3 specii generatoare de alcalinitate, trebuie rezolvate alte doua ecuatii:
[HO-] = Kw/[H+] = 10-14/10-10 = 10-4
si
[CO32-] = Ka2[HCO3-]/[H+]
Din rezolvarea acestor trei ecuatii rezulta:
[HCO3-] = 4,64.10-4 M si [CO32-] = 2,18.10-4M.
Deci contributia la alcalinitatea acestei ape (solutii) va fi urmatoarea:
4,64 x 10-4 eq/L din HCO3-
2 x 2,18 x 10-4 = 4,36 x 10-4 eq/L din CO32-
1,00 x 10-4 eq/L din HO-
__________ ______ ____ _________
alk = 1,00 x 10-3 eq/L
Aceste valori pot fi utilizate pentru a arata ca, la aceeasi valoare a alcalinitatii, concentratia carbonului anorganic dizolvat, [C], variaza cu pH-ul.
[C] = [CO2] + [HCO3-] + [CO32-]
[C]pH 7 = 2,25.10-4 + 1.10-3 + 0 = 1,22.10-3
[C]pH 10 = 0 + 2,18.10-4 + 4,64.10-4 = 6,82.10-4
Din acest calcul reiese ca, la pH =10, concentratia carbonului anorganic este aproape jumatate din cea la pH =7. Aceasta datorita faptului ca la pH =10 contributia majora in alcalinitate este data de CO32- , fiecare ion de carbonat avand de doua ori alcalinitate unuia de bicarbonat si de ionii HO- (care nu contin carbon).
In procesul de fotosinteza:
CO2 + H2O + hν → + O2
HCO3- + H2O + hν → + O2 + HO-
Cand carbonul anorganic este folosit in procesul de fotosinteza apa devine mai bazica. Cantitatea de carbon care poate fi consumata inainte ca apa sa devina prea bazica pentru dezvoltarea algelor este proportionala cu alcalinitatea. Plecand de la pH=7 la pH=10, cantitatea de carbon anorganic consumata dintr-un litru de apa avand alcalinitatea de 10-3 eq/L este:
[C]pH 7 x 1L - [C]pH 10 x 1L = 1,22.10-3 mol - 6,82.10-4 mol = 5,4.10-4 mol
aceasta se traduce printr-o crestere de 5,4.10-4 mol de biomasa → 16mg/L .
Considerand ca nu are loc nici un transfer aditional de CO2 in apa, pentru aceeasi variatie de pH, mai multa biomasa se produce la o alcalinitate mai mare. Din acest motiv biologii utilizeaza alcalinitatea ca masura a fertilitatii.
De asemenea, cresterea solubilitatii bioxidului de carbon in apa creste cu cresterea alcalinitatii.
La valori ale pH-lui mai mici de 7, [H+] conduce la o scadere semnificativa a alcalinitatii si concentratia lui trebuie scazuta cand se calculeaza alcalinitatea totala. In consecinta:
[alc] = [HCO3-] + 2[CO32-] + [HO-] - [H+]
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2755
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved