| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Re
Pentru exemplificare se considera reactia dintre hidrogen si iod:
H2 + I2 Û 2HI
Initial (I) a b 0 moli
Re
Echilibru (E) a-x b-x 2x moli
Re
Concentratiile de echilibru sunt:
![]() (6.40)
(6.40)
Rezulta:
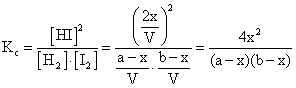
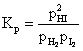 (6.42)
(6.42)
nechil = a - x + b - x + 2x = a + b (6.43)
Presiunile partiale sunt:

Constanta de echilibru Kp devine:
 (6.45)
(6.45)
Folosind relatia (6.21), rezulta:
![]() (6.46)
(6.46)
Aranjand dupa puterile lui x, relatia (6.46) devine:
(K - 4)x2 - (a + b)Kx + abK = 0 (6.47)
Rezulta:
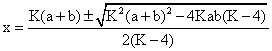 (6.48)
(6.48)
Semnificatie fizica are numai solutia in care se considera radicalul cu semnul minus, adica solutia in care x < a, respectiv x < b.
Cercetand ![]() 50.
50.
Se observa ca in re
Re
N2O4 Û 2NO2 n > 0
N2 + 3H2 Û 2NH3 n < 0
2CH4 Û C2H2 + 3H2 n > 0
Se considera re
N2O4 Û 2NO2
I a 0 moli
R x 0 moli
E a-x 2x moli
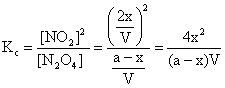 (6.49)
(6.49)
 (6.50)
(6.50)
Presiunile partiale sunt:

Kp devine:
 (6.52)
(6.52)
 (6.53)
(6.53)
In unele sisteme aflate in echilibru chimic, pot avea loc
simultan doua sau mai multe re
Un exemplu il constituie re
CO2 + H2 Û CO + H2O
cu:
 (6.54)
(6.54)
In afara
2H2O Û 2H2 + O2
2CO2 Û 2CO + O2
Constantele de echilibru ![]() , respectiv
, respectiv ![]() pentru
pentru
 (6.55)
(6.55)
 (6.56)
(6.56)
Echilibrul se stabileste astfel incat presiunea partiala a oxigenului in cele doua echilibre sa fie identica. Din relatiile (6.55) si (6.56) rezulta:
 (6.57)
(6.57)
Rezulta:
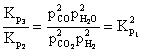 (6.58)
(6.58)
Deci:
 (6.59)
(6.59)
Interdependenta echilibrelor este utila pentru studiul echilibrelor, deoarece in multe cazuri relatiile care se pot stabili intre diversele constante de echilibru permit calcularea unor constante de echilibru care nu se pot obtine cu precizie prin masuratori directe.
Pentru re
Un exemplu de echilibru omogen in faza lichida il
constituie re
CH3COOH + C2H5OH Û CH3COOC2H5 + H2O
I a b 0 0 moli
R x x 0 0 moli
E a-x b-x x x moli
Re
Constanta de echilibru Kc este:
![]()
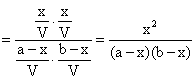 (6.60)
(6.60)
Constanta de echilibru Kx este:
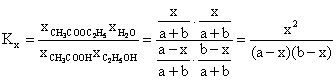
Dezvoltand relatia (6.60) sau (6.61) dupa puterile lui x se obtine:
(K - 1)x2 - K(a + b)x + Kab = 0 (6.62)
De unde:
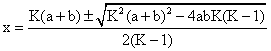 (6.63)
(6.63)
Insa in cele mai multe cazuri, solventul influenteaza
puternic concentratiile re
D
In expresia constantei de echilibru K vor apare
presiunile partiale de echilibru ale componentilor gazosi ai sistemului, iar
ceilalti componenti sunt exprimati prin
Uneori se intampla ca anumiti re
a) Un exemplu de echilibru eterogen il constituie re
CaCO3 Û CaO + CO2
Constanta de echilibru ia forma:
![]() (6.64)
(6.64)
Deoarece Kp este constant la o temperatura data, rezulta ca fiecarei temperaturi ii corespunde o valoare definita a presiunii CO2 numita presiune de disociere.
Re
Deci:
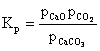 (6.65)
(6.65)
unde: pCaO, ![]() = presiunile partiale de
echilibru in faza gazoasa a CaO, respectiv CaCO3.
= presiunile partiale de
echilibru in faza gazoasa a CaO, respectiv CaCO3.
Vaporii de CaO si CaCO3 se gasesc in echilibru cu corpurile solide respective, iar presiunile lor de echilibru vor fi egale cu presiunile de vapori la temperatura respectiva si fiind foarte mici se inglobeaza in constanta de echilibru si se ajunge la relatia (6.64).
La temperatura constanta se poate scrie izoterma de disociere (6.2):
![]() = -RTlnKp = -RTln
= -RTlnKp = -RTln![]() (6.66)
(6.66)
unde:
![]() =
= ![]() -
- ![]() = -RTln
= -RTln![]() (6.67)
(6.67)
Din relatia (6.67) se poate calcula presiunea de echilibru sau presiunea de disociere dupa relatia:
![]() (6.68)
(6.68)
Conform relatiei (6.68) se observa ca presiunea de disociere creste cu temperatura.
Descompunerea termica a unui carbonat are loc cand presiunea de echilibru este mai mare decat presiunea exterioara. Pentru a provoca disocierea termica a unui carbonat la presiune normala, trebuie ridicata temperatura pana ce presiunea de disociere egaleaza presiunea atmosferica.
b) Un alt tip de echilibru eterogen este cel de disociere a cristalohidratilor:
Na2SO4∙10H2O Û Na2SO4 + 10H2O
Constanta de disociere a
![]() (6.69)
(6.69)
Substantele a caror presiune de descompunere (presiunea vaporilor de apa in echilibru la o anumita temperatura) este mai mica decat presiunea partiala a vaporilor de apa din atmosfera se numesc higroscopice. Exemple: CaCl2∙H2O; KOH∙H2O.
D
c) 3Fe + 4CO2 Û Fe3O4 + 4CO
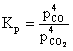 (6.70)
(6.70)
d) 3Fe + 4H2O Û Fe3O4 + 4H2
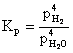 (6.71)
(6.71)
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3401
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved