| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Un amestec format din doi componenti miscibili in faza lichida va contine doua faze. Varianta sistemului va fi: l = 2 - 2 + 2 = 2.
Daca se mentine constanta temperatura sau presiunea, sistemul devine monovariant.
Amestecul binar este format din componentii 1 si 2. Amestecul este ideal, supunandu-se legilor solutiilor diluate daca fortele de interactiune dintre moleculele identice 1 - 1 sau 2 - 2 sunt egale cu cele care se exercita intre moleculele diferite 1 - 2.
Aplicand legea lui Raoult (5.36) pentru fiecare component, se obtine:
![]() (5.94)
(5.94)
si
![]() (5.95)
(5.95)
unde: ![]()
![]() = presiunile partiale de vapori ale componentilor puri 1 si 2;
= presiunile partiale de vapori ale componentilor puri 1 si 2;
p1, p2 = presiunile partiale de vapori ale componentilor deasupra amestecului;
x1, x2 = fractiile molare ale componentilor.
Conform legii lui Dalton (2.30), presiunea totala de vapori a solutiei ideale este egala cu suma presiunilor partiale:
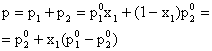 (5.96)
(5.96)
Relatia (5.96) arata ca presiunea totala de vapori a solutiei este functie liniara de compozitie (x1). Reprezentarea grafica a presiunilor partiale p1 si p2 precum si a presiunii totale p in functie de compozitia fazei lichide x1 este prezentata in fig. 5.2.
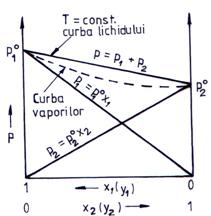
Fig. 5.2. Variatia presiunii de vapori pentru un amestec de lichide ideale la temperatura constanta
Compozitia fazei gazoase (de vapori) in echilibru cu amestecul lichid, exprimata prin fractiile molare y1 si y2 ale celor doi componenti difera de cea a amestecului lichid:
![]() (5.97)
(5.97)
![]() (5.98)
(5.98)
Din relatia (5.97) rezulta:
![]() (5.99)
(5.99)
Inlocuind valoarea lui x1 din relatia (5.96) in relatia (5.99):
![]() (5.100)
(5.100)
se obtine:
![]() (5.101)
(5.101)
Explicitand in relatia (5.101) presiunea totala, rezulta:
![]() (5.102)
(5.102)
care reprezinta ecuatia
curbei hiperbolice cuprinsa intre punctele ![]() si
si ![]() reprezentata in fig. 5.2. prin
curba intrerupta, numita curba vaporilor. Curba continua p se numeste curba
lichidului, in functie de compozitia fazei lichide. Intre curba vaporilor
si curba lichidului coexista cei doi componenti in cele doua faze. In zonele
exterioare curbelor de echilibru, amestecul este monofazic si bicomponent.
reprezentata in fig. 5.2. prin
curba intrerupta, numita curba vaporilor. Curba continua p se numeste curba
lichidului, in functie de compozitia fazei lichide. Intre curba vaporilor
si curba lichidului coexista cei doi componenti in cele doua faze. In zonele
exterioare curbelor de echilibru, amestecul este monofazic si bicomponent.
Raportul fractiilor molare a compozitiei fazei de vapori este:
![]() (5.103)
(5.103)
Se observa ca raportul y1/y2 este
mai mare decat raportul x1/x2 d![]() >
> ![]() , adica
faza gazoasa este mai bogata in componentul 1 decat faza lichida, d
, adica
faza gazoasa este mai bogata in componentul 1 decat faza lichida, d
Daca ![]() >
> ![]() atunci faza de vapori va fi mai bogata in
componentul 2. In general, faza de vapori este mai bogata in componentul mai
volatil.
atunci faza de vapori va fi mai bogata in
componentul 2. In general, faza de vapori este mai bogata in componentul mai
volatil.
Gradul de imbogatire al unui component in faza de vapori este dat de raportul:
 (5.104)
(5.104)
care se numeste factor de separare.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1249
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved