| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Folosind aceleasi unitati de masura pentru caldura si lucru mecanic, principiul I are urmatoarea expresie matematica pentru procese ciclice:
Q = - W sau ![]() (4.10)
(4.10)
conform careia caldura primita de sistem este egala cu lucrul mecanic efectuat.
Relatia (4.10) sta la baza inexistentei unui perpetuum mobile de speta intai conceput ca o masina capabila sa produca energie din nimic.
Formularea matematica a principiului intai pentru procese neciclice este:
Q + W sau ![]() (4.11)
(4.11)
unde: ΔU = variatia de energie interna:
ΔU = U2 - U1 (4.12)
1 - starea initiala; 2 - starea finala.
Energia interna (U) contine energia de translatie, de rotatie, de vibratie a moleculelor si atomilor, energia potentiala si cinetica a electronilor, energia corespunzatoare fortelor intermoleculare si intramoleculare, etc.
Ecuatia (4.11) este pentru un proces finit. In cazul unui proces elementar aceasta ecuatie poate fi scrisa sub forma:
![]() (4.13)
(4.13)
Energia interna este o functie de stare, in timp ce Q si W nu sunt deoarece depind de calea urmata de sistem.
Deci principiul I afirma ca energia (caldura si lucrul mecanic) schimbata de un sistem cu mediul exterior, provoaca modificarea energiei lui interne.
Un alt enunt al principiului I este: energia unui sistem izolat este constanta.
Daca in relatia (4.13) se expliciteaza lucrul de volum (4.6) se obtine:
![]() (4.14)
(4.14)
iar la volum constant:
dUV = dQV (4.15)
sau prin integrare:
ΔUV =QV (4.16)
Altfel spus: caldura absorbita de sistem la volum constant serveste la cresterea energiei sale interne.
Adesea este avantajos sa se formuleze principiul I al termodinamicii, alegand ca variabile de stare, presiunea si temperatura.
Se defineste o noua functie de stare, entalpia (H) care este functie de presiune, temperatura si compozitie: H=f(T,p,ni).
Entalpia are prin definitie expresia:
H = U + pV (4.17)
Entalpia reprezinta suma dintre energia interna si lucrul mecanic efectuat de sistem pentru a ocupa volumul V sub presiunea exterioara p.
Diferentiala entalpiei din relatia (4.17) este:
dH = dU + pdV + Vdp (4.18)
Inlocuind dU + pdV = dQ din relatia (4.14), se obtine formularea matematica a principiului I prin intermediul entalpiei:
![]() (4.19)
(4.19)
Mentinand presiunea constanta, rezulta:
dHp = dQp (4.20)
sau prin integrare:
Hp = Qp (4.21)
Relatia (4.21) arata ca: la presiune constanta, caldura absorbita (schimbata) de sistem serveste la cresterea entalpiei acestuia (este egala cu variatia entalpiei).
Diferentiala dH este o diferentiala totala:
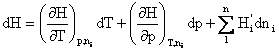 (4.22)
(4.22)
unde:  (4.23)
(4.23)
![]() =
entalpia molara partiala.
=
entalpia molara partiala.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1884
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved