| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Grupa I si II - Litiu, sodiu, potasiu, rubidiu, cesiu; beriliu, magneziu, calciu, strontiu si bariu
Caracteristicile generale ale elementelor
Elementele care formeaza aceste doua grupe sunt numite: metale alcaline cele din grupa I-a si metale alcalino-pamantoase cele din grupa a II-a. Cateva dintre proprietatile fizice asociate metalelor, duritate, un inalt punct de topire si punct de fierbere, lipsesc acestor metale, dar toate aceste metale au o buna conductibilitatea electrica (Tabelul 1.).
Tabelul 1. Proprietati selectate ale elementelor grupelor I-a si a II-a
|
Element |
Numar atomic |
Electroni din stratul exterior |
Densitate (g/cm3) |
P.t. (K) |
P.f. (K) |
Tarie/ stralucire |
|
Li |
2s1 | |||||
|
Na |
3s1 | |||||
|
K |
4s1 | |||||
|
Rb |
5s1 | |||||
|
Cs |
6s1 | |||||
|
Be |
2s2 | |||||
|
Mg |
3s21 | |||||
|
Ca |
4s2 | |||||
|
Sr |
5s2 | |||||
|
Ba |
6s2 |
|
In tabelul 1. se vede foarte usor ca metalele din grupa a II-a sunt mai dense, mai dure si au un punct de topire si un punct de fierbere mai ridicat decat metalele din grupa I.
S-a discutat anterior despre taria legaturii metalice, si anume ca taria legaturii depinde in general de raportul dintre numarul de electroni capabili sa formeze legaturi si greutatea atomica. Cu cat mai mare este raportul cu atat mai puternica este legatura dintre atomii metalelor. In cazul metalelor pretranzitionale acest raport este mic si minim in grupa I, fiind totusi o legatura electronica. Legatura metalica este mai puternica in grupa II, dar existand doi electroni de legatura disponibili, totusi metalele sunt relativ moi si au un punct scazut de topite si fierbere. Duritatea, punct de topire si punct de fierbere descresc constant in grupa I, Li→Cs, puterea legaturii metalice descreste cu crestere razei atomice. Aceasta schimbare nu este bine marcata in grupa II, dar mentionam ca beriliu, in masura mai mica, magneziu care este metal mai dur, denota ca au o greutate atomica mica; aceste proprietati, cuplate cu densitatea redusa a acestora, determina cateva dintre aplicatiile tehnologice importante.
Tabelul 2. Alte proprietati ale elementelor grupelor I-a si a II-a
|
Element |
Energia de ionizare (kj/mol) |
Raza metalica (nm) |
Raza ionica (nm) |
Caldura de vaporizare la 298 K (kj/mol) |
Energia de hidratare a ionului gazos (kj/mol) |
EQ (v) |
|
Li | ||||||
|
Na | ||||||
|
K | ||||||
|
Rb | ||||||
|
Cs | ||||||
|
Be | ||||||
|
Mg | ||||||
|
Ca | ||||||
|
Sr |
5s2 |
| ||||
|
Ba |
6s2 |
Tot in prima parte a acestui curs s-a discutat despre schimbarea energiei de ionizare a elementelor legata de pozitia in grupe si perioade. Aceste date sunt prezentate in tabelul.2.
Formarea ionilor
Se poate discuta despre elemente electropozitive care au o energie de ionizare relativ scazuta si in consecinta sunt foarte reactive. Schimbarea entalpiei ceruta pentru proces M(metal)→M+(g) pentru grupa I si M(metal)→M2+(g) pentru grupa a II-a, este maxima in partea de sus a fiecarei grupe si este asa deoarece nu ne surprinde sa gasim litiul, beriliul si intr-o anumita masura magneziu sub forma de cativa compusi covalenti. Cei mai solizi componenti al elementelor din grupa I-a si II, au totusi structura ionica si proprietati asociate cu o astfel de structura, un inalt punct de topire si punct de fierbere, solubile in apa mai repede decat in solventi organici si conductibilitate electrica in topitura.
Ionii in solutie
Energia de hidratare (entalpia de hidratare), scade, de asteptat, descrescand in fiecare grupa si au ioni mai multi in grupa II decat in grupa I. Solubilitatea sarurilor din grupa I si II este determinata de balanta dintre energia de structura, energia de hidratare si entropia se schimba in tranzitie de la solid la solutie, fiind posibile putine generalizari. Astfel incarcatura inalta si razele ionice scazute tind sa produca insolubilitate (sarea de litiu, beriliu si magneziu), in mod special cei cu incarcatura dubla de anioni ca de ex. carbonatul). Pe o alta scala incarcatura scazuta si razele largi de asemenea produc o solubilitate scazuta (sarurile de potasiu, rubidiu si cesiu) contin multi anioni la fel ca anionul de tetrafenilborat. De regula, sarurile elementelor din grupa a I si cele mai multe saruri din grupa II, contin o simpla sarcina pozitiva, dar pentru multe saruri din grupa a II incarcate cu dubla sau tripla incarcatura pozitiva ca insolubilitatea este adesea observata.
Tendinta descrescanda de formare de saruri care contin apa de cristalizare (in grupa este descrescatoare) este de asemenea in stransa legatura cu scaderea energiei de hidratare. De exemplu, sulfatul de sodiu cat si carbonatul de sodiu formeaza hidrati, dar nici unul din corespondentii sarii de potasiu nu formeaza hidrati; sulfatii elementelor din grupa II arata un comportament similar sulfurii de magneziu MgSO4 7H2O, CaSO4 2 H2O, BaSO4. Totusi, pentru elementele din grupa I si II tendinta ionica este data de metalele respective, fiind cea a ionilor M+ pentru elementele din grupa I si M+2 pentru cele din grupa II. Dupa cum stim cele doua elemente din capul grupelor, litiul si beriliu au tendinta de a forma compusi covalenti; ionul de beriliu pentru ca are raza atomica mica si dubla incarcare, are de asemenea anumite proprietati specifice in solutie care se vor examina pe parcurs.
Stare naturala si extractie.
Metalele alcaline de la grupa I se gasesc in principiu sub forma de clorhidrati (in scoarta terestra si in apa de mare) precum si sulfati si carbonati. Litiu se prezinta ca un mineral aluminiusilicat: spodumen si lepidolita. Metalele din grupa II (de la beriliu pana la bariu), beriliu cel mai rar, se prezinta ca aluminiusilicat, numit beryl; magneziu se gaseste sub forma de carbonati, impreuna cu calciu, ca dublu carbonat - dolomita. Calciu, strontiu si bariu in natura se prezinta sub forma carbonatilor; carbonatul de calciu apare foarte mult ca piatra calcaroasa. Caracteristicile generale ale tuturor acestor elemente nu permit metodele de extractie pe baza de apa (hidrolitice). Pentru metalele cele mai usoare si mai putin volatile (Li, Na, Be, Mg, Ca), se foloseste electroliza sarurilor topite (a clorurilor), sau un amestec de saruri topite. Metalele mai grele si mai mult volatile in fiecare grupa se pot obtine in mod similar prin electroliza, dar de obicei mult mai convenabil este prin oxidarea clorurii; reactia generala este :
 .
.
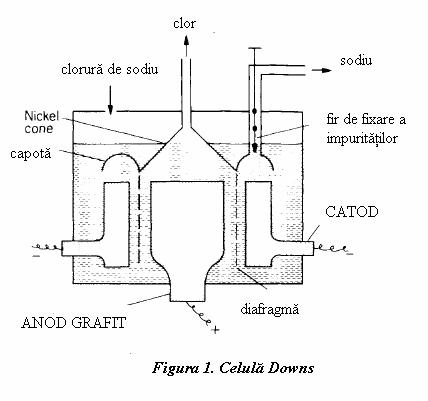
Potasiu se obtine incalzind clorura de potasiu cu sodiu, bariul prin reductia oxidului de bariu cu aluminiu. Sodiul este important in multe procese tehnice si de aceea se prepara in cantitati considerabile. Acestea se obtin in special prin electroliza clorurii de sodiu topite, utilizand procedeul celulelor, cunoscut in literatura de specialitate drept "DOWNS CELL technology". In aceste celule de electroliza anodul, din grafit, este cilindric si inconjurat de diafragme subtiri din otel iar catodul cilindric este concentric (pentru ca este tot din otel). Solutia electrolitica este de obicei un amestec de clorura de sodiu si clorura de calciu; ultima se adauga pentru a reduce temperatura de topire a clorurii de sodiu la aproximativ 800 K (se elibereaza calciu si sodiu in urma reactiei). Distanta dintre anod si catod se pastreaza cea mai mica posibila pentru a reduce rezistenta: caldura dezvoltata de curentul electric mentine temperatura din celula. Clorul se formeaza pe suprafata anodului, eliberandu-se in conul de nichel care permite colectarea. Sodiul este eliberat la catod, trecerea lui spre anod fiind blocata de diafragma; sodiul topit se colecteaza sub capacul circular fiind necesara impingerea lui cu o tija. Calciu fiind nemiscibil cu sodiul si mult mai gros, poate repede sa se separe de sodiul topit. Anodul de grafit se consuma si se inlocuieste tot timpul.
Utilizare
Litiul se foloseste in sticla securizata, iar mult studiata a fost si este utilizarea ca si catod in bateriile cu densitate energetica inalta. Mult sodiu este folosit in aliaj cu plumbul, care in reactie cu clorura de etil produce tetraetilplumb, ca aditiv antiexplozie in benzina. Sodiu este utilizat pentru producerea peroxidului de sodiu si hidroxidului de sodiu. Sodiu lichid, cu inalta conductibilitate termica, este utilizat ca lichid de schimb termic in schimbatorii de caldura din reactoarele nucleare si in liniile de conductori electrici care utilizeaza sodiu.
Potasiu e utilizat pentru a produce peroxid de potasiu care reactioneaza cu apa si dioxid de carbon pentru a rezulta oxigen pur,
![]()
este folosit ca sursa de oxigen de urgenta (ex.: in mine si submarine). Aliajul sodiu-potasiu are la fel proprietati termice ca si sodiul lichid, cu avantajul ca sunt lichide la temperatura obisnuita. Beriliu este adaugat cuprului pentru a produce un aliaj cu inalta rezistenta la uzura; este utilizat pentru resorturi conducatoare de curent si aparate de siguranta care nu produc scantei. Este de asemenea utilizat ca moderator de neutroni si reflector in reactoarele nucleare. O mare cantitate de magneziu este utilizata in aliaj de metal usor; aceste utilizari include extractia titanului si indepartarea oxigenului si sulfului de la otel; calciu se utilizeaza in mod similar.
Importanta biologica
Ionii de sodiu si potasiu se gasesc in toate celulele animalelor, in general concentratia de ioni de potasiu in celule este mai mare decat sodiu. In multe celule, aceasta diferenta de concentratie este mentinuta prin pompa sodiului , un proces a carui energie este furnizata de hidroliza ATP-ului (adenozintrifosfatul). Difuzia excesului de ioni de potasiu afara din peretele celulei da o retea negativa (din cauza prezentei anionilor) si se creeaza o diferenta de potential intre exteriorul si interiorul peretelui celulei.
Intr-o celula nervoasa, un schimb de moment al permeabilitatii peretelui celulei fata de ioni de sodiu poate schimba potentialul celulei, si acest schimb produce un impuls electric asociat cu un nerv. Abilitatea organismelor vii de a diferentia similaritatea chimica intre ionii de sodiu si potasiu trebuie sa depinda de diferentele dintre ioni in solutie apoasa. In esenta, aceasta diferenta este data de dimensiune ionilor hidratati, ce inseamna diferenta dintre forta electrostatica de atractie intre cationii hidratati si cei incarcati negativ din membrana celulara; astfel membrana este capabila de a accepta micii ioni de sodiu si sa refuze ionii mari de potasiu. Astfel de mecanism de selectare opereaza intr-un alt proces de selectare de ioni, definit drept rasini schimbatoare de ioni.
Toate organismele au nevoie de magneziu. In plante, complexul clorofilian de magneziu este primul agent al fotosintezei. In animale, magneziu are functie de enzima activatoare; enzime care catalizeaza hidroliza ATP mentionate mai sus reprezinta un important exemplu.
Calciu are un rol important in constructia si intarirea organismului viu, deoarece principala lui abilitate este de a conecta materialele ca contin fosfat. Ionii de calciu in celule au un rol vital in contractia musculara.
Reactiile metalelor
In general, metalele din grupa I si II se pot combina, mai mult sau mai putin rapid, cu multe elemente mai putin electropozitive. Reactivitatea fata de majoritatea reactantilor, ca de exemplu oxigen uscat sau brom uscat, creste pe masura ce dimensiunea atomului creste si energia de ionizare scade. Totusi, atunci cand reactioneaza cu elemente nemetalice foarte mici in dimensiune, ca de exemplu carbonul sau azotul, inversa este cea valabila, deoarece anionul foarte mic, la fel ca si cationul foarte mic, produsi in reactie, determina formarea unei retele cristaline puternice. Energia retelei cristaline este suficient de mare pentru a compensa inalta energie de ionizare necesara formarii acestor specii. In consecinta elementele grupei a a II-a formeaza nitriti, iar dintre metalele grupei I-a doar litiu este capabil de asa ceva.
Majoritatea metalelor din grupele I-a si a II-a reactioneaza cu apa, respectiv cu orice solutie apoasa conducand la formarea efectiva a ionilor M+ pentru elementele grupei I-a si M2+ pentru elementele grupei a II-a:
Grupa 1: 2M + 2H2O → 2M + (aq) + 2OH- + H2
Grupa II: M + 2H2O → M2 + (aq) + 2OH- + H2
Reactiile cu apa sunt insumate in Tabelul.3. Deoarece metalele sunt puternici agenti reducatori, nu pot fi preparate in solutii apoase.
Metalele alcaline au o proprietate interesanta, cea de a se dizolva in unii solventi neaposi precum amoniacul, pentru a rezulta solutii colorate limpezi, care sunt agenti reducatori excelenti si sunt des folositi si in chimia organica.
Tabelul 3. Reactivitatea elementelor grupei I-a si a II-a
|
Element |
Li |
Na |
K |
Rb |
Cs |
|
Conditii de reactie |
Toate reactioneaza cu apa pt. a produce baze (MOH) Intensitatea reactiei creste de la Li la Cs Concentratia bazei creste de la Li la Cs |
||||
|
Caracteristicile bazice ale produsilor |
|||||
|
Element |
Be |
Mg |
Ca |
Sr |
Ba |
|
Conditii de reactie |
Nu reactioneaza cu apa |
Foarte incet cu apa |
Reactioneaza cu apa. Intensitatea reactiei creste |
||
|
Caracteristicile bazice ale produsilor |
Be(OH) amfoter |
MgO insolubil |
putin solubil M(OH) Solubil |
||
|
Taria bazei creste de la Li la Cs |
|||||
De exemplu sodiul formeaza in amoniac lichid o solutie albastru intens si de aceea electronul (3s) de la fiecare atom de sodiu se presupune a fi oarecum asociat cu amoniacul solvent, astfel incat sistemul este
Na+(solvent)+ e- (solvent)
Solutia este instabila energetic, sodiul reactionand incet cu amoniacul astfel :
2Na + NH3 → 2NaNH2 + H2↑
amidura de sodiu (sodamida)
(reactie care poate fi scrisa ca: 2e- + 2NH3→ 2NH2 + H2)
Aceasta reactie este catalizata de ioni ca fier(III) si poate fi comparata cu reactia cu apa:
2Na + 2H2O → 2NaOH + H2↑
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3206
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved