| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Ionizarea apei; pH
![]()
In anumite conditii, apa se scindeaza in doua fragmente, numite ioni si anume unul pozitiv, ionul de hidrogen (sau proton) si unul negativ, ionul de hidroxil. Aceasta este de fapt o reprezentare schematica a unui fenomen care are loc intre doua molecule de apa in care una joaca rolul de acceptore de proton (baza) iar cealalta de donatoare de proton (acid)

Disocierea apei este un proces de echilibru si a carei constanta de echilibru (IK) este:
![]() (ec.
2.1)
(ec.
2.1)
parantezele drepte indicand concentratia in moli la litru.
Deoarece concentratia ionilor de H+ si HO- este foarte mica (1x10-7 M la 25 0C) iar concentratia apei in forma pura este de 55,5 M, rezulta ca concentratia molara a apei nu este influentata de ionizarea ei, astfel incat aceasta poate fi considerata constanta. Introducand acum aceasta constanta in expresia constantei de echilibru rezulta:
![]() (ec.
2.2)
(ec.
2.2)
Se defineste astfel o noua constanta, produsul ionic al apei.
![]() (ec. 2.3)
(ec. 2.3)
Pentru temperatura de 25 0C, valoarea acestei constante este 1,0x10-14.
Pentru a simplifica modul de exprimare a concentratie s-a recurs la definirea termenului de pH, prescurtare a expresie "pondus hidrogenii" (ponderea in hidrogen), drept logaritmul zecimal cu semn schimbat al concentratiei ionilor de hidrogen:
![]() (ec.
2.4)
(ec.
2.4)
In cazul apei pure, concentratiile ionilor de hidrogen si de hidroxil fiind egale, rezulta ca la 25 0C, pentru o solutie neutra [H+] = [HO-] = 1.10-7 M, deci pH va avea valoarea 7. Pornind de la aceasta constanta, biochimistul danez S.P.L. Srensen defineste scara de pH, care permite corelarea concentratiei ionilor de hidrogen, respectiv a celor de hidroxil, pentru orice solutie apoasa.
|
[H+], M | |||||||||||||||
|
pH | |||||||||||||||
|
HO-], M |
|
In functie de valoarea pH-ului solutiile au fost clasificate in trei categorii:
Solutii acide pH < 7
Solutii neutre pH = 7
Solutii bazice pH > 7
In tabelul de mai jos sunt redate valorile pH-ului pentru anumite sisteme din natura si organismele vii.
|
Lichide |
pH |
Lichide biologice |
pH |
|
Apa de mare (variabil) |
Plasma sanguina | ||
|
Lapte de vaca |
Lichid interstitial | ||
|
Suc de rosii |
Lichid intracelular muschi ficat | ||
|
Suc de grapefruit |
Suc gastric | ||
|
Bauturi nealcolice (cola) |
Suc pancreatic | ||
|
Suc de lamaie |
Saliva | ||
|
Vin |
Urina |
In consecinta devine fireasca clasificarea substantelor, respectiv a solutiilor lor apoase, in acizi si baze.
1. Acizi si baze
Cea mai generalizata definitie a acizilor si bazelor a fost enuntata de G. N. Lewis, care defineste drept acid substanta capabila sa accepte o pereche de electroni, iar baza substanta capabila sa cedeze o pereche de electroni. Cu toate acestea, in descrierea sistemelor apoase diluate, cum sunt de fapt si sistemele biologice, se utilizeaza inca frecvent definirea notiunilor de acid si baza conform teoriei lui J. N. Brnsted si T. M. Lowry. In definirea lor acidul este o substanta capabila sa cedeze protoni, respectiv baza substanta capabila sa accepte protoni.
Dupa cum se observa, intr-o astfel de reactie trebuie sa existe intotdeauna doi parteneri: acidul si baza conjugata. Exemplificam mai jos cateva astfel de perechi.
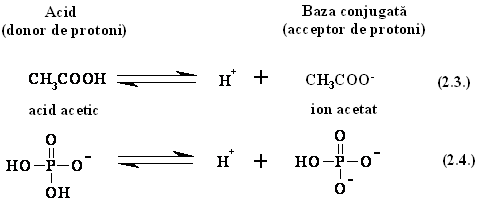
In solutii apoase diluate, disocierea (ionizarea) unui acid implica transferarea unui proton provenind din acid la o molecula de apa:
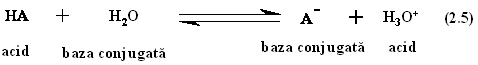
Se observa ca baza conjugata a unui anumit acid va purta intotdeauna o sarcina neta mai negativa cu o unitate comparativ cu acidul pereche. In sistemele biologice sunt intalnite perechi acido-bazice slabe, de exemplu aminoacizi, nucleotide, fosfolipite, etc. Acizii si bazele slabe nu sunt complet disociate in solutii, spre deosebire de acizii si bazele tari care sunt complet disociate. In consecinta, doar o parte din moleculele prezente in solutiile acizilor slabi sau bazelor slabe sunt ionizate, sistemul ajungand la un moment dat la o stare de echilibru. Considerand reactia (2.5), la echilibru se poate determina asa numita constanta de disociere (ec. 2.5), concentratiile exprimate in paranteze patrate [X], fiind in moli per litru:
![]()
![]() (ec.
2.5)
(ec.
2.5)
Deoarece in cazul sistemelor diluate concentratia apei ramane practic aceeasi, valoarea concentratiei se poate trece in stanga, noua constanta fiind definita drept constanta de aciditate Ka (ec. 2.6):
![]() (ec. 2.6)
(ec. 2.6)
respectiv, ca si in cazul conceptului de pH, prin logaritmare si schimbarea semnului se defineste notiunea de pKa (ec. 2.7):
pKa = -log Ka (ec. 2.7)
Aplicand logaritmarea si proprietatile logaritmilor in expresia lui Ka (ec. 2.6, respectiv 2.8 si 2.9) si rearanjand temenii pentru ca expresia sa devina pozitiva, aceasta se transforma in ecuatia 2.10.
![]() (ec.
2.8)
(ec.
2.8)
![]() (ec.
2.9)
(ec.
2.9)
![]() (ec.
2.10)
(ec.
2.10)
Asa cum rezulta din studiul ecuatiei 2.10, se observa ca valori mici ale lui pKa le vor avea acizii tari, care in solutie vor tinde la o valoare a concentratiei acidului [HA] catre zero, cedand astfel foarte usor protonii in solutie.
Daca vom exprima acum pH-ul din ecuatia 2.10, aceasta se transforma in bine cunoscuta expresie a ecuatiei lui Henderson-Hasselbalch (ec. 2.11):
![]() (ec.
2.11)
(ec.
2.11)
ecuatie deosebit de importanta pentru studiu cantitativ al tuturor sistemelor acido-bazice din sistemele biologice. Pe baza acestei ecuatii se poate calcula pH-ul oricarei solutii de acid, daca se cunoaste constanta sa de aciditate, prin simpla determinare a concentratiilor acidului si bazei sale conjugate din solutie. Prin simpla observare a ecuatiei Henderson-Hasselbalch, se observa cateva reguli simple care permit economie de timp la calcule:
la orice pH peste valoarea pKa, molecula va fi incarcata mai mult negativ;
la orice pH sub valoarea pKa, molecula va fi incarcata mai pozitiv;
Exemplificarea grafica simpla a celor enuntate mai sus este redata in figura 2.5.
 Figura 2.5.
Figura 2.5.
La orice pH mai mare cu 1,0 unitate peste valoarea pKa, putem considera ca molecula se afla intr-o singura stare, deoarece deja peste 90% din molecule sunt ionizate. De aici deriva importanta pKa-ului pentru diferiti acizi care participa la sisteme vii. In tabelul 2.1. sunt prezentate perechi acido-bazice provenind de la aminoacizi.
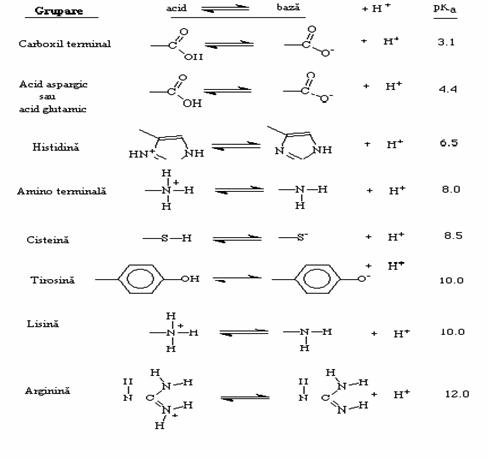
Tabelul 2.1.
Valori pKa pentru diferite grupari functionale biochimice
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 8416
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved