| CATEGORII DOCUMENTE | ||
|
||
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
LEGILE GAZELOR
Starea gazoasa este una dintre starile de agregare a materiei, care se caracterizeaza prin faptul ca particulele constituente, atomi sau molecule, se gasesc la distante mari unele de altele, la care interactiunile reciproce sunt neglijabile, spre deosebire de starea lichida sau solida, in care particulele se gasesc aproape in contact. Din acest motiv, starea gazoasa a materiei este cea mai putin densa.
Atomii sau moleculele gazului au o miscare haotica perpetua, cu viteze
medii ce cresc cu marirea temperaturii. In miscarile lor rectilinii,
particulele gazului se ciocnesc intre ele, schimbandu-si directia si viteza de
deplasare. Intrucat ciocnirile sunt elastice, la aceeasi temperatura, energia
cinetica a tuturor particulelor este
Un gaz are tendinta de a ocupa tot volumul pe care il are la dispozitie. Prin urmare, un gaz nu are volum si nici forma proprie.
Moleculele sau atomii gazului se ciocnesc si de peretii vasului in care
se gaseste gazul. Intrucat, in conditii obisnuite, frecventa ciocnirilor este
extrem de mare, forta cu care particulele gazului apasa pe peretii vasului este
practic
Gazele se numesc ideale sau perfecte, daca particulele lor pot fi considerate punctiforme, iar interactiunile dintre ele sunt nule. In aceste conditii, legile care caracterizeaza starea gazoasa au forma cea mai simpla. In situatia in care dimensiunile particulelor si interactiunile dintre ele nu pot fi neglijate, gazele se numesc reale. De obicei, gazele reale, la temperatura suficient de ridicata si presiune suficient de scazuta, au comportare de gaz perfect.
5.1. Legea transformarilor izoterme (Boyle-Mariotte)
La temperatura
pV = k (4.1)
in care: p este presiunea gazului, V - volumul gazului.
Legea Boyle-Mariotte se poate scrie si sub forma:
pV = p1V1 (4.2)
in care p1 si V1 reprezinta presiunea, respectiv volumul gazului intr-o noua stare.
Daca se reprezinta grafic ecuatia (4.1) se obtine o familie de hiperbole echilatere (figura 4.3), corespunzatoare diferitelor temperaturi (T1 > T2 > T3). Curbele T1, T2 si T3 se numesc izoterme.
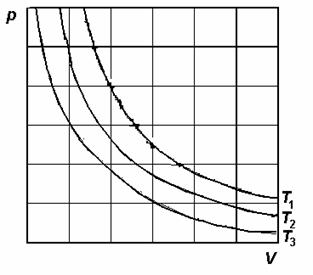
Fig. 5.1. Legea Boyle-Mariotte p = kV-1, parametrul k este functie de temperatura.
O astfel de comportare a gazelor ideale se explica astfel: prin comprimare (micsorarea volumului) distantele dintre particulele gazului devin mai mici. In consecinta, numarul de ciocniri ale particulelor de gaz cu peretele vasului creste, ceea ce inseamna cresterea proportionala a presiunii.
Legea Boyle-Mariotte se aplica in domeniul presiunilor nu prea ridicate si la temperaturi nu prea scazute, adica in conditiile in care un gaz poate fi considerat ideal.
5.2. Legea transformarilor
izobare (Gay-Lussac) se
refera la variatia volumului unui gaz functie de temperatura, la presiune
La presiune
Relatia care exprima legea transformarilor izobare poate fi redata prin ecuatia:
V = Vo(1+at (4.3)
in care: V este volumul de gaz la temperatura t, Vo - volumul de gaz la 0 C, a - coeficientul de dilatare a gazelor (a
Pe scara Kelvin a temperaturilor (T - temperatura termodinamica, in K):
T = 273,16 + t = To + t (4.4)
astfel incat relatia (4.3) devine:
![]() (4.5)
(4.5)
Relatia (4.5) poate fi scrisa sub forma:
![]() (4.6)
(4.6)
Reprezentarea grafica a relatiei care exprima legea transformarilor izobare (V = k'T) este o dreapta care intersecteaza abscisa in punctul T = 0 (figura 5.1). Dreptele corespunzatoare diferitelor presiuni se numesc izobare.
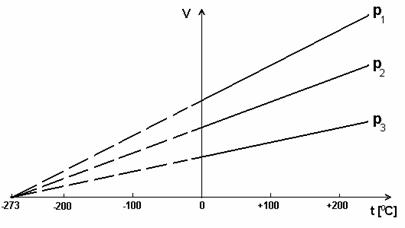
Fig. 5.2. Legea transformarilor izobare.
Din punct de vedere cinetic, comportarea
gazului ideal in conditii izobare se explica astfel: daca gazul se incalzeste,
agitatia termica este intensificata astfel incat, pentru a mentine presiunea
5.3. Legea transformarilor izocore (Charles) se refera la variatia presiunii unui gaz functie de temperatura, la volum constant:
La volum constant, marirea temperaturii cu 1 C duce la cresterea presiunii cu 1/273,16 din presiunea pe care o are gazul la 0 C.
Legea transformarilor izocore este exprimata de relatia:
p = po(1+at (4.7)
in care p este presiunea gazului la temperatura t, po - presiunea gazului la 0 C, a - coeficientul de dilatare a gazelor (a
Pe scara termodinamica a temperaturii, relatia (4.7) devine:
![]() (4.8)
(4.8)
5.4. Ecuatia de stare a gazelor ideale
Comportarea gazelor ideale este descrisa de ecuatia:
![]() (4.9)
(4.9)
Ecuatia de stare a gazelor ideale poate fi scrisa si sub forma:
pV = nRT (4.10)
in care: n este cantitatea de substanta (numarul de moli de gaz), R - constanta universala a gazelor.
Pentru 1 mol de gaz, ecuatia (4.10) devine:
pVM = RT (4.11)
in care VM este volumul molar (volumul ocupat de 1 mol de gaz la temperatura T si presiunea p).
In conditii normale de temperatura si presiune, volumul molar este VM = 22,414 L mol-1 = = 22,414 10-3 m3 mol-1.
R este o constanta universala independenta de natura gazului, care poate fi evaluata cu ajutorul ecuatiei (4.11). In conditii normale de temperatura si presiune se obtine:
![]() (4.12)
(4.12)
In Sistemul international de unitati po = 101.325 N m-2, VM = 22,414 10-3 m3 mol-1
iar To=273,16 K. Se obtine
R = 8,31447 J mol-1 K-1.
In cazul in care presiunea gazului este exprimata in atmosfere fizice (atm),
iar volumul in litri (L), pentru
5.5. Ecuatia lui Dalton se refera la amestecurile de gaze. Pentru un amestec de k gaze ideale, ecuatia de stare se scrie sub forma:
pV = (n1 + n2 + + nk)RT (4.13)
din care rezulta:
![]() (4.14)
(4.14)
Termenul ![]() reprezinta presiunea partiala a gazului i. Ecuatia (4.14) devine:
reprezinta presiunea partiala a gazului i. Ecuatia (4.14) devine:
p = p1 + p2 + . + pk (4.15)
Ecuatia (4.15) exprima legea lui
Presiunea totala a unui amestec de gaze este egala cu suma presiunilor partiale
5.6. Determinarea masei moleculare a gazelor
Conform legii lui Avogadro: volume egale de gaze, in aceleasi conditii de temperatura si presiune, contin un numar egal de molecule. O consecinta a legii lui Avogadro este faptul ca densitatea unui gaz este direct proportionala cu masa moleculara a gazului respectiv. Prin urmare, raportul densitatilor a doua gaze A si B este egal cu raportul maselor moleculare ale gazelor respective:
![]() (4.16)
(4.16)
Cunoscand ca masa moleculara medie a aerului este 28,99 se poate calcula masa moleculara a unui gaz, determinand experimental densitatea relativa a gazului fata de aer:
![]() (4.17)
(4.17)
in care d este densitatea fata de aer a gazului considerat, M - masa moleculara a gazului.
5.7. APLICATII:
5.1. Indicati sirul care cuprinde numai substante gazoase in conditii normale:
a) H2, O2, Cl2, He, Hg, H2O;
b) NH3, Ne, H2S, SO2, HF, I2;
c) HCl, H2S, Cl2, CO2, CH4, Ar;
d) H2, O2, Cl2, Br2, I2, N2;
e) CO2, CO, O2, SO2, CH4, H2O.
5.2. Care dintre urmatoarele afirmatii este falsa:
a) vaporizarea unei substante lichide este insotita de marirea considerabila a volumului;
b) gazele au densitate mult mai mica decat lichidele sau solidele, intrucat particulele componente ale gazelor sunt mult mai apropiate intre ele;
c) particulele care alcatuiesc un gaz ocupa tot spatiul care le sta la dispozitie, gazul luand forma vasului in care se afla;
d) gazele sunt mult mai usor compresibile decat lichidele sau solidele;
e) gazele exercita o presiune asupra peretilor vasului in care se gasesc.
5.3. Care dintre urmatoarele afirmatii este falsa?
a) gazele se amesteca in orice proportie;
b) gazele se pot comprima usor;
c) viteza de difuziune a gazelor creste odata cu masa moleculara a acestora;
d) presiunea exercitata de un gaz aflat intr-un volum inchis creste odata cu temperatura;
e) gazele pot strabate un material poros.
5.4. Intr-un amestec gazos format din 10 g H2, 70 g N2 si 110 g CO2, hidrogenul reprezinta, in % mol:
a) 50; b) 33,3; c) 5,26; d) 25; e) 10.
5.5. Un amestec de CO2 si CO are densitatea fata de aer 1,241. Sa se calculeze compozitia procentuala volumica. Se da masa moleculara medie a aerului: 29.
a) 25 % CO2 si 75 % CO; b) 75 % CO2 si 25 % CO; c) 20 % CO2 si 80 % CO;
d) 80 % CO2 si 20 % CO; e) 50 % CO2 si 50 % CO.
5.6. Expresia matematica a legii Boyle-Mariotte este data de relatia:
a) p1V1 = p2V2;
b) ![]() ;
;
c) ![]() ;
;
d) ![]() ;
;
e) T = 273 + t;
in care p, V, T si t reprezinta presiunea, volumul, temperatura absoluta (in K), respectiv temperatura gazului (in C).
5.7. Expresia matematica a legii lui Charles este data de relatia:
a) p1V1 = p2V2;
b) ![]() ;
;
c) ![]() ;
;
d) ![]() ;
;
e) T = 273 + t;
in care p, V, T si t reprezinta presiunea, volumul, temperatura absoluta (in K), respectiv temperatura gazului (in C).
5.8. Expresia matematica a legii lui Gay-Lussac este data de relatia:
a) p1V1 = p2V2;
b) ![]() ;
;
c) ![]() ;
;
d) ![]() ;
;
e) T = 273 + t;
in care p, V, T si t reprezinta presiunea, volumul, temperatura absoluta (in K), respectiv temperatura gazului (in C).
5.9. Ecuatia de stare a gazelor perfecte este data de relatia:
a) p1V1 = p2V2;
b) ![]() ;
;
c) ![]() ;
;
d) pV = nRT;
e) T = 273 + t;
in care p, V, n, T si t reprezinta presiunea, volumul, numarul de moli, temperatura absoluta (in K), respectiv temperatura gazului (in C).
5.10. Valoarea constantei generale a gazelor perfecte (R) depinde de unitatile alese. Care este valoarea corecta a lui R in cazul exprimarii in J mol-1 K-1?
a) 0,082; b) 62400; c) 8,31103; d) 8,31; e) 22,4.
5.11.
Un gaz cu volumul de 5 dm3 are presiunea de 2 atm. La ce volum
trebuie adus gazul, la temperatura
a) 2,5 dm3; b) 10 dm3; c) 4 dm3; d) 2 dm3; e) 1 dm3.
5.12.
Un gaz la presiunea de 1 atm este comprimat, la temperatura
a) 4 atm; b) 2 atm; c) 5 atm; d) 2,5 atm; e) 10 atm.
5.13. O cantitate de 5 g aer, in conditii normale de temperatura si presiune, ocupa un volum de 3,862 L. Care este masa moleculara medie a aerului?
(VM = 22,4 L mol-1)
a) 32; b) 16; c) 29; d) 28; e) 24.
5.14. Intr-o butelie de 12 L se gasesc 73,17 moli N2, la temperatura de 27 C. Care este presiunea gazului in butelie.
(
a) 75 atm; b) 150 atm; c) 100 atm; d) 13,5 atm; e) 300 atm.
5.15. Ce volum ocupa 2,9 g amestec gazos in conditii normale, daca densitatea fata de aer este 2,24. (Maer = 29; VM = 22,4 L/mol)
a) 1 L; b) 1 m3; c) 0,5 L; d) 2 L; e) 2,24 L.
5.16. Ce volum ocupa, in conditii normale, hidrogenul dintr-o butelie cu volumul de 10 L, daca la temperatura de 27 C presiunea sa este 150 atm?
a) 136,5 m3; b) 1365 m3; c) 1365 L; d) 2730 L; e) 273 L.
5.17.
Calculati
(Se dau: po = 1 atm; To=273 K; VM = 22,4 L/mol)
a) 0,82 L atm mol-1 K-1;
b) 0,082 L atm mol-1 K-1;
c) 12,18 L atm mol-1 K-1;
d) 22,4 L atm mol-1 K-1;
e) 6,0221023 L atm mol-1 K-1;
5.18. O cantitate de 32 g metan ocupa, la presiunea de 4 atm, un volum de 22,4 L. Temperatura gazului este:
a) 0 C; b) 27 C; c) 18 C; d) 273 C; e) 546 C.
5.19. La temperatura de 57 C, 280 g de gaz pur ocupa un volum de 33 L, la presiunea de 8,2 atm. Sa se calculeze masa moleculara a gazului.
(R = 0,082 L atm mol-1 K-1)
a) 28; b) 56; c) 2; d) 17; e) 32.
5.20. De cate ori este mai mare densitatea unui gaz oarecare fata de hidrogen decat fata de heliu, in aceleasi conditii de temperatura si presiune?
a) 4; b) 8; c) 2; d) 3; e) 6.
5.21. Ce volum ocupa 56 g gaz pur, in conditii normale, a carui densitate in raport cu hidrogenul este 14?
(VM = 22,4 l/mol)
a) 22,4 L; b) 11,2 L; c) 44,8 L; d) 56 L; e) 89,6 L.
5.22. Dintr-o butelie de oxigen de 12 L, aflata la temperatura de 27 C, se consuma 896 g gaz. Stiind ca presiunea initiala a oxigenului a fost 82 atm, sa se calculeze presiunea finala.
a) 12,3 atm; b) 20,5 atm; c) 41 atm; d) 24,6 atm; e) 49,2 atm.
5.23. Un amestec gazos format din 10 g H2, 70 g N2 si 110 g CO2 se afla intr-un cilindru inchis, la presiunea de 3 atm. Care este presiunea partiala a hidrogenului din acest amestec?
a) 3 atm; b) 1 atm; c) 1,5 atm; d) 2 atm; e) 2,5 atm.
5.24. Care este masa moleculara medie a amestecului gazos format din 10 g H2,
70 g N2 si 110 g CO2?
a)19; b) 24,66; c) 37; d) 28; e) 14.
5.25. Intr-un cilindru inchis cu volumul de 5 L se afla un amestec echimolecular de N2 si CO2. Stiind ca temperatura este 27C, iar presiunea partiala a azotului din amestec este 2 atm, se cere volumul in conditii normale ocupat de amestecul gazos?
a) 9,1 L; b) 22,4 L; c) 18,2 L; d) 33,6 L; e) 44,8 L.
5.26. De cate ori se mareste volumul ocupat de apa prin vaporizare, admitand ca temperatura vaporilor este 100C, presiunea 1 atm, iar densitatea apei lichide 1 g/cm3?
a) 100 de ori; b) 1000 de ori; c) 1600 de ori;
d) 1700 de ori; e) 1244 de ori.
5.27. Care este masa a 12,308 L de H2 masurata la 2 atm si 27C?
a) 20 g; b) 10 g; c) 1 g; d) 2 g; e) 5 g.
5.28. Azotul dintr-o butelie de otel cu volumul de 4,48 litri cantareste 56 g. Care va fi presiunea din butelie la temperatura de 27,3C?
a) 2 atm; b) 4 atm; c) 8 atm; d) 11 atm; e) 13 atm.
5.29. Un amestec echimolecular de azot si hidrogen are densitatea relativa fata de aer (aflat in aceleasi conditii de temperatura si presiune, Maer=29) egala cu:
a) 0,25; b) 0,52; c) 0,75; d) 1,0; e) 1,25.
5.30. Un amestec gazos compus din 6 g hidrogen si 280 g azot are masa moleculara medie:
a) 15; b) 30; c) 7,2; d) 14,4; e) 22.
5.31. Un amestec gazos compus din 1,2 g hidrogen, 5,6 g azot si 8,8 g bioxid de carbon se afla intr-un recipient la presiunea de 10 atm. Care este presiunea partiala a hidrogenului din acest amestec?
a) 3,33 atm; b) 6 atm; c) 1,2 atm; d) 6,66 atm; e) 0,6 atm.
5.32. Intr-o butelie cu volumul de 16,41 litri se afla un amestec de hidrogen si azot in raport molar de 3:1. Stiind ca presiunea gazului din butelie este 3 atm la temperatura de 27 C, se cere masa amestecului din butelie.
a) 15 g; b) 30 g; c) 28 g; d) 8,5 g; e) 17 g.
5.33. Numarul lui Avogadro reprezinta:
a) numarul de electroni dintr-o molecula de gaz;
b) numarul de particule (atomi, molecule) ce se gasesc intr-un mol de substanta;
c) cantitatea de electricitate necesara degajarii unui mol de gaz;
d) volumul unui mol de gaz in conditii normale de temperatura si presiune;
e) numarul de molecule care se gasesc intr-un litru de gaz.
5.34. Ce volume de N2 si CO2 sunt necesare pentru a obtine 500 mL amestec gazos, in conditii normale de temperatura si presiune, avand densitatea fata de hidrogen egala cu 19,6?
a) 100 mL N2 si 400 mL CO2; b) 400 mL N2 si 100 ml CO2; c) 150 mL N2 si
350 mL CO2;
d) 250 mL N2 si 250 mL CO2; e) 200 mL N2 si 300 mL CO2;
5.35. De cate ori se mareste volumul CO2 prin sublimare, presupunand ca procesul se desfasoara in conditii normale (0C si 1atm)? Densitatea CO2 solid este 1,56 g/cm3.
a) 22,4 ori; b) 44,8 ori; c) 39,71 ori; d) 79,42 ori; e) 794,2 ori.
5.36. Daca se noteaza cu r densitatea unui gaz la temperatura T1 si presiunea p1 si cu r densitatea aceluiasi gaz la temperatura T2 si presiunea p2, care dintre urmatoarele relatii este corecta?
a) ![]() b)
b) ![]() c)
c) ![]()
d) ![]() e)
e) ![]()
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4251
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved