| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Polarizatia moleculelor datorata polaritatii si polarizabilitatii acestora este cauza aparitiei unor legaturi intermoleculare, aceste interactii care apar intre molecule sunt cunoscute sub numele de forte Van der Waals si legaturi de hidrogen.
 Moleculele
diatomice in stare gazoasa, moleculele mono sau poliatomice saturate din punct
de vedere al covalentei din retelele moleculare se leaga prin forte slabe de
natura electrostatice, numite forte Van der Waals.
Moleculele
diatomice in stare gazoasa, moleculele mono sau poliatomice saturate din punct
de vedere al covalentei din retelele moleculare se leaga prin forte slabe de
natura electrostatice, numite forte Van der Waals.
Aceste forte nu implica punerea in comun sau transferul de electroni, la baza lor stand fenomenul de polarizatie dintre particulele componente, interactiunea realizandu-se prin interactiuni dipol-dipol, care sunt de trei feluri:
1. interactiuni prin forte de dispersie - interactiuni London;
2. interactiuni prin forte de orientare - interactiuni Keesom;
3. interactiuni prin forte de inductie - interactiuni Debye.
Indiferent de natura lor, interactiile dipol-dipol sunt atractive si repulsive, iar instabilitatea retelelor moleculare se datoreste echilibrului dintre ele. Apropierea dintre molecule s-ar face pana la contopirea lor totala, datorita fortelor atractive, daca concomitent nu s-ar naste fortele repulsive intre electronii invelisurilor exterioare ale moleculelor si intre nucleele slab ecranate.
Cele trei tipuri de interactiuni Van der Waals asigura coeziunea moleculara si se manifesta in starile condensate (solida si lichida), dar si la gaze, la presiuni mari si la temperaturi mai apropiate de punctul de lichefiere. Contributia acestor trei tipuri de interactiuni la coeziunea moleculara este insa inegala si depinde de polarizabilitatea si de polaritatea moleculelor.
Taria fortelor Van der Waals determina valorile constantelor fizice ale substantelor moleculare. Astfel, substantele nepolare au puncte de topire si de fierbere scazute, calduri de topire si vaporizare de asemenea mai scazute decat a substantelor polare cu mase moleculare comparabile. Asigurand coeziunea moleculara, fortele Van der Waals explica de ce substantele moleculare cu masa moleculara mai mica sunt gaze (gazele rare, H2, N2, O2, Cl2, CO2, H2S, NH3, CH4, etc.) in timp ce substantele moleculare cu masa moleculara mai mare si polarizabilitate ridicata sunt lichide (Br2, C6H6, hidrocarburile cu mai mult de cinci atomi de carbon, CCl4) sau chiar solide cu retele de simetrie scazuta (S8, P4).
 Legatura de hidrogen ia nastere prin
intermediul atomilor de hidrogen si se stabileste numai cu atomii elementelor
puternic electronegative. Protonul exercita o atractie puternica asupra
electronilor neparticipanti ai atomilor puternic
electronegativi fluor, oxigen, azot, stabilind cu acestia o legatura de natura
electrostatica.
Legatura de hidrogen ia nastere prin
intermediul atomilor de hidrogen si se stabileste numai cu atomii elementelor
puternic electronegative. Protonul exercita o atractie puternica asupra
electronilor neparticipanti ai atomilor puternic
electronegativi fluor, oxigen, azot, stabilind cu acestia o legatura de natura
electrostatica.
Aceasta atractie se exercita atat asupra atomului electronegativ de care hidrogenul este legat initial, cat si de atomul electronegativ din molecula invecinata.
Astfel sunt hidrurile (HF, H2O, NH3), oxoacizii si sarurile acide ale acestora, acizii organici si sarurile lor acide, alcooli, fenolii, hidroxilamina, aminele, iminele, amiduri, hidrazida, acizii azothidric si cianhidric, aminoacizii.
Legatura de hidrogen se formeaza datorita particularitatilor pe care le prezinta protonul:
- este complet lipsit de invelis electronic;
- are raza cea mai mica, ceea ce permite patrunderea lui in invelisul electronic al atomilor;
- are sarcina specifica cea mai mare;
- puterea sa polarizanta este maxima.
Legaturile de hidrogen pot aparea:
atat intre molecule, rezultand forte intermoleculare (intre molecule de HF, H2O):
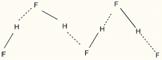
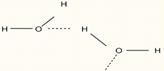
cat si in molecule, fortele exercitate fiind intramoleculare:
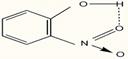
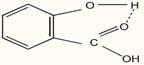
Numarul maxim de legaturi de hidrogen la apa, apar la 4oC (ρmax=1 g/cm3), dupa care prin cresterea temperaturii incepe si ruperea legaturilor de hidrogen, astfel ca la cca 40oC raman doar 50% legaturi de hidrogen, in timp ce la 80oC acestea dispar. Din asocierea moleculelor de apa se formeaza asa-zisa "apa polimerizata".
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2295
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved