| CATEGORII DOCUMENTE | ||
|
||
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
MODELUL CUANTIC
Niels Bohr (1913) elaborareaza un nou model atomic pornind de la legile fizicii clasice, folosindu-se de teoria cuantica a luminii a lui Max Plank si de teoria efectului fotoelectric, elaborata de Albert Einstein.
Teoria cuantica asupra luminii a fost elaborata de Max Plank (1900) pentru explicarea distributiei discontinue a energiei in spectrul radiatiei corpului negru.
Noile observatii experimentale nu se puteau interpreta cu ajutorul teoriei ondulatorii a luminii care explica numai unele fenomene ca propagarea, difractia, interferenta si polarizatia luminii.
Conform teoriei cuantice, lumina prezinta caracter discontinuu, corpuscular. Ea este absorbita sau emisa de corpuri in mod discontinuu deoarece este formata din corpusculi (graunti) de lumina de marime determinata, numite cuante de lumina sau fotoni a caror energie este:
![]()
in care h = 6,625610-34 Js si poarta numele de constanta lui Plank, iar n este frecventa radiatiei de masa m = hn/c2 si impuls p=mc=h/l
Dupa Einstein (1905), cand se produce un schimb de energie intre o particula (atom sau molecula) si o radiatie electromagnetica (lumina) de frecventa n, variatia energiei particulei este data de relatia:
![]() (1.4.)
(1.4.)
Unul din primele fenomene care au putut fi interpretate prin teoria cuantelor a fost efectul fotoelectric extern. Acest efect consta in emisia de electroni, numiti fotoelectroni de catre unele foite metalice fotosensibile sub actiunea luminii. Ecuatia efectului foto-electric data de Einstein (1905) este:
![]() ()
()
in care Ei este energia de ionizare necesara pentru a scoate electronul din metal iar mv2/2 este energia cinetica cu care electronul paraseste metalul.
Postulatele lui Bohr
Pentru a pune de acord modelul planetar al lui Rutherford cu teoria cuantelor, Bohr a enuntat doua postulate care stau la baza noului sau model atomic, modelul atomic al lui Bohr, aplicabil numai atomului de hidrogen si ionilor hidrogenoizi (mono-electronici).
Postulatele lui Bohr se enunta astfel:
1. Electronul se roteste in jurul nucleului atomic numai pe anumite orbite numite orbite stationare sau permise corespunzatoare unor stari bine determinate si constante ale energiei atomului (stari stationare). In asemenea stari, atomul nu emite si nu absoarbe energie. Valorile energiei atomului in aceste stari sunt cuantificate, adica pot varia numai discontinuu (de ex. E1, E2, E3En).
2. Atomul poate emite sau absorbi energie radianta numai atunci cand trece dintr-o stare stationara in alta. Astfel, cand atomul absoarbe energie, ceea ce corespunde trecerii sale in stare excitata, electronul sau trece de pe o orbita inferioara, mai apropiata de nucleu, pe o orbita superioara mai indepartata de nucleu. Dupa un timp foarte scurt (10-8 s), electronul revine prin salt pe orbita stationara initiala eliberand o cuanta de energie. Energia cuantei emise sau absorbite este egala cu diferenta dintre energia starii finale E2 si initiale E1 a atomului:
![]() (1.6.)
(1.6.)
2. Calculul razelor orbitelor permise
Pe baza unor consideratii pur mecanice, Bohr a reusit sa calculeze in cadrul teoriei sale razele orbitelor permise. In atomul de hidrogen, asupra electronului de masa m care se roteste in jurul nucleului cu viteza v pe o orbita circulara de raza r, actioneaza doua forte egale si de semn contrar: forta centrifuga F1 si forta de atractie coulombiana F2 dintre electronul negativ si nucleul pozitiv.
Forta centrifuga F1 care cauta sa indeparteze electronul de nucleu, este data de relatia:
![]() (1.7.)
(1.7.)
iar forta de atractie electrostatica dintre electron si nucleu este data, conform legii lui Coulomb, de relatia:
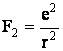 (1.8.)
(1.8.)
Cele doua forte fiind egale, rezulta:
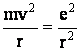 sau
sau ![]() (1.9.)
(1.9.)
Pentru calculul razelor Bohr s-a folosit si de momentul cantitatii de miscare a electronului in rotatia sa in jurul nucleului.
Este cunoscut ca produsul mv constituie cantitatea de miscare, iar 2pmvr momentul cantitatii de miscare a electronului pentru intreaga orbita numit si moment de rotatie sau moment unghiular.
Conform ipotezei lui Bohr, sunt permise numai acele orbite al caror moment de rotatie este un multiplu intreg (n) al constantei lui Plank adica:
![]() (1.10)
(1.10)
n numindu-se numar cuantic principal.
Aceasta conditie impusa arbitrar de Bohr constituie un postulat aditional si poarta numele de conditia de cuantificare a momentului cantitatii de miscare (orice marime fizica ce poate primi numai anumite valori, discontinue este cuantificata).
Ridicand la patrat relatia (1.10) rezulta:
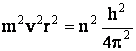 (1.11)
(1.11)
iar prin impartirea relatiei (1.11) la relatia (1.9) se obtine valoarea razei:
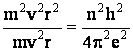 (1.12)
(1.12)
sau:
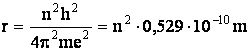 (1.13)
(1.13)
Daca se inlocuieste n cu valorile 1, 2, 3se obtin razele orbitelor permise electronului in atomul de hidrogen. Pentru primele trei raze se obtin valorile:
r1 = 0,52910-10 m; r2 = 2,1210-10 m; r3 = 4,7710-10 m (1.14)
3. Calculul caracteristicilor liniilor spectrale ale hidrogenului si interpretarea lor prin teoria lui Bohr
Al doilea succes imediat al teoriei lui Bohr a fost calcularea frecventei liniilor spectrale ale atomului de hidrogen.
Se considera ca energia totala a electronului Etot aflat pe o orbita stationara este egala cu suma energiei cinetice Ec si energiei potentiale Ep.
Valorile acestor energii sunt:
![]() si
si ![]() (1.15)
(1.15)
Din relatia (1.9) prin inmultire cu r si impartire la 2 rezulta:
![]() (1.16)
(1.16)
sau tinand seama de (1.15):
![]() (1.17)
(1.17)
Deci:
![]() sau
sau ![]() (1.18)
(1.18)
Inlocuind r cu valoarea sa din relatia (1.13), se obtine energia unei orbite permise:
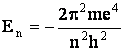 unde n = 1, 2, 3 (1.19)
unde n = 1, 2, 3 (1.19)
Notandu-se cu E1 si E2 energiile atomului cand electronul acestuia se afla pe orbita cu numarul cuantic n1 si respectiv pe cea cu numarul cuantic n2, energia emisa de atom la saltul electronului de pe orbita cu n2 pe cea cu n1 este, dupa Bohr, egala cu hn. Deci:
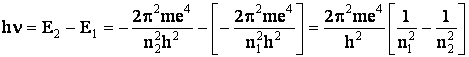 ` (1.20)
` (1.20)
Cum:
![]()
rezulta:
 (1.21)
(1.21)
unde factorul comun R reprezinta constanta lui Rydberg si este alcatuita la randul ei din unele constante naturale fundamentale. Prin inlocuirea acestora cu valorile lor, Bohr a calculat valoarea constantei R pe care Balmer a obtinut-o din masuratori experimentale (1885).
Este de mentionat ca relatia (1.21) este un caz particular al relatiei generale:
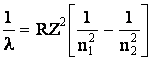 (1.22)
(1.22)
aplicabila spectrelor ionilor hidrogenoizi (unielectronici): He+, Li2+, Be3+, Z fiind numarul atomic al elementului cercetat.
Cu ajutorul teoriei lui Bohr se poate interpreta spectrul optic al hidrogenului. Seriile spectrale descrise mai sus (v. 1.4.1) se datoresc tranzitiilor electronilor, adica revenirii lor de pe un nivel energetic superior pe altul inferior dupa excitarea atomului. Ori de cate ori electronii sufera tranzitii de pe nivele superioare pe nivelul n1, avand numarul cuantic principal n=1, se emit radiatii din seria Lyman (nivelul corespunzator numarului cuantic principal n=1 constituie stratul K) (v. fig. 5). Atunci cand tranzitiile de pe nivelele superioare se fac pe nivelul cu n=2, apar linii in seria Balmer (stratul cu n=2 s-a numit nivel sau strat L) si asa mai departe, stratul cu n=3 s-a numit strat M, apoi N, O, P si Q.
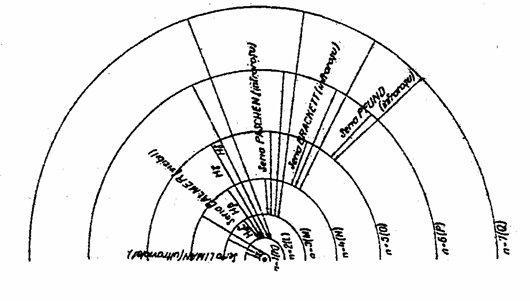
Figura 5. Seriile spectrale ale atomului de hidrogen dupa Bohr.
Termenul n2 este variabil intr-o serie si indica nivelul de pe care sare electronul pentru a reveni din starea excitata in starea initiala.
Atunci cand electronul este
smuls si proiectat la infinit (![]() ) in urma unei excitari puternice a atomului, termenul
curent al liniei din formula (1.21) se anuleaza, iar noua relatie:
) in urma unei excitari puternice a atomului, termenul
curent al liniei din formula (1.21) se anuleaza, iar noua relatie:
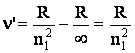 (1.23)
(1.23)
caracterizeaza limita seriei (L.S.). Limitele seriilor spectrale au urmatoarele valori: R (Lyman), R/4 (Balmer), R/9 (Paschen), R/16 (Brackett) si R/25 (Pfund).
4. Explicarea spectrelor de raze X cu ajutorul teoriei lui Bohr
Teoria lui Bohr a permis explicarea spectrelor de raxe X ale elementelor. Razele X (v. 1.1) sunt radiatii electromagnetice care au aceeasi natura ca lumina insa lungime de unda mai mic (0,01-10 nm).
Ele se obtin prin bombardarea cu un fascicol de raze catodice (electroni) asupra unui anticatod confectionat dintr-un metal sau o combinatie a sa greu fuzibila.
Elementul din care este confectionat metalul emite raze X (Rentgen-1895) sub actiunea fascicolului de electroni. Sunt cunoscute proprietatile deosebite ale acestor radiatii de a strabate cu usurinta prin foite metalice, sticla si alte materiale, de a ioniza aerul, de a distruge bacteriile si de a avea un efect mutagen producand mutatii biochimice si anomalii in diviziunea celulara.
Analizand spectrele de raze X ale diverselor elemente, H.G.J. Moseley (1913) a constatat ca acestea sunt surprinzator de simple. Ele sunt formate ca si in cazul spectrelor optice, din mai multe linii notate cu a b g etc., grupate in serii care se noteaza prin K, L, M, N, O, P, in ordinea descrescatoare a frecventelor. Seria K, cea mai simpla, are numai doua linii caracteristice Ka si Kb, fiecare fiind formata din doua linii apropiate (dublet). Comparand spectrele caracteristice ale elementelor succesive in sistemul periodic, se observa o deplasare a frecventei unei linii din aceeasi serie in directia frecventelor mari odata cu cresterea numarului de ordine (atomic) al elementelor.
Pe baza acestei observatii Moseley a stabilit in mod empiric (1913)o relatie conform careia radacina patrata a frecventei n sau a numarului de unda n' variaza liniar cu numarul atomic Z.
Pentru elementele cu Z > 10 relatia are forma:
![]() (1.24)
(1.24)
in care a si b au
valori constante cand se trece de la un element la altul si valori
variabile cand se trece de la o serie la alta. In figura 6 se reprezinta
variatia liniara pentru fiecare serie atunci cand se ia pe
ordonata ![]() si pe
abscisa Z.
si pe
abscisa Z.
Interpretarea spectrelor de raxe X cu ajutorul teoriei lui Bohr a fost data de N. Kossel. Electronii din tuburile Crookes care bombardeaza suprafata metalului au o energie suficient de mare pentru a patrunde profund in straturile electronice ale atomilor metalici expulzand electronii chiar din straturile cele mai apropiate de nucleu. Locurile devenite vacante sunt ocupate imediat prin
tranzitiile electronilor aflati in straturile cu energie mai mare. Aceste tranzitii electronice sunt insotite de emisii de cuante X.
Astfel, cand este expulzat un electron situat in stratul K, locul lui se poate ocupa de electroni din straturile L, M, N sau O incat, in spectru apar liniile stratului K. Liniile spectrelor de raze X, in deplina concordanta cu legea lui Moseley, pot fi caracterizate printr-o relatie analoaga celei utilizate de Bohr:
 (1.25)
(1.25)
in care R este constanta lui Rydberg, n1 si n2 sunt aceleasi numere cuantice ca in relatia (1.21), Z este numarul atomic al elementului din care este confectionat anticatodul, iar a constituie o constanta de ecranare indicand numarul de electroni situati intre nucleu si stratul electronic din care a fost expulzat electronul. Pentru prima linie a a primei serii K (deci linia Ka) a unui element cu numar atomic Z, ecuatia (1.25) ia forma:
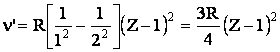 (1.26)
(1.26)
de unde rezulta ca relatia (1.25) devine egala cu (1.24) cand:

Figura
6. Variatia liniara a lui Z in functie de ![]() in spectrele de raze
X.
in spectrele de raze
X.
Modelul atomic al lui Bohr a constituit un pas serios in elucidarea structurii atomice. El a permis interpretarea unor rezultate experimentale importante, printre care, asa cum s-a aratat mai sus, spectrul atomilor hidrogenoizi, spectrele de raze X, potentialele de ionizare ale unor atomi hidrogenoizi, fundamentarea teoretica a formulei empirice a lui Balmer etc. Cu toate aceste succese, modelul atomic al lui Bohr si teoria sa cuantica asupra atomului de hidrogen s-au dovedit din multe puncte de vedere imperfecte. O serie de critici aduse teoriei lui Bohr se refereau in principal la introducerea cu totul arbitrara de catre acesta a cuantificarii momentului cantitatii de miscare a electronului si a orbitelor stationare, precum si a lipsei de radiatii electromagnetice a electronului care graviteaza in jurul nucleului de-a lungul aceleiasi orbite stationare. Orice incercare de a extinde teoria lui Bohr asupra atomilor cu mai multi electroni a dat gres, iar numarul liniilor spectrale s-a dovedit a fi mult mai mare decat prevedea teoria.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4459
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved