| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
NOTIUNI DE ELECTROCHIMIE
1. Electroliza, legi si aplicatii
Electroliza este un proces fizico-chimic complex, provocat de campul electric stabilit intre doi electrozi introdusi in solutia sau in topitura unui electrolit si legati la bornele unui generator de curent continuu. Sub actiunea campului electric aplicat, in electrolit are loc deplasarea ionilor negativi spre anod si a ionilor pozitivi spre catod. Ajunsi la electrozi, ionii sufera reactii electrochimice pe suprafata de separare metal-electrolit, reactii ce se pot clasifica in:
- reactii primare de electrod - care sunt reactiile de oxidare anodica si reactiile de reducere catodica;
- reactii secundare de electrod - care au loc atunci cand atomii sau radicalii rezultati in urma reactiilor primare de electrod, reactioneaza cu electrozii, cu solventul sau intre ei, substanta respectiva depunandu-se sau degajandu-se daca este un gaz.
Electroliza are loc atunci cand intre electrozi se stabileste o diferenta de potential cunoscuta sub numele de potential de electroliza. Prin tensiune de electroliza se intelege, tensiunea minima necesara pentru separarea unui produs la electrod. Fiecare combinatie chimica are o anumita tensiune de descompunere. Tensiunea de electroliza este de ordinul a catorva volti.
Legile fundamentale ale electrolizei au fost stabilite de M. Faraday (1833).
1) In orice depunere electrolitica, marimea actiunii chimice este proportionala cu cantitatea totala de electricitate, care trece prin electrolit.
m = k I t = k Q
unde: m = masa produsului de electroliza [g];
I = intensitatea curentului electric [A];
t = timpul de electroliza [s];
k = constanta de proportionalitate;
Q = cantitatea de electricitate [C].
2) Masele diferitelor substante separate la electrozi, de aceeasi cantitate de electricitate, sunt proportionale cu echivalentii lor chimici.
Cantitatea de electricitate, determinata experimental, care poate depune sau dizolva prin electroliza, un echivalent gram (Eg), de substanta este aceeasi; ea se numeste faraday, se noteaza cu F si este egala cu 96491,4 coulombi ( 96500 C).
Adica, daca 1F coulombi........1Eg = A/z grame
![]()
Atunci Q = I t...........m
grame
![]()
Comparand aceasta ecuatie cu ecuatia m = k I t ,
rezulta:
k se numeste echivalent electrochimic.
Relatia obtinuta pentru m serveste la calculul masei de substanta depusa in conditii date de electroliza sau pentru calculul cantitatii de electricitate necesara pentru depunerea unei cantitati determinate dintr-un element dat.
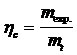
In industrie importanta deosebita prezinta stabilirea
randamentului de curent. Datorita proceselor secundare de la electrozi sau
diferitelor rezistente sau scurtcircuite, care pot aparea in celula
de electroliza, cantitatea de substanta separata experimental
este intotdeauna mai mica decat cea calculata. Randamentul de curent hc,
se exprima prin relatia:
unde mexp.= masa de substanta separata la electrod;
mt = masa calculata cu legea lui Faraday pentru acelasi consum de cantitate de electricitate.
Deoarece randamentul de curent are valoare subunitara, se exprima ca randament procentual: hc
Procesele de electroliza au capatat largi si variate intrebuintari:
a) In industria chimica:
- descompunerea electrolitica a apei in scopul obtinerii hidrogenului necesar in diferite sinteze;
- electroliza solutiei de clorura de sodiu pentru obtinerea hidroxidului de sodiu, a clorului si hidrogenului;
- industria produselor de oxidare electrochimica, cum sunt cloratii metalelor alcaline, percloratii, hipocloritii, apa oxigenata, etc.
b) Galvanotehnica, care concentreaza totalitatea operatiilor ce au ca scop principal depunerea unui strat de metal pe un alt metal, in scop de protectie (galvanostegia) sau acoperirea cu strat metalic a unui material izolant (galvanoplastia).
c) Electrodepunerea metalelor din solutii apoase, care constituie baza prepararii metalelor prin metoda hidrometalurgica.
d) Electroliza in topituri, care se foloseste pentru obtinerea metalelor ai caror oxizi nu pot fi redusi cu carbon sau daca pot fi redusi, procesul intampina dificultati mari sau este foarte costisitor. Obtinerea aluminiului este cea mai importanta industrie bazata pe electroliza topiturilor.
e) Electroliza cu catod metalic lichid, care se aplica pentru obtinerea metalelor, care in stare pura se obtin foarte greu. Astfel de exemplu, metalele alcaline se prepara electrolitic cu un randament de curent mai mare pe catod lichid decat pe unul solid.
2. Surse chimice de curent
O cantitate importanta de curent este furnizata tehnicii moderne de sursele chimice de curent. Acestea sunt pilele galvanice (elemente galvanice) prin care se inteleg acele dispozitive care transforma energia chimica in energie electrica. Ele reprezinta un lant electrochimic constituit din doi conductori electronici, reuniti prin unul sau mai multi conductori ionici. Sursele chimice de curent se pot clasifica in: primare, secundare si pile de combustie.
a) Pilele electrochimice primare se caracterizeaza prin faptul ca energia electrica se produce pe seama unor reactanti ce se gasesc in pila in cantitati limitate, iar regenerarea lor prin electroliza nu are loc.
- Pila Leclanche este cea mai raspandita pila primara (uscata). Lantul electrochimic al acesteia este: (-) Zn/NH4Cl/MnO2 + C (+).
Anodul pilei este confectionat dintr-un pahar de zinc (1) iar catodul din carbune (2) invelit intr-un sac de panza ori introdus intr-un vas de portelan poros (3), in care se gaseste un amestec de MnO2 si negru de fum (4).
Electrolitul este o solutie apoasa de NH4Cl sau KOH, trecuta sub forma de pasta, cu amidon si faina de grau (5). Pentru a evita consumarea electrodului de zinc, in urma actiunii corosive a atmosferei, el se izoleaza cu un ambalaj de masa plastica.
Reactiile ce au loc in pila se prezinta prin ecuatiile:
la catod (+): 2 MnO2 + 2 H2O + 2 e- 2 MnO(OH) + 2 OH-
la anod (-): Zn - 2 e- Zn2+
Zn2+ + 2 OH- Zn(OH)2
Reactia globala: Zn + 2 MnO2 + 2 H2O 2 MnO(OH) + Zn(OH)2
In realitate reactiile din pila sunt mult mai complexe, fapt dovedit prin formarea unor compusi ca: ZnO Mn2O3, Mn2O3 H2O, ZnO, ZnCl2 2NH3 si ZnCl2 4Zn(OH)2.
Pila are o f.e.m. de 1,5-1,6 V si o capacitate, pentru cele de buzunar, de 2 Ah. Prezinta o mare importanta economica provenita din simplitatea manipularii si usurinta transportului ei. Se foloseste in domenii foarte diferite: alimentarea aparatelor de radio si TV tranzistorizate, a instalatiilor de semnalizare, etc.
- Pila cu oxid mercuric este pila la care anodul este format din pulbere de zinc amalgamata, iar masa activa la catod, din oxid rosu de mercur si carbune. Lantul electrochimic al acestei pile este:
(-) Zn/KOH/HgO + C (+)
Reactiile ce se desfasoara la cei doi electrozi sunt:
la catod (+): HgO + H2O + 2 e- Hg + 2 OH-
la anod (-): Zn + 4 OH- [Zn(OH)4]2- + 2 e-
[Zn(OH)4]2- Zn + 2 H2O + 2 OH-
Reactia globala: Zn + HgO Hg + ZnO
Aceste pile se comercializeaza sub forma de pastile sau sub forma de nasture. Costul mai ridicat si fabricarea mai dificila, limiteaza utilizarea ei la domenii mai restranse, cum sunt alimentarea unor aparate medicale (stimulatoare cardiace, dispozitive auditive, etc.), minicalculatoare, ceasuri electronice, etc.
b) Pile electrochimice secundare (acumulatoare) sunt acelea in care partenerii de reactie consumati in timpul producerii energiei electrice (descarcare) se pot reface cu ajutorul unui proces de electroliza, numit incarcare.
- Acumulatorul cu plumb (Plante, 1859) are electrozii confectionati din plumb, sub forma de retele, umplute la polul negativ cu plumb spongios, iar la polul pozitiv cu dioxid de plumb. Placile de plumb se pot inlocui cu placi din aliaj Pb-Sb 7,5 %, care este mai rezistent la coroziune decat plumbul pur. Electrolitul este o solutie de acid sulfuric cu densitatea de 1,26 g/cm3 (cand acumulatorul este incarcat).
Lantul electrochimic este: (-) Pb/H2SO4 aq/PbO2 (+).
Reactiile chimice, care se produc in timpul descarcarii si incarcarii sunt:
la catod (+): PbO2 + 4 H+ Pb4+ + 2 H2O
Pb4+ + 2 e- Pb2+
Pb2+ + SO42- PbSO4
la anod (-): Pb - 2 e- Pb2+
Pb2+ + SO42- PbSO4
Reactia globala: Pb + 2 H2SO4 + PbO2 2 PbSO4 + 2 H2O
Reactiile sunt reversibile, ceea ce permite regenerarea acumulatorului printr-un proces de electroliza.
Acumulatoarele cu plumb dau o tensiune de 2,01-2,06 V, ramanand la sarcina normala, aproape invariabila, in timpul functionarii. Cand tensiunea scade (la 1,8 V) acumulatorul trebuie incarcat, altfel se degradeaza.
Capacitatea acumulatorului este definita prin cantitatea de electricitate restituita de un acumulator incarcat in anumite conditii si se masoara in amperi-ore (Ah). Capacitatea este influentata de toti factorii determinanti in functionarea acumulatorului: cantitatea de materie activa; difuziunea; cantitatea, concentratia si temperatura electrolitului; intensitatea curentului care strabate elementul; gradul de formare electrochimica a materiei active; etc.
Acumulatorul este sediul unor procese, in permanenta manifestare, independente de circuitul de utilizare, in timpul incarcarii, al descarcarii si chiar in repaos. Aceste procese poarta numele de autodescarcare, efectul lor fiind o pierdere continua din incarcarea electrica a acumulatorului si micsorarea duratei de functionare a acestuia. Cauzele autodescarcarii sunt de natura chimica si electrochimica si anume: scurtcircuitele din interiorul acumulatorului provoaca descarcarea inutila a ambelor feluri de placi; atacarea placilor de catre impuritatile aflate accidental in electrolit; atacarea plumbului de catre H2SO4 din electrolit; densitatea si temperatura necorespunzatoare a electrolitului;
Exista si actiuni locale cu caracter electrochimic, prin constituirea de elemente galvanice parazitare, care produc curenti locali si duc la autodescarcari (sulfatari, coroziune, etc.).
Sulfatarea placilor este un proces de formare pe placi a unui exces de sulfat de plumb, sub forma de cristale mari, greu de eliminat. Adaugarea de acid sulfuric concentrat in loc de apa distilata si descarcarile lente, prelungite, urmate de lunga inactivitate, cu variatii de temperatura, sunt cazurile cele mai frecvente, care provoaca procesul de sulfatare. In acest caz, cristalele formate impiedica reactivitatea placilor, iar incarcarea obisnuita nu are nici un efect; acumulatorul poate fi scos din functiune, daca sulfatarea este excesiva.
Eliminarea sulfatarii este, in principiu, posibila. In cazurile mai putin grave, dupa completarea electrolitului cu apa distilata, acumulatorul se pune la incarcat. Daca din primele momente apare fierberea, curentul initial trebuie coborat, pana ce fierberea inceteaza. Eliminarea sulfatarii este terminata, cand tensiunea si densitatea ajunse la valori normale, nu mai cresc timp de 4 ore.
In cazurile mai grave de sulfatare, se inlocuieste tot electrolitul cu apa distilata si acumulatorul se pune la incarcat, timp de 24 de ore. Daca densitatea electrolitului a ajuns la 1,12 g/cm3, se goleste din nou, se umple cu apa distilata si se reincarca. Repetand operatia de 2-3 ori, se regenereaza o baterie de pornire, foarte sulfatata. Daca operatia reuseste, ultimul electrolit trebuie inlocuit cu acid sulfuric de densitate normala si apoi acumulatorul se incarca, timp de 2 ore.
Incarcarea acumulatoarelor trebuie facuta imediat dupa constatarea unei descarcari mai importante, o intarziere de 2-3 zile poate aduce neajunsuri starii substantelor active ale placilor.
- Acumulatorul alcalin fero-nichel (Edison, 1902).
Lantul electrochimic al acestui acumulator este:
(-) Fe/KOH sol. conc. //Ni2O3 3H2O/Ni (+)
Reactia globala de functionare este:
Ni2O3 3H2O + Fe + KOH 2 Ni(OH)2 + Fe(OH)2 + KOH
Fiecare acumulator cuprinde un numar de placi negative, intre care sunt intercalate placile pozitive, legate in paralel.
Electrolitul este format dintr-o solutie 21 % KOH, care mai contine si 5 % LiOH; prezenta acestuia mareste tensiunea, capacitatea si durata de functionare a acumulatorului. Spre deosebire de acumulatorul cu plumb, electrolitul nu ia parte la reactiile de descacare si incarcare.
Tensiunea acestui acumulator este: initial 1,65 V; medie 1,2 V; si minima 1,1 V. El suporta un numar mare de incarcari si intretinere simpla. Se foloseste, in special, in conditii grele de lucru cum ar fi la iluminatul trenurilor si la actionarea locomotivelor de mina. Dintre dezavantajele acestui acumulator se remarca: tensiune mai mica la borne, decat la acumulatorul cu Pb; randament de curent mai mic; cost mai ridicat.
c) Pile de combustie. Pila de combustie se defineste ca fiind un generator de energie electrica, alimentat continuu cu specia activa la electrozi. La electrodul de combustibil are loc oxidarea combustibilului, cu oxidantul alimentat la celalalt electrod. Printre cei mai utilizati combustibili se mentioneaza H2, CH3OH, N2H4 (hidrazina), hidrocarburi, CO, etc. Drept oxidant se foloseste oxigenul pur sau aerul.
Pila hidrogen-oxigen (H2-O2), este cea mai bine studiata si cea mai raspandita; a servit ca sursa de energie electrica si apa, pe capsulele trimise in cosmos in cadrul proiectelor Gemini si Apollo.
Functionarea acestei pile se bazeaza pe reactia de sinteza a apei din elemente. Reactiile ce au loc sunt:
la catod (+): 2 H2 4 H+ + 4 e-
la anod (-): O2 + 4 H+ + 4 e- 2 H2O
Reactia globala: 2 H2 + O2 2 H2O
Schema unei astfel de pile este prezentata in figura de mai jos. Aceasta se compune din electrozi de Ti cu catalizator de Pt (1), membrana schimbatoare de ioni (2) si mesa pentru mentinerea cotei de apa in membrana schimbatoare de ioni (3).
Utilizarea hidrogenului in aceste pile, prezinta dezavantajul ca acesta nu poate fi lichefiat, ceea ce ridica probleme destul de dificile. In unele aplicatii militare acest dezavantaj a fost rezolvat prin folosirea hidrurii de litiu, care degaja hidrogen sub actiunea apei:
LiH + H2O LiOH + H2
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3956
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved