| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
NOTIUNI DE ELECTROCHIMIE
1. NOTIUNI INTRODUCTIVE
Electrochimia are ca obiect conversia materiei in electricitate si reciproc, transformarea materiei cu ajutorul electricitatii si legile care le guverneaza, sistemele ionice aflate in echilibru si transportul ionilor.
Din punct de vedere al trecerii curentului electric, substantele se impart in doua categorii: conductori de ordinul I sau electronici si conductori de ordinul II sau ionici. Substantele care nu lasa sa treaca curentul electric se numesc izolatori sau dielectrici.
In categoria conductorilor electrici, pe langa metalele in stare solida sau topita intra si o serie de substante cu luciu metalic cum ar fi grafitul, carburile metalice precum si unii oxizi. Deplasarea sarcinilor electrice este o consecinta a mobilitatii electronilor din reteaua cristalina. Caracteristic acestor conductori este scaderea conductibilitatii electrice cu cresterea temperaturii datorita agitatiei termice.
La temperaturi apropiate de zero absolut, conductibilitatea unor metale creste foarte mult, aparand fenomenul de supraconductibilitate.
In categoria conductorilor ionici se incadreaza sarurile si bazele in solutie sau topitura, precum si acizii in solutie. Conductibilitatea electrica se datoreaza ionilor existenti care migreaza sub actiunea campului electric, transportand sarcinile electrice.
In general, conductibilitatea conductorilor ionici este inferioara conductibilitatii conductorilor electronici.
2. CONDUCTANTA ELECTRICA A SOLUTIILOR DE ELECTROLIT
Interfata dintre un conductor electric si un conductor ionic (solutia de electrolit) se numeste electrod.
Prezenta unui camp electric intr-o solutie de electrolit intrerupe miscarea dezordonata a ionilor si declanseaza miscarea lor ordonata soldata cu transportul spre cei doi electrozi. Aceasta miscare ordonata in camp electric se numeste migrare si constituie baza conductantei electrice a solutiilor de electrolit.
Proprietatea unei substante de a conduce curentul electric poate fi exprimata cantitativ prin conductibilitatea electrica.
Celula de conductibilitate (conductometrica) este un vas de sticla prevazut cu doi electrozi de platina.
Analog cu un rezistor, rezistenta celulei de conductibilitate este direct proportionala cu lungimea coloanei de electrolit dintre electrozi si invers proportionala cu sectiunea coloanei de electrolit conform relatiei:
![]() (1)
(1)
unde: R = rezistenta celulei de conductibilitate [Ω];
ρ = rezistivitatea solutiei de electrolit [Ωcm];
λ = conductivitatea (conductanta specifica) solutiei de electrolit [Ω-1cm-1];
l = lungimea coloanei de electrolit dintre electrozi;
S = sectiunea coloanei de electrolit = sectiunea
electrodului.
![]() (2)
(2)
unde: C = constanta celulei conductometrice [cm-1].
Marimea inversa a rezistentei se numeste conductanta:
![]() (3)
(3)
unde: q = conductanta electrolitului [Ω-1].
Conductivitatea solutiei de electrolit variaza cu concentratia acestuia.
In solutiile concentrate de electroliti tari (KCl), conductivitatea creste si apoi scade cu cresterea concentratiei.
Pentru a se putea compara conductivitatile solutiilor de electroliti s-a introdus o marime numita conductanta echivalenta Λ care reprezinta conductivitatea unei solutii de electrolit care contine un echivalent gram de substanta intr-un cm3 de solutie si este data de relatia:
![]() (4)
(4)
unde: c = concentratia normala a solutiei de electrolit.
Conductanta echivalenta creste cu
dilutia si tinde catre o valoare maxima limita atinsa la dilutie infinita si
numita conductanta echivalenta limita ![]() .
.
Influenta concentratiei asupra conductantei echivalente a solutiei de electrolit tare 1:1 este descrisa de legea lui Kohlrausch:
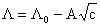 (5)
(5)
unde: A = constanta dependenta de natura electrolitului.
Reprezentand grafic conductanta
echivalenta Λ in functie de ![]() , conform
ecuatiei (5) se obtine o dreapta a carei ordonata la origine este conductanta
echivalenta limita a solutiei de electrolit tare.
, conform
ecuatiei (5) se obtine o dreapta a carei ordonata la origine este conductanta
echivalenta limita a solutiei de electrolit tare.
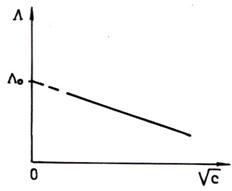
Fig.
1. Variatia conductantei echivalente cu ![]()
pentru electrolitii tari
Pentru un electrolit slab, conductanta echivalenta limita se determina din legea migratiei independente a ionilor, dedusa de Kohlrausch:
![]() (6)
(6)
unde: ![]() =
conductantele echivalente limita ale ionilor electrolitului slab.
=
conductantele echivalente limita ale ionilor electrolitului slab.
Influenta concentratiei asupra conductantei echivalente a solutiei de electrolit slab este descrisa de ecuatia Debye-Hckel-Onsager:
![]() (7)
(7)
unde: α = gradul de disociere al electrolitului slab;
A, B = constante caracteristice solventului pentru o temperatura data.
In solutiile electrolitilor slabi diluati, relatia (7) devine:
![]() (8)
(8)
Cunoscand α din masuratori conductometrice, se poate determina constanta de disociere a electrolitului slab pe baza legii dilutiei lui Ostwald:
![]() (9)
(9)
unde: K = constanta de disociere a electrolitului slab.
POTENTIAL DE ELECTROD. ECUATIA LUI NERNST
La suprafata de separatie (interfata) dintre electrod si solutia de electrolit se stabileste o diferenta de potential care se numeste potential de electrod. Potentialul de electrod este o valoare relativa; ea nu se poate determina direct, ci numai in raport cu un electrod de referinta.
Se considera o interfata metal/electrolit simbolizata M/Mz+. Reactia care se desfasoara la electrod se numeste reactie potential activa (RPA):
M2+
+ ze- ![]() M
M
Un electrod de specia I metalic este alcatuit dintr-un metal aflat in echilibru cu ionii sai dintr-o solutie a unei sari solubile si este simbolizat M/Mz+. Ex.: Cu/Cu2+.
Potentialul electrodului de specia I
metalic (![]() ) se
exprima folosind relatia lui Nernst:
) se
exprima folosind relatia lui Nernst:
![]() (10)
(10)
unde: ![]() =
potentialul de electrod standard;
=
potentialul de electrod standard;
R = constanta universala a gazelor = 8,31 J/molK;
F = numarul lui Faraday = 96500 C;
z = valenta metalului = numarul de electroni schimbati in RPA;
![]() = activitatea ionilor Mz+ in
solutia de electrolit;
= activitatea ionilor Mz+ in
solutia de electrolit;
aM = activitatea metalului; aM = 1M;
T = temperatura absoluta.
Pentru 25C, relatia (10) devine:
![]() (11)
(11)
Electrodul redox este alcatuit dintr-un metal inert (Pt) introdus intr-o solutie ce contine un sistem redox dizolvat si este simbolizat Pt/ox, red sau (Pt) ox/red. Ex.: Pt/Fe2+, Fe3+.
RPA care are loc la electrodul redox este:
ox + ze- ![]() red
red
Potentialul electrodului redox se exprima pe baza relatiei lui Nernst:
![]() (12)
(12)
unde: ![]() =
potentialul redox standard;
=
potentialul redox standard;
aox = activitatea formei oxidate;
ared = activitatea formei reduse.
4. ELECTROZI DE REFERINTA
Pentru determinarea potentialelor de electrod standard se foloseste ca si electrod de referinta electrodul de hidrogen normal (EHN) al carui potential standard se considera in mod conventional egal cu zero la toate temperaturile.
EHN este ales de Nernst si consta
dintr-o placuta de platina platinata si scufundata intr-o solutie de acid avand
![]() =1 M. Prin
solutie se barboteaza un curent de H2 pur avand p = 1 atm.
=1 M. Prin
solutie se barboteaza un curent de H2 pur avand p = 1 atm.
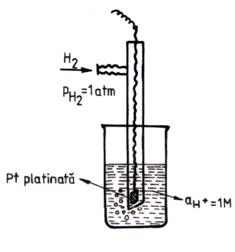
Fig. 2. Electrodul de hidrogen normal.
RPA a EHN este:
2H+
+ 2e- ![]() H2
H2
Sistemul format din doi electrozi formeaza o pila galvanica. Daca se formeaza o pila galvanica alcatuita din EHN si un electrod de specia I metalic si se masoara diferenta de potential dintre cei doi electrozi, se obtine direct potentialul standard al metalului.
Deoarece se opereaza greu cu EHN, se prefera si alti electrozi de referinta care pot fi calibrati fata de EHN. Un astfel de electrod des folosit in laborator este electrodul de calomel saturat (ECS) simbolizat prin lantul electrochimic:
Hg/Hg2Cl2/KClsat
Este alcatuit din Hg in contact cu calomel (Hg2Cl2) si cu o solutie de KCl saturata. Potentialul este preluat cu ajutorul unui fir de platina.
RPA a ECS este:
Hg2Cl2
+ 2e- ![]() 2Hg + 2Cl- ε = 0,244 V/EHN la 25C
2Hg + 2Cl- ε = 0,244 V/EHN la 25C
5. SERIA POTENTIALELOR DE ELECTROD STANDARD
Potentialele standard ale metalelor, sistemelor redox si ale nemetalelor s-au determinat in raport cu EHN si au fost tabelate in ordine crescanda, stabilindu-se seria potentialelor standard de reducere.
Potentialele standard au valori negative cand potentialul metalului este mai negativ decat potentialul EHN si valori pozitive cand acest potential este mai mare.
Cu cat un element are un potential de reducere standard mai negativ cu atat caracterul reducator este mai accentuat.
Tabelul 1. Potentiale de electrod standard la 25C
|
Electrodul |
RPA |
|
|
|
K+/K |
K+
+ e- | ||
|
Al3+/Al |
Al3+
+ 3e- | ||
|
Zn2+/Zn |
Zn2+
+ 2e- | ||
|
H+/H2 |
2H+
+ 2e- | ||
|
Cu2+/Cu |
Cu2+
+ 2e- | ||
|
I2/I-,Pt |
I2
+ 2e- | ||
|
Ag+/Ag |
Ag+
+ e- | ||
|
Co3+/Co2+ |
Co3+
+ e- | ||
Analizand seria potentialelor standard, se poate deduce schema:
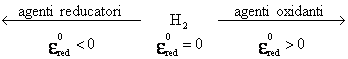
6. PILE GALVANICE
Pila galvanica este sistemul in care energia chimica este convertita in energie electrica. Ea este formata din doi electrozi reuniti prin conductori ionici (solutii de electroliti) si separati printr-un sifon electrolitic sau o diafragma.
La cei doi electrozi au loc reactii de oxido-reducere. La electrodul pozitiv numit catod are loc reducerea ionilor metalici din solutie, iar la electrodul negativ numit anod are loc oxidarea.
Pila galvanica se simbolizeaza printr-un lant electrochimic, iar reactia care se desfasoara in aceasta se numeste reactie electromotric activa (REMA).
Stabilirea polaritatii unei pile galvanice se face tinand cont de valorile potentialelor standard ale celor doi electrozi. Astfel, electrodul al carui potential de reducere standard este mai negativ va juca rolul de anod.
Mentionam doua pile de importanta practica:
a) Pila Volta este o pila ireversibila care consta din doi electrozi Zn si Cu introdusi intr-o solutie de H2SO4. Ea se simbolizeaza astfel:
(-) Zn/H2SO4/Cu (+)
RPA care au loc la electrozi sunt:
anod (-) Zn - 2e- ![]() Zn2+
Zn2+
catod (+) 2H+ + 2e- ![]() H2
H2
REMA din pila este:
Zn + 2H+
![]() Zn2+ + H2
Zn2+ + H2
b) Pila Daniell este o pila reversibila care este formata dintr-un electrod de Cu introdus intr-o solutie de CuSO4 si un electrod de Zn introdus intr-o solutie de ZnSO4. Cele doua solutii sunt separate printr-un sifon electrolitic umplut cu solutie de KCl saturata sau printr-o membrana poroasa. Pila se simbolizeaza prin lantul electrochimic urmator:
(-) Zn/ZnSO4//CuSO4/Cu (+)
RPA care au loc la electrozi sunt:
anod (-) Zn - 2e- ![]() Zn2+
Zn2+
catod (+) Cu2+ + 2e- ![]() Cu
Cu
REMA care se desfasoara in pila este:
Zn + Cu2+
![]() Zn2+ + Cu
Zn2+ + Cu
6.1. Forta electromotoare a pilelor galvanice
Caracteristica cea mai importanta a unei pile galvanice este forta electromotoare (f.e.m.), E, definita ca diferenta dintre potentialele de echilibru ale celor doi electrozi, masurata in circuit deschis:
E = ε+ - ε- (13)
unde: ε+ = potentialul de reducere al catodului;
ε- = potentialul de reducere al anodului.
O pila galvanica functioneaza daca E > 0.
Pentru a determina potentialul de electrod al metalelor, se formeaza o pila galvanica formata dintr-un electrod de referinta si metalul de studiat si se masoara f.e.m. a pilei. Ex.:
(-) ECS//CuSO4/Cu (+)
![]() (14)
(14)
Rezulta:
![]() (15)
(15)
Lucrul electric maxim produs de pila galvanica la temperatura si presiune constanta este egal cu variatia de entalpie libera ce insoteste REMA:
ΔG = -zFE (16)
unde: z = numarul de electroni participanti la REMA;
ΔG = variatia de entalpie libera.
Starea de referinta este cea standard corespunzatoare temperaturii de 25C, pentru substantele gazoase la p=1 atm, iar pentru cele solide si lichide la activitati unitare.
In conditii standard, relatie (16) devine:
![]() =
= ![]() (17)
(17)
unde: ![]() = f.e.m.
standard.
= f.e.m.
standard.
Fie o reactie de forma generala:
aA + bB
![]() cC + dD
cC + dD
F.e.m. a pilei ce functioneaza pe baza reactiei este data de relatia:
![]() (18)
(18)
unde: K = constanta termodinamica de echilibru (exprimata prin activitati).
Activitatea substantelor pure se considera egala cu 1 M.
Folosind relatia (17), izoterma de
reactie van't Hoff ΔG = ![]() + RTlnK devine in conditii de echilibru cand ΔG = 0:
+ RTlnK devine in conditii de echilibru cand ΔG = 0:
![]() = -RTlnK (19)
= -RTlnK (19)
Din relatia (19) se poate calcula
constanta termodinamica de echilibru a reactiei, cunoscand f.e.m. standard ![]() :
:
![]() (20)
(20)
respectiv la 25C:
![]() (21)
(21)
6.2. Termodinamica pilelor galvanice
Reactia decurge spontan in pila daca K>1. Inlocuind ΔG data de expresia (16) in relatia Gibbs-Helmholtz
![]()
aceasta devine:
![]() (22)
(22)
Rezulta:
![]() (23)
(23)
Relatia (23) arata legatura dintre f.e.m. a unei pile reversibile si efectul termic al reactiei electromotric active precum si variatia f.e.m. cu temperatura.
![]() se numeste coeficientul de temperatura al
f.e.m.
se numeste coeficientul de temperatura al
f.e.m.
In practica exista urmatoarele cazuri:
a)
![]() < 0. REMA este exoterma. Pila
se incalzeste prin functionare. F.e.m. scade cu cresterea temperaturii deoarece
energia electrica obtinuta in pila este mai mica decat ΔH;
< 0. REMA este exoterma. Pila
se incalzeste prin functionare. F.e.m. scade cu cresterea temperaturii deoarece
energia electrica obtinuta in pila este mai mica decat ΔH;
b)
![]() = 0. Pila nu absoarbe si nu
cedeaza caldura mediului. Este cazul pilei Daniell. Energia electrica
realizabila in pila egaleaza caldura eliberata in REMA;
= 0. Pila nu absoarbe si nu
cedeaza caldura mediului. Este cazul pilei Daniell. Energia electrica
realizabila in pila egaleaza caldura eliberata in REMA;
c)
![]() > 0. Nu prezinta importanta
practica. F.e.m. creste cu cresterea temperaturii. Pila absoarbe caldura din
exterior (ΔH > 0). Energia electrica este mai mare decat ΔH
(energia chimica) si pila se raceste prin functionare.
> 0. Nu prezinta importanta
practica. F.e.m. creste cu cresterea temperaturii. Pila absoarbe caldura din
exterior (ΔH > 0). Energia electrica este mai mare decat ΔH
(energia chimica) si pila se raceste prin functionare.
7. ELECTROLIZA
Electroliza este procesul de descompunere a substantei dizolvate in solutie sau a topiturii unui electrolit sub actiunea curentului electric.
In celula de electroliza, anodul are un potential pozitiv, iar catodul are un potential negativ. In timpul electrolizei au loc reactii principale (descarcarea ionilor la electrozi) si reactii secundare (ale atomilor sau radicalilor formati prin descarcarea ionilor).
La anod au loc procese de oxidare, iar la catod procese de reducere.
Diferenta de potential minima care trebuie aplicata la electroliza pentru producerea electrolizei se numeste tensiune de descompunere electrolitica, Edesc.
E = εa - εc (24)
unde: εa = potentialul de reducere al anodului;
εc = potentialul de reducere al catodului.
Edesc > E datorita aparitiei fenomenului de polarizare a electrozilor. Polarizarea poate fi chimica si de concentratie. Polarizarea chimica ia nastere in urma reactiilor secundare la electroliza (ex.: degajare de gaz). Polarizarea de concentratie se produce datorita variatiilor de concentratie in spatiul anodic si cel catodic.
Daca solutia contine mai multi ioni, ordinea in care se vor separa la electroliza va depinde de potentialul standard de electrod.
La catod (-) se descarca cationii avand potentialul de descompunere standard mai putin negativ, iar la anod se descarca anionii cu potential de reducere standard mai mic (potential de oxidare standard mai mare).
Ex.:
Ag+ Cu2+ H+ Na+ Ba2+ K+
![]()
creste facilitatea descarcarii la catod
unde: ![]() ;
; ![]() ;
; ![]() ;
;
![]() ;
; ![]() ;
; ![]() .
.
7.1. Legile electrolizei
Au fost descoperite de M. Faraday in 183
In orice descompunere electrolitica, marimea actiunii chimice (m) depinde de cantitatea de electricitate (sarcina electrica) Q care traverseaza solutia sau topitura
m = const Q (25)
unde: const = K = echivalent electrochimic al substantei separate.
Masele diverselor substante separate la electrozi de catre aceeasi cantitate de electricitate se gasesc intre ele in aceeasi proportie ca masele lor echivalente
Depunerea sau dizolvarea prin electroliza a unui echivalent gram necesita o cantitate de electricitate de 1 F (faraday) = 96500 C.
![]() (26)
(26)
unde: Eg = echivalent gram al metalului separat.
Rezulta:
![]() (27)
(27)
Comparand relatiile (25) si (27) se observa ca:
![]() (28)
(28)
Stiind ca:
Q = It (29)
![]() (30)
(30)
relatia (27) devine:
![]() (31)
(31)
unde: m = cantitatea de metal (substanta) depusa la catod (g);
A = masa atomica a metalului;
n = valenta elementului (metalului) separat;
I = intensitatea curentului electric (A);
t = timpul de electroliza (s).
Relatia (31) reprezinta legea lui Faraday.
In practica o parte din energia electrica furnizata celulei de electroliza se pierde sub forma de caldura sau se consuma in unele reactii secundare. De aceea, masa practica depusa la electrozi (mp) este mai mica decat masa teoretica (mt) calculata din legea lui Faraday.
![]() (32)
(32)
η se numeste randament de curent sau randament faradaic.
7.2. Aplicatiile electrolizei
a) Coulometria
Este metoda prin care se determina cantitatea de electricitate necesara depunerii substantei la electrod.
Celulele de electroliza se numesc coulometre si pot fi: gravimetrice (cu Ag, cu Cu), cu gaz si titrimetrice.
Printre coulometrele gravimetrice se foloseste coulometrul cu Ag, in care se electrolizeaza o solutie apoasa de AgNO3, folosind drept catod un creuzet de Ag care se cantareste si ca anod o bara de Ag. Masa metalului depus se afla cantarind catodul inainte si dupa electroliza;
b) Galvanotehnica
Folosirea electrolizei la acoperirea la catod a unor suprafete metalice cu alte metale este cunoscuta sub numele de galvanotehnica si este raspandita atat pentru a proteja suprafetele metalice cat si pentru a le da un aspect placut, in scop decorativ.
Galvanoplastia este procedeul prin care se confectioneaza obiecte metalice pe cale electrolitica sau se repara obiecte metalice defecte.
c) Electrorafinarea
Consta in separarea si purificarea metalelor din solutiile apoase ale ionilor lor. Pe aceasta cale se obtin Cu, Ag, Pb, Zn.
d) Electroliza sarurilor topite
Metalele puternic electropozitive nu pot fi obtinute prin electroliza solutiilor apoase deoarece nu se pot atinge potentialele lor de descarcare nici la cele mai mari densitati de curent si se produce numai degajarea hidrogenului. Obtinerea lor electrochimica se face din saruri topite. Astfel se obtin metalele alcaline, alcalino-pamantoase si aluminiul.
e) Electrosinteza anorganica si organica (oxidari anodice, reduceri catodice)
Electroliza NaCl in solutii apoase este o metoda industriala pentru obtinerea NaOH, Cl2 si H2.
Prin oxidari anodice se prepara: KMnO4, KClO3, H2O2.
7. Electroliza apei
a) Electroliza apei in prezenta de H2SO4
In solutie exista ionii:
H2SO4
![]() 2H+ +
2H+ + ![]()
H2O
![]() H+ + OH-
H+ + OH-
Potentialele standard de reducere sunt:
0,4 V pentru OH- si 2,01
V pentru ![]() .
.
Reactiile la electrozi sunt:
catod (-) 2H+ + 2e- ![]() 2H. reactie
principala
2H. reactie
principala
2H. ![]() H2 reactie
secundara
H2 reactie
secundara
anod (+) se descarca OH- deoarece ![]() mai mare.
mai mare.
2OH- - 2e- ![]() 2OH. reactie principala
2OH. reactie principala
2OH. ![]() H2O +
H2O + ![]() O2
O2
sau 2OH- ![]()
![]() O2
+ H2O + 2e-
O2
+ H2O + 2e-
La catod se degaja H2, iar la anod se degaja O2.
b) Electroliza apei in prezenta de NaOH
In solutie exista ionii:
NaOH ![]() Na+ + OH-
Na+ + OH-
H2O
![]() H+ + OH-
H+ + OH-
catod (-) H+ se descarca
inaintea Na+ deoarece are ![]() mai mare (
mai mare (![]() = -2,71
V).
= -2,71
V).
Reactiile la electrozi sunt:
catod (-) 2H+ + 2e- ![]() H2
H2
anod (+) 2OH- ![]()
![]() O2
+ H2O + 2e-
O2
+ H2O + 2e-
8. COROZIUNEA ELECTROCHIMICA A METALELOR
Coroziunea electrochimica reprezinta cea mai frecventa forma de distrugere a metalelor sau aliajelor. Ea apare la contactul metalelor cu solutii de electroliti sau topituri de saruri si este insotita de trecerea curentului electric.
Cauza coroziunii o constituie instabilitatea termodinamica a metalelor in mediul coroziv bun conducator de electricitate. Coroziunea electrochimica este atribuita adeseori functionarii unor pile locale a caror anozi localizeaza distrugerea propriu-zisa pe anumite portiuni ale suprafetei metalului in timp ce restul suprafetei functioneaza catodic, ramanand neatacata.
Suportul experimental al teoriei pilelor locale consta in influenta pronuntata pe care o exercita asupra vitezei de coroziune a metalelor, neomogenitatile de orice natura, in special incluziunile de impuritati metalice.
Coroziunea electrochimica se desfasoara pe suprafata metalului sub forma a doua reactii de electrod simultane de sens contrar si cu viteze egale. Viteza acestor reactii depinde de valoarea potentialului de electrod.
Una din reactii este reactia anodica, adica ionizarea (oxidarea) metalului:
M ![]() Mz+ + ze-
Mz+ + ze-
A doua reactie este reactia catodica care consta in reducerea unui oxidant capabil sa accepte electronii rezultati prin oxidarea metalului.
Reactia catodica consta in reducerea ionilor de hidrogen, reducerea O2 sau reducerea unui alte substante numita depolarizant:
2H+ + 2e- ![]() H2
H2
coroziune prin depolarizare cu H2 - mediu acid
sau 4H+ + O2 + 4e-
![]() 2H2O
2H2O
coroziune prin depolarizare cu O2 - mediu acid
O2 + 2H2O + 4e-
![]() 4OH-
4OH-
coroziune prin depolarizare cu O2 - mediu alcalin
Reactiile catodice se numesc si reactii de depolarizare. Cele doua procese (anodic si catodic) se vor desfasura simultan la un potential comun numit potential mixt sau potential de coroziune.
Uneori, viteza de coroziune scade si coroziunea devine lenta din cauza unui produs (oxid, sare greu solubila) format pe suprafata metalului. Fenomenul se numeste pasivare.
Deosebirea dintre potentialul de electrod al metalului si potentialul de coroziune consta in faptul ca potentialul de electrod caracterizeaza reactia de ionizare a metalului, electronii care se deplaseaza fiind consumati in reactia de reducere a ionilor aceluiasi metal.
Potentialul de coroziune caracterizeaza procesul de ionizare a metalului, electronii pusi in libertate fiind consumati de depolarizantul existent in mediul coroziv.
Valoarea potentialului de coroziune
εcor este cuprinsa intre potentialul de electrod standard ![]() al metalului supus coroziunii si potentialul
standard de reducere al depolarizantului din mediul coroziv
al metalului supus coroziunii si potentialul
standard de reducere al depolarizantului din mediul coroziv ![]() :
:
![]() >
> ![]() >
> ![]() (33)
(33)
Potentialul de coroziune depinde de natura metalului, de starea suprafetei lui si de mediul coroziv.
9. APLICATII NUMERICE
1) Se dau pilele galvanice:
a) (-) Ca/Ca2+//Zn2+/Zn (+)
b) (-) Pb/Pb2+//Ag+/Ag (+)
Scrieti RPA de la electrozi si REMA.
Rezolvare:
a) RPA:
(-) Ca - 2e- ![]() Ca2+
Ca2+
(+) Zn2+ + 2e-
![]() Zn
Zn
REMA: Ca + Zn2+ ![]() Ca2+ + Zn
Ca2+ + Zn
b) RPA:
(-) Pb - 2e- ![]() Pb2+
Pb2+
(+) Ag+ + e-
![]() Ag |∙2
Ag |∙2
REMA: Pb + 2Ag+ ![]() Pb2+ + 2Ag
Pb2+ + 2Ag
2) Se da pila galvanica:
(-) Mn/Mn2+//Ag+/Ag (+)
Sa se deduca f.e.m. la 25C, folosind relatia lui Nernst.
Rezolvare:
(-) Mn - 2e- ![]() Mn2+ oxidare
Mn2+ oxidare
red ox
RPA:
(+) Ag+ + e-
![]() Ag |∙2 reducere
Ag |∙2 reducere
ox red
![]()
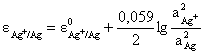
![]()
aAg = 1 M; aMn = 1 M.
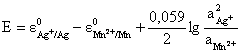
3) Stiind valorile potentialelor de
reducere standard, ![]() = -0,76 V si
= -0,76 V si ![]() = -0,14 V, sa se indice daca pila galvanica
poate functiona:
= -0,14 V, sa se indice daca pila galvanica
poate functiona:
(-) Zn/Zn2+//Sn2+/Sn (+)
Se cunosc: ![]() .
.
Rezolvare:
![]()
E = -0,14 + 0,76 = 0,62 V
E > 0 - rezulta ca pila galvanica poate functiona.
4) Calculati f.e.m. a pilei galvanice:
(-) Mn/Mn2+//Ni2+/Ni (+)
Se cunosc ![]() , iar
potentialele de reducere standard sunt:
, iar
potentialele de reducere standard sunt: ![]() = -1,18 V;
= -1,18 V; ![]() = -0,25 V.
= -0,25 V.
Rezolvare:
![]()
E = -0,25 + 1,18 = 0,93 V
5) Se supune electrolizei o solutie de FeCl Care este echivalentul electrochimic al Fe depus ? Se da: AFe = 56 g/mol.
Rezolvare:
![]()
KFe = 0,19310-3 g/C
6) Care este echivalentul gram al Bi daca pentru depunerea a 10 g Bi din solutia de BiCl3 trebuie sa treaca prin solutie 13850 C ?
Rezolvare:
![]()
=> ![]() g/val
g/val
7) Care este echivalentul gram al Cd daca pentru a depune 0,843 g Cd dintr-o solutie de CdSO4 este necesar un timp de 10 minute si un curent electric de 2,5 A la un randament de 96,5% ?
Rezolvare:
![]()
=> ![]()
![]()
=> ![]()
![]()
ECd = 56,2 g/val
8) Se leaga doua celule de electroliza in serie. La catodul uneia din ele se depun 0,5 g Ag, iar la catodul celeilalte 0,136 g dintr-un metal divalent. Sa se determine masa atomica a metalului necunoscut. Se da: AAg = 108 g/mol.
Rezolvare:
Q este aceeasi la celulele de electroliza legate in serie.
![]()
![]()
=> 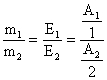
=>
![]() =>
=> ![]()
![]() g/mol
g/mol
9) Sa se calculeze randamentul de curent stiind ca un curent de 2 A depune 8,595 g Cu dintr-o solutie de CuCl2, in timp de 4 ore. Se da: ACu = 64 g/mol.
Rezolvare:
![]()
![]()
![]()
10) Printr-o solutie de AgNO3 trece un curent de 5 A, timp de 20 minute. Randamentul de curent este de 75%. Care este cantitatea de Ag depusa la catod? Se da: AAg = 108 g/mol.
Rezolvare:
![]()
![]()
![]() =>
=> ![]()
![]()
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3873
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved