| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
OCUPAREA ORBITALILOR ATOMICI CU ELECTRONI. STRUCTURA INVELISULUI DE ELECTRONI A ATOMILOR
In cazul atomilor mai grei decat hidrogenul, orbitalii atomici sunt constituiti dupa aceleasi reguli ca si la atomul de hidrogen. Ocuparea cu electroni a acestor orbitali se face respectand urmatoarele principii:
a) Nivelurile energetice in atomi se ocupa cu electroni in ordinea crescanda a energiei lor. Din figura 15 rezulta ca se ocupa mai intai orbitalul 1s apoi 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p etc.
b) Principiul de excluziune al lui Pauli (1925). Un orbital poate fi ocupat de cel mult doi electroni caracterizati prin spin opus (electroni cuplati). Acest principiu mai poate fi formulat si astfel: intr-un atom nu pot exista doi electroni cu toate numerele cuantice identice, ei vor avea cel putin un numar cuantic diferit.
c) Regula lui Hund (1925) Aceasta regula se refera la ocuparea nivelelor energetice degenerate, adica a substraturilor cu mai multi orbitali identici. In asemenea substraturi se ocupa fiecare orbital cu cate un electron pana se capata o multiplicitate maxima (maximul posibil de electroni necuplati, impari) dupa care se completeaza cu al doilea electron (se imperecheaza). Nu incepe completarea unui substrat superior pana ce nu s-a completat substratul inferior. Asezarea stratificata a electronilor se reflecta in configuratia electronica.
Configuratia electronica a atomilor se descrie prin indicarea numarului de electroni alaturi de simbolurile fiecarui tip de orbital in ordinea crescanda a energiei si folosind numerele cuantice n si l.
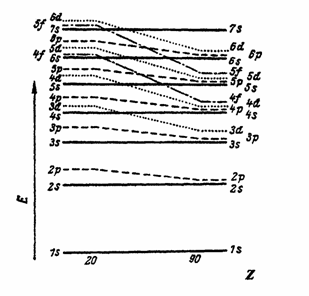
Figura 15. Ordinea crescanda a nivelelor energetice in atom.
Pentru hidrogen, singurul sau electron aflandu-se in orbitalul 1s configuratia electronica este H(1s1). La heliu, al doilea electron ocupa acelasi orbital dand o configuratie stabila de dublet, deci He(1s2). Al treilea electron al litiului nu mai poate intra in orbitalul 1s din primul strat astfel incat incepe ocuparea celui de-al doilea strat cu orbitalui 2s. Deci litiul are configuratia electronica Li(1s2 2s1). Pentru ca fiecare element dintr-o perioada prezinta structura electronica a gazului monoatomic (gaz rar) cu care s-a incheiat perioada anterioara, se poate scrie formula configuratiei electronice utilizand simbolul gazului inert: Li(2He, 2s1).
Pentru primele doua perioade se prezinta in tabelul 3 succesiunea ocuparii straturilor, substraturilor si orbitalilor atomici cu electroni, precum si formula configuratiei electronice a elementelor respective. Pentru fiecare perioada ocuparea straturilor, substraturilor si orbitalilor cu electroni se face astfel:
1: 1s1-2 2He
2: 2He 2s1-2, 2p1-6 10Ne
3: 10Ne 3s1-2, 3p1-6 18Ar
4: 18Ar 4s1-2, 3d 1-10, 4p1-6 36Kr
5: 36Kr 5s1-2, 4d 1-10, 5p1-6 54Xe
6: 54Xe 6s1-2, 5d 1, 4f 1-14, 5d 2-10, 6p1-6 86Rn
7: 86Rn 7s1-2, 6d 1, 5f 1-14, 6d 2-10, 7p1-6
Tabelul 3
Succesiunea ocuparii cu electroni a orbitalilor in primele
doua straturi (perioade)
|
Elemen-tul |
Z |
Strat K (n = 1) |
Strat L (n = 2) |
Formula electronica |
|
2s 2px 2py 2pz |
||||
|
H |
|
1s1 |
||
|
He |
1s2 |
|||
|
Li |
1s22s1 |
|||
|
Be |
|
1s22s2 |
||
|
B |
1s22s22p1 |
|||
|
C |
1s22s22p2 |
|||
|
N |
1s22s22p3 |
|||
|
O |
1s22s22p4 |
|||
|
F |
1s22s22p5 |
|||
|
Ne |
1s22s22p6 |
Este de remarcat ca fiecare perioada se termina cu un element monoatomic (gaz rar) cu configuratii electronice stabile pe ultimul strat si anume configuratie de 2 electroni in cazul heliului (dublet stabil) si de 8 electroni, octet stabil, in cazul celorlalte.
Deoarece nivelul 4s este foarte apropiat in energie de nivelul 3d , la subgrupa VIb elementul Cr prezinta o exceptie avand configuratia 4s1 3d5 in loc de 4s2 3d4 ceea ce conduce la un numar de 6 orbitali monoelectronici cu implicatii deosebite in proprietatile cromului in aliaje si anume rezistenta deosebita la agentii chimici motiv pentru care in industria chimica se utilizeaza numai aliaje cu crom. Asemenea exceptie este generala si pentru Mo si W, din aceeasi subgrupa, molibdenul utilizandu-se in aliaje extrem de rezistente la compresiuni mari iar wolframul este elementul cu cele mai ridicate puncte de topire si de fierbere. Si elementele din subgrupele vecine (sgr. VIIb si Vb) poseda un numar mare de electroni necuplati ceea ce le confera proprietati fizice exceptionale in utilizarea lor ca aliaje. Astfel Mn se afla aliat cu Fe in sinele de cale ferata rezistente la presiuni mari iar vanadiul se intrebuinteaza la fabricarea otelurilor rapide pentru cutitele de strung sau la aliajele de Cr-V pentru fabricarea diferitelor scule. Exceptii asemanatoare in care gasim un singur electron in substratul 4s intalnim si la subgrupa Ib (Cu), la care al doilea electron completeaza substratul 3d9 la 3d10 incat noua configuratie 4s1 3d10 ii confera acestui element o stabilitate mult mai mare, fapt observabil in special la perioada 5 si 6 a acestei subgrupe (Ag, Au) care sunt metale nobile, rezistente la agentii chimici.
Exista si alte exceptii mai putin semnificative la perioadele 6 si 7 la care unul din electronii 6s2 , respectiv 7s2 se afla in substratul 4f , respectiv 5f. Tot datorita tendintei de stabilizare in starea fundamentala, elementul paladiu are ambii electroni 5s in substratul 4d incat configuratia 5s2 4d8 devine 5s0 4d10 ceea ce ii confera acestuia rezistenta mare la agentii chimici.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4920
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved