| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Polaritatea apei si legaturile de hidrogen
Comparativ cu hidrogenul oxigenul este mult mai electronegativ sau atragator de electroni. Aceasta diferenta de afinitate fata de electroni determina o distributie neegala a sarcini electrice (dipol) pe suprafata moleculei, cu o sarcina partial negativa (δ-) spre atomul de oxigen si cu sarcini partial pozitive (δ+) spre atomii de hidrogen. O astfel de inegalitate de repartitie a sarcinii electrice defineste o molecula polara. Pe de alta parte, aceasta polarizare a moleculei determina o interactiune electrostatica intre sarcina negativa al unei molecule (situata spre atomul de oxigen) si sarcina pozitiva al altei molecule (situata catre atomul de hidrogen), stabilind astfel o asa numita legatura de hidrogen (Figura 2.1. si 2.2.). De fapt aceasta legatura este una de tip electrostatic dipol-dipol si a carei tarie depinde de marimea dipolului moleculei. Aceste legaturi sunt legaturi slabe intre molecule apropiate, lungimea de legatura fiind relativ mare, dar obisnuite pentru compozitele biologice si de o importanta deosebita pentru acestea.
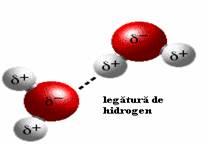
Figura 2.1. Legatura de hidrogen intre doua molecule de apa
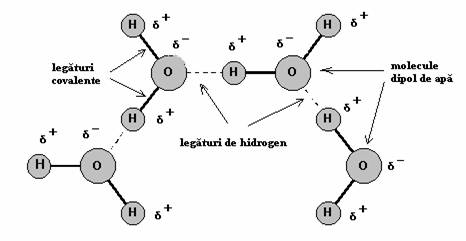
Figura 2.2. Alta reprezentare a formarii legaturii de hidrogen intre molecule polare de apa
Legaturile de hidrogen nu sunt specifice doar interactiunii dintre moleculele apei. Ele pot aparea intre un atom electronegativ (acceptor de hidrogen, de obicei atomi de oxigen sau azot cu perechi de electroni neparticipanti) si un atom de hidrogen legat covalent la un alt atom electronegativ (donor de hidrogen) aflat in aceiasi molecula sau molecula diferita (figura 2.3.)
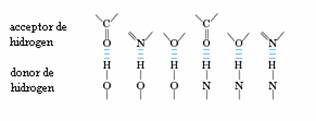
Figura 2.3. Legaturi de hidrogen intre diferite grupari
Legaturile de hidrogen covalente din moleculele de alcani sau alte molecule organice nu sunt suficient de polare pentru a permite formarea de legaturi de hidrogen suficient de puternice. In schimb, in moleculele organice din alte clase, ca de exemplu alcooli, acizi, etc., in care apar hidrogen legat de atomi mai electronegativi, pot stabili legaturi de hidrogen mai puternice. Asa se explica diferentierile dintre punctele de fierbere ale butanolului (1170C) si butanului (-50C) dar si diferentierea solubilitati in apa, butanul fiind insolubil in apa. Biomolecule polare, dar fara sarcini, cum sunt de exemplu zaharurile, pot fi solubilizate usor in apa. Diferite tipuri de legaturi de hidrogen care pot aparea in sistemele biochimice sunt reprezentate in figura 2.4.
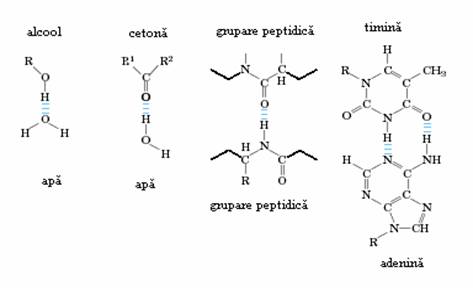
Figura 2.4. Legaturi de hidrogen in sisteme biochimice
Apa are si alte proprietati deosebit de importante in biochimia vietii vii. Aceste proprietati sunt determinate in majoritatea cazurilor de prezenta legaturilor de hidrogen. Dintre acestea mai importante sunt:
SOLVENT - Apa este o substanta cu proprietati de solvatare aproape universale, foarte putine substante nefiind solubile in ea. Compusi ionici sau molecule polare au o afinitate deosebita fata de apa si s-au denumit drept hidrofile (iubitoare de apa). Astfel sarurile, zaharurile sau aminoacizii sunt usor dizolvate de apa. Majoritatea moleculelor care contin carbon si hidrogen sunt hidrofobe (respingatoare de apa).
IONIZARE - Atat substantele cu structura ionica cat si cele cu structuri covalent polara sunt "dispersate" intre moleculele apei sub forma de ioni. Acest fenomen explica solubilizarea usoara a aproape tuturor substantelor in apa. Mai jos este exemplificat procesul dizolvarii sarii de bucatarie (NaCl) care este "rupta" in ionii componenti Na+ si Cl-. In formele vii substantele apar sub forma speciilor ionizate in solutiilor apoase.
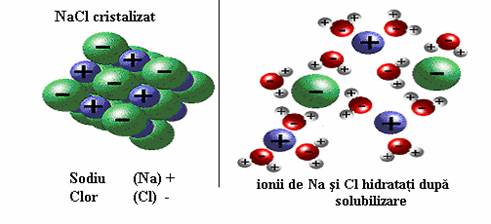
Apa poate stabiliza astfel forme ionizate ale moleculelor ca Na , Cl , K , Mg , Ca , SO4 , PO4 , si HCO . In cazul ionilor pozitivi, moleculele de apa care inconjoara ionul sunt orientate cu partea negativata a moleculei (dipolului) inspre acesta, iar in cazul ionilor negativi cu partea pozitivata a dipolului. Numarul moleculelor de apa care inconjoara un ion s-a definit drept numar de hidratare si variaza in functie de tipul ionului.
COEZIUNEA - Datorita prezentei legaturilor de hidrogen, moleculele apei se "grupeaza" avand astfel o mare coeziune. Acest fapt explica si tensiunea superficiala a apei, care permite unor animale mici sa "mearga (calce)" pe apa. La fel se poate explica "urcarea apei" prin tuburile capilare ale plantelor.
CAPACITATE CALORICA SPECIFICA - Apa are o caldura specifica de 4,2 J g-1 0C-1, adica ia o energie de 4,2 jouli pentru incalzirea fiecarui gram de apa cu 10C. Aceasta valoare foarte mare determina ca apa sa nu-si modifice temperatura foarte usor. Asa se explica fluctuatia lenta a temperaturii marilor si oceanelor, dar si minimalizarea fluctuatiilor termice din interiorul celulelor.
CALDURA DE EVAPORARE - Pentru modificarea starii fizice din lichid in vapori, apa necesita o cantitate mare de energie. Proprietatea este reflectata in sistemele biologice in mecanismul de racire (transpiratie si respiratie); prin evaporare apa extrage caldura din imprejurimi, racind astfel organismele.
CALDURA LATENTA DE TOPIRE - Si la schimbarea din lichid la solid apa necesita o mare cantitate de caldura, deci probabilitatea formarii cristalelor de gheata in sistemele vii este putin probabila.
DENSITATEA - Apa este unica prin faptul ca in stare solida (gheata) are o densitate mai mica decat in stare lichida, astfel incat pluteste. Aceasta determina ca la racirea atmosferei sub zero grade Celsius, apa sa formeaze gheata la suprafata ei, dedesubt ramanand apa lichida, proprietate ce explica posibilitatea vietii in ecosistemele apelor curgatoare si a marilor.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 6350
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved