| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Protectia anticoroziva a metalelor prin acoperiri galvanice: zincarea si nichelarea
Consideratii teoretice
Electrodepunerea metalelor din solutii apoase constituie baza prepararii lor, prin metoda hidroelectrometalurgica, cu o ramura extractiva din combinatii (electroextractia) si o alta ramura, de rafinare, obtinandu-se astfel metale ca: Ni, Zn, Cu, Cd, Sn si Ag.
Depunerea pe cale galvanica (galvanizarea) a straturilor metalice se face in diverse scopuri: cresterea rezistentei la coroziune a pieselor acoperite, imbunatatirea aspectului, marirea duritatii si rezistentei la uzura, scoaterea de copii metalice de pe forme metalice si nemetalice. Tehnologia depunerilor galvanice se imparte in doua ramuri: galvanostegia si galvanoplastia. Galvanostegia este ramura care se ocupa cu obtinerea de straturi metalice relativ subtiri si foarte aderente la metalul de baza. Galvanoplastia este ramura care urmareste realizarea de straturi groase si usor detasabile de pe piesele acoperite.
Pe calea electrodepunerii este posibila si elaborarea de aliaje prin descarcarea simultana pe materialul de baza a doua sau mai multe metale, din aceeasi baie electrolitica.
Galvanizarea este cel mai raspandit procedeu de acoperire cu straturi metalice. Prin galvanizare nu numai ca se pot obtine depozite din toate metalele si aliajele, uzuale si nobile, dar atat grosimea cat si structura si aspectul exterior al depozitului pot fi reglate dupa dorinta si necesitati.
Galvanizarea se realizeaza prin electroliza solutiilor apoase de saruri simple sau complexe, care contin ionul metalului ce trebuie depus. Piesa de acoperit constituie catodul, iar anodul poate fi confectionat, fie dintr-un material inert (varianta cu anod insolubil) fie din metalul care urmeaza sa fie depus (varianta cu anod solubil).
In cazul depunerii catodice, reactia de reducere catodica generalizata este:
Metal de baza (catod): Me(aq) z+ + ze- Mecrist. + n H2O
In general un metal cu potential normal, e , mai negativ se va descarca pe metalul cu e mai putin negativ sau chiar pozitiv. Decurg astfel functiile de electrod ale metalelor coexistente in celula de electroliza. Va functiona deci ca anod acel metal, care are e mai mic, iar ca si catod metalul cu e mai mare, pe scara potentialelor electrochimice. Deci principiul depunerii unui metal pe alt metal consta in existenta unei diferente de potential De pozitive, intre metalul de baza si cel depus.
Alegerea naturii electrozilor si a electrolitului, a pH-ului electrolitului, a temperaturii, a regimului de contactare electrod-electrolit, a densitatii de curent si a timpului de electroliza sunt parametrii de care depinde randamentul depunerilor.
Descarcarea metalelor din solutii apoase decurge intotdeauna la un potential eMe, mai negativ decat potentialul de echilibru ee,Me. Are loc deci o polarizare a electrodului, ca o masura a supratensiunii (h
h eMe ee,Me
Supratensiunea este in functie de natura procesului de electrod si de densitatea de curent.
Deseori reducerea catodica a unui metal se desfasoara simultan cu reducerea hidrogenului. De exemplu, la electroliza unei solutii apoase acide de Zn2+, cu catod de fier si anod de zinc, are loc depunerea zincului la catod, cu degajarea simultana a hidrogenului. Potentialul catodului fiind mai negativ decat al hidrogenului, se vor descarca atat ionii de Zn2+, cat si ionii de H+. Cand ne intereseaza doar depunerea zincului, descarcarea hidrogenului este un proces parazitar, micsorand randamentul depunerii.
Fiecare proces de reducere are o viteza specifica, individuala (k), exprimata cu o densitate de curent (ik), corespunzatoare, deci it = Sik. Pentru a caracteriza gradul de utilizare a curentului trecut prin celula de electroliza, se foloseste frecvent randamentul de curent (rk):
rk
(%) = 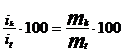
in care:
mk - masa de metal depusa la catod, determinata prin cresterea gravimetrica a acestuia (diferenta dintre masa finala si masa initiala a catodului);
mt - masa teoretica, adica masa de metal ce ar trebui sa se depuna in conditiile experientei cu un randament de 100%, calculata pe baza legilor lui Faraday.
Astfel:
![]()
unde: AMe - masa atomica a metalului depus [g];
z - valenta ionului care se descarca;
F - numarul lui Faraday (96500 C);
I - intensitatea curentului catodic [A];
t - timpul de electroliza [s].
a) Zincarea fierului. Zincul, datorita potentialului sau normal e = - 0,76 V, se foloseste pe scara larga in industrie pentru protejarea pieselor din fier sau aliajelor uzuale ale acestuia, considerate cu potential normal e = - 0,44 V, care urmeaza a functiona in atmosfera coroziva, cu limitarea umiditatii pana la 70 %. In conditii de umiditate peste 75 %, apar produsi de coroziune ai zincului, solubili in apa de condens.
Electrolitul folosit, ca sursa de ioni de Zn(II), este un electrolit sulfat (ZnSO4 7H2O), acidulat cu acid sulfuric la un pH optim, cuprins intre 3-4,5. pH-ul electrolitului are un rol important asupra structurii depunerii. Valori prea scazute de pH produc degajare abundenta de hidrogen si consum anodic excesiv de zinc, cu randamente de curent scazute. Valori ridicate de pH provoaca depunerea unor straturi de zinc cu structura spongioasa. Temperatura de lucru este temperatura camerei, iar durata depunerii 5-10 minute, la o intensitate a curentului electric de 0,4 - 1 A.
Reactiile de reducere catodica sunt:
Fe (-) : Zn2+ + 2e- Zn
Fe (-) : 2H+ + 2e- H2
Reactia de dizolvare anodica a zincului este:
Zn (+) : Zn Zn2+ + 2e-
Aparatura si substante necesare
- circuit clasic de electroliza format din sursa de curent continuu, ampermetru, voltmetru, reostat si celula de electroliza;
- anod din zinc electrolitic de puritate 99,9 %;
- catod-piesa de protejat din fier, fonta sau otel;
- solutie de electrolit;
- hartie abraziva;
- solutie alcalina de degresare (NaOH 20%);
- etuva;
- balanta analitica.
Mod de lucru
Suprafata catodului se prelucreaza cu hartie abraziva de diferite granulozitati, pana la eliminarea rugozitatilor macroscopice evidente, se spala cu apa curenta, pana la indepartarea urmelor de pilitura remanente pe suprafata metalica. Se introduce piesa, sub agitare manuala, intr-un vas cu solutie alcalina de degresare (NaOH 20 %), timp de 2-3 minute, se spala cu apa curenta, apoi cu apa distilata de 2-3 ori si se finiseaza degresarea prin spalare cu alcool etilic. Piesa astfel pregatita se introduce in etuva, pentru uscare la 110 C, timp de 15 minute, iar apoi se scoate si se lasa sa se raceasca in exicator, timp de 10 minute, dupa care se cantareste la balanta analitica pentru a determina masa initiala a catodului (mi).
Se fixeaza electrozii respectand polaritatile sursei de curent, se toarna electrolitul in celula de electroliza astfel incat acesta sa acopere complet suprafata de zincat si se conecteaza instalatia la pozitia de lucru. Se citeste valoarea intensitatii curentului (I) la ampermetru, mentinandu-se constanta la valoarea prescrisa, tot timpul depunerii. Dupa trecerea timpului de electroliza se intrerupe trecerea curentului prin baia de electroliza, se scoate catodul si se spala repetat cu apa distilata si alcool etilic, dupa care se pune in etuva pentru uscare la 110 C, timp de 15 minute, se raceste in exicator 10 minute si se recantareste la balanta analitica determinand masa finala a acestuia (mf).
Manipularile catodului se fac prin prinderea acestuia cu penseta sau cu un cleste de laborator.
Controlul calitatii depunerii: dupa cantarirea piesei se verifica porozitatea depunerii prin aplicarea pe piesa catod a unei hartii de filtru imbibate cu o solutie de fericianura de potasiu, K3[Fe(CN)6]. In dreptul porilor ce descopera suprafata metalului de baza (fierul), apare un precipitat de culoare albastra. Hartia cu solutie reactiv se intinde pe toata suprafata zincata a electrodului si se preseaza prin rostogolirea unei baghete de sticla. Ionii ferosi proveniti din catodul acoperit poros, porii fiind centrele descoperitoare, formeaza cu reactivul, fericianura de potasiu, precipitatul albastru, conform reactiei:
2 K3[Fe(CN)6] + 3 Fe2+ Fe3[Fe(CN)6]2 + 6 K+
Hartia cu reactiv se mentine timp de 15 minute pe suprafata piesei, dupa care se spala si se usuca. Se aleg pe catod mai multe zone (minim 3) cu suprafata de cate 1cm2 fiecare, se numara porii colorati aferenti fiecarei zone, dupa care se face media acestor determinari:
![]() [nr. pori/cm2]
[nr. pori/cm2]
Prelucrarea datelor experimentale
Calculul randamentului de curent (% rk):
% rk = 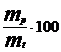
in care: mp = Dm = mf - mi
mt
= ![]() , stiind ca
, stiind ca ![]()
Se fac trei determinari ale randamentului de curent, rezultatele prezentandu-se intr-un tabel de forma:
|
Nr. det. |
I [A] |
t [s] |
mi [g] |
mf [g] |
Dm [g] |
mt [g] |
% rk |
b) Nichelarea lucioasa a cuprului. Nichelul se aplica direct, in scop protector pieselor confectionate din cupru si aliaje ale acestuia. Metalele cum sunt fierul, aluminiul, staniul, se nicheleaza indirect, necesitand cuprarea intermediara. Nichelarea lucioasa a castigat o raspandire tot mai larga in industriile electrotehnica si constructoare de masini, nichelul prezentand o rezistenta ridicata la coroziune chimica, atmosferica (lipsita de SO2), duritate mare, precum si un efect estetic satisfacator.
Exista situatii in practica galvanotehnica si galvanoplastica, cand sunt necesare depuneri de doua sau chiar trei straturi de nichel succesive. Astfel amintim "Nichel Duplex" si "Nichel Triplex", la care prima depunere este mata, iar celelalte, semilucioasa si lucioasa.
Electrolitul, folosit ca sursa de ioni de Ni(II), prezinta doua variante: "Ni-S" si "Ni-C", dupa cum predomina in concentratie sulfatul sau clorura de nichel. Compozitia celor doua variante de bai de nichelare lucioasa este:
|
Componentul |
Solutia "Ni-S" |
Solutia "Ni-C" |
|
Sulfat de nichel NiSO4 7H2O Clorura de nichel NiCl2 6H2O Acid boric H3BO3 Agent de luciu "Cirazin" RSR Temperatura ( C) pH Densitate catodica de curent |
300 g/l 60 g/l 40 g/l 2-8 A/dm2 |
100 g/l 200 g/l 40 g/l 2-10 A/dm2 |
Electrozii: anodul - nichel electrolitic de puritate 99,9 %;
catodul - piesa de nichelat din cupru sau alama.
Anodul din nichel se imbraca intr-un sac de material sintetic. Raportul dintre suprafata catodica/anodica = 1/1 sau 2/1.
Pentru ambele tipuri de solutie de electrolit se recomanda agitarea mecanica a barei catodice. Timpul optim (minute) necesar obtinerii unei depuneri de 10 mm, la diferite densitati de curent, este dat in tabelul:
|
Densitatea de curent [A/dm2] | |||
|
Timpul optim de electroliza [minute] |
In general randamentul de curent al solutiilor "Ni-S" si "Ni-C" este cuprins intre 95 si 98 %.
Baia de nichelare se confectioneaza din otel cauciucat in interior, din sticla sau plexiglas, prevazuta cu termostatare si instalatie de agitare a barei catodice.
Reactiile ce au loc la electrozi sunt:
Cu (-) : Ni2+ + 2e- Ni
Ni (+) : Ni Ni2+ + 2e-
Aparatura si substante necesare
- circuit clasic de electroliza format din sursa de curent continuu, ampermetru, voltmetru, reostat si celula de electroliza;
- anod din nichel electrolitic de puritate 99,9 %;
- catod-piesa de protejat din cupru sau alama;
- solutie de electrolit "Ni-S" sau "Ni-C";
- hartie abraziva cu granulatie fina;
- solventi organici pentru degresare;
- etuva;
- balanta analitica.
Mod de lucru
Suprafata catodului de alama se prelucreaza cu hartie abraziva cu granulatie fina, pana la obtinerea unei suprafete uniforme, lucioase si netede. Se spala abundent cu apa curenta, se degreseaza cu solventi organici, se spala de mai multe ori cu apa distilata, in final cu alcool etilic si se introduce in etuva pentru uscare, la 110 C, timp de 15 minute. Dupa uscare se lasa sa se raceasca in exicator, timp de 10 minute, iar apoi se cantareste la balanta analitica pentru determinarea masei initiale a catodului, (mi).
Se fixeaza electrozii respectand polaritatile sursei de curent, se toarna electrolitul in celula de electroliza astfel incat acesta sa acopere complet suprafata de nichelat si se conecteaza instalatia la pozitia de lucru. Se citeste valoarea intensitatii curentului (I) la ampermetru, mentinandu-se constanta la valoarea prescrisa, tot timpul depunerii. Dupa trecerea timpului de electroliza se intrerupe trecerea curentului prin baia de electroliza, se scoate catodul si se spala repetat cu apa distilata si alcool etilic, dupa care se pune in etuva pentru uscare la 110 C, timp de 15 minute, se raceste in exicator 10 minute si se recantareste la balanta analitica determinand masa finala a acestuia (mf).
Manipularile catodului se fac prin prinderea acestuia cu penseta sau cu un cleste de laborator.
Prelucrarea datelor experimentale
Calculul randamentului de curent (% rk):
% rk = 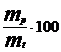
in care: mp = Dm = mf - mi
mt
= ![]() , stiind ca
, stiind ca ![]()
Se fac trei determinari ale randamentului de curent, rezultatele prezentandu-se intr-un tabel de forma:
|
Nr. det. |
I [A] |
t [s] |
mi [g] |
mf [g] |
Dm [g] |
mt [g] |
% rk |
Pentru calculul grosimii stratului de nichel depus se utilizeaza metoda cantaririi, raportata la suprafata piesei, relatia de calcul fiind:
![]() [mm]
[mm]
in care: d - grosimea stratului de metal depus [mm];
mf - masa finala a catodului [g];
mi - masa initiala a catodului [g];
r - densitatea nichelului [g/cm3];
S - suprafata piesei acoperita cu nichel [cm2].
Rezultatele se prezinta intr-un tabel de forma:
|
Nr. det. |
mI [g] |
mf [g] |
S [cm2] |
r [g/cm3] |
d mm] |
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3769
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved