| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Reactiile cu elementele
Oxigenul este un element foarte reactiv si multe metale si nemetale reactioneaza usor cu acesta printr-o reactie specifica de ardere in urma careia rezulta oxizi, subiect discutat in cadrul fiecarei grupe separat.
Sulful este mai putin reactiv comparativ cu oxigenul, ramanand totusi un element relativ reactiv, care, atunci cand este incalzit, reactioneaza direct cu elementele nemetalice, oxigenul, hidrogenul, halogenii (cu exceptia iodului), cu carbonul si fosforul, dar si cu numeroase metale pentru a rezulta sulfuri.
Seleniul si telurul sunt mult mai putin reactive comparativ chiar cu sulful, dar cand sunt incalzite, reactioneaza totusi cu multe metale si nemetale.
Utilizarea elementelor
Oxigenul
Cantitati importante de oxigen sunt utilizate in industria otelurilor. O alta cale importanta de utilizare o constituie reactiile de oxidare din chimia compusilor organici, un exemplu concludent fiind reactia de oxidare a etilenei, CH2=CH2, la oxid de etilena, compus de importanta economica deosebita:
![]()
Per de alta parte, caldura rezultata din arderea hidrocarburilor are mare importanta. De la utilizarea acesteia la flacara arzatoarelor utilizate in pregatirea hranei in casa (aragaz sau gazul metan) la taierea fierului prin intermediul flacarii oxiacetilenice sau la combustibilul rachetelor cosmice nu reprezinta decat utilizari alternative ale acestor compusi.
Sulful
Este utilizat in multe domenii casnice precum cel al fabricarii chibriturilor, impotriva insectelor sau in vulcanizarea cauciucurilor. Oricum, majoritatea cantitatilor de sulf utilizate pe plan mondial se regasesc in industria acidului sulfuric si derivatilor sai.
Seleniul
La fel ca si sulful acest element se regaseste in vulcanizarea gumelor speciale, dar si in celulele fotovoltaice, a caror importanta capata tot mai multa incredere si utilizare.
Hidruri (combinatii cu hidrogenul)
Toate elementele grupei a VI-a formeaza hidruri de tipul H2X. Cu exceptia apei, acestea sunt toate otravitoare si cu miros neplacut. In tabelul VII.2 sunt prezentate cateva din caracteristicile fizico-chimice ale acestor combinatii.
Tabelul 7.2 Cateva proprietati ale hidrurilor elementelor grupei a VI-a
|
Proprietatea |
H2O |
H2S |
H2Se |
H2Te |
|
Greutate moleculara | ||||
|
p.t. (K) | ||||
|
p.f. (K) | ||||
|
Entalpia de formare (kJ/mol) | ||||
|
Entalpia de vaporizare (kJ/mol) | ||||
|
Energia termodinamica a legaturii M-H (kJ/mol) |
Asa cum se observa din table, proprietatile apei difera esential de celelalte combinatii; multiplele deviatii pot fi usor explicate daca se accepta formarea legaturilor de hidrogen, mai ales in cazul moleculelor de apa.
In plus fata de exprimarea formulei H2X, apa mai poate forma un compus H2O2, peroxidul de hidrogen sau apa oxigenata, iar sulful poate forma o serie intreaga de compusi cu hidrogenul, cunoscuti sub numele generic de sulfani; acestea sunt lichide instabile termodinamic, de culoare galbena.
Apa
Asa cum s-a mentionat anterior proprietatile apei par sa difere esential de combinatiile corespunzatoare ale celorlalte elemente ale grupei.
Proprietatile fizice
Faptul ca apa este lichida la temperatura camerei cu entalpii mari de formare si vaporizare pot fi atribuite existentei legaturilor de hidrogen intermoleculare. Modul de prezentare a moleculei de apa este cel reprezentat de figura 7.3. Datorita prezentei perechii de electroni neparticipante la legaturi, molecula prezinta un moment dipol (lichidul prezentand un induce inalt de permisimibilitate, respectiv de constanta dielectrica)
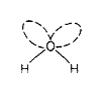
Figura 7.3
In gheata, se formeaza o structura tridimensionala, in care atom de oxigen al fiecarei molecule de apa este inconjurat de patru molecule de apa per sarcina pozitiva, aranjati aproximativ tetraedric in jurul acesteia.
Proprietatile de solvent ale apei
Marea permitivitate (constanta dielectrica a apei) determina ca aceasta sa prezinte proprietati de dizolvant specifice. In plus, deoarece apa este constituita de unitati polare, introducerea unor specii ionice cu polarizare cunoscuta, determina modificari ale aranjamentului initial ale moleculelor de apa in contextul aranjarii lor, in sensul orientarii acestor dipoli pentru a satisface anumite cerinte ale ionilor dizolvati, asa definitul numar de hidratare. Cu toate ca aceasta ar fi un bun mijloc de explicare a dizolvarii unor substante in apa, ramane insa neelucidata problema dizolvarii unor substante neionice, care totusi isi pot avea o explicatie prin interactiunea prin legaturi de hidrogen cu acestea, formula lor prezentand intotdeauna atomi de oxigen sau hidrogen, capabile sa formeze legaturi de hidrogen cu moleculele apei. Spre exemplu, in cazul substantelor care contin grupari OH, precum alcoolii, acizii carboxilici si unii carbohidrati sunt solubili in apa, cu toate ca restul molecular ar spune ca dizolvarea nu este posibila.
Proprietatile chimice ale apei
Asa cum era de asteptat din entalpia de formare apa este un compus extrem de stabil si doar incalzit in stare de vapori in jurul temperaturii de 1300 K disociaza slab in elementele componente. Apa pura aproape ca nu este conductoare de electricitate cu toate ca exista o slaba disociere a moleculelor ei:
![]()
Astfel apa se poate comporta atat ca si acid, fata de baze mai puternice decat ea:
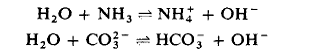
sau ca baza atunci cand se intalneste cu astfel de situatii:
![]()
Apa se comporta atat ca agent oxidant cat si ca agent reducator:
![]()
Multe metale, in special cele mai electropozitive cum sunt sodiul sau calciul, reactioneaza cu apa cu formare de hidrogen:
![]()
reactia pare a fi vizualizata ca:
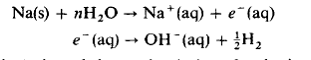
S-au obtinut dovezi in privinta electronului hidratat e-(aq); in reactia vaporilor de sodiu cu gheata la 273 K se formeaza o coloratie albastra atribuita formarii acestei specii, ca si in cazul reactiei sodiului cu amoniacul lichid.
Hidroliza
Termenul de hidroliza este utilizat mult pentru a exemplifica:
reactia directa a apei cu o substanta, de exemplu hidroliza unui ion:
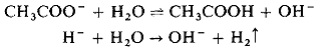
sau hidroliza unei molecule:
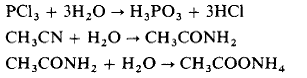
disocierea apei coordinate la un cation, cu formarea unui specii hidroxo ionice:
![]()
De notat ca initial procesul este unul de atractie electrostatica dintre moleculele de apa si ion, urmat de formarea legaturilor covalente, iar in contrast cu hidratarea molecula de apa se desface.
Apa grea, oxidul de deuteriu D2O
Apa grea se obtine ca reziduu la electroliza indelungata a apei. Asa cum ii indica si numele ea este mai densa decat apa (1,11 g/cm3) avand si un punct de fierbere ceva mai ridicat 374 K precum si mici diferentieri in comportamentul fizic general. Din punct de vedere chimic apa grea se comporta la fel cu apa obisnuita, dar viteza de reactie sau unele produse pot diferi. Astfel, apa grea se aditioneaza la saruri anhidre pentru a forma deuterati, analogi ai hidratilor, ca de exemplu in cazul cuprului CuSO4x5D2O. Hidroliza tricarburii de aluminiu pentru a forma metan este o reactie rapida, iar in cazul utilizarii apei grele singurul produs care se formeaza, dar incet este deuterometanul D4C. Alt exemplu in constituie fermentarea glucozei care in prezenta apei grele decurge mult mai lent.
Apa grea si-a gasit diverse utilizari in laboratoare cum ar fi marcarea unor compusi pentru urmarirea unor procese, la obtinerea unor compusi deuterati, dar cea mai utilizata cale o reprezinta utilizarea acesteia drept moderator in reactoarele nucleare, avand proprietati superioare carbonului.
Apa oxigenata, hidrogen peroxidul H2O2
Unicitatea apei oxigenate deriva din multiplele posibilitati prin care poate fi obtinuta:
din oxigen si hidrogen prin
a. arderea hidrogenului in oxigen si racirea rapida a flacarei pe gheata
b. prin expunerea amestecului de oxigen si hidrogen la actiunea directa a luminii ultraviolete puternice
c. prin expunerea aceluiasi amestec la diferite radiatii radioactive, electroni sau neutroni
prin trecerea unui fulger prin vaporii de apa, care poate conduce la solutii concentrate de apa oxigenata
prin procese oxidative cum ar fi arderea hidrocarburilor, a acizilor grasi sau chiar a unor metale
prin oxidare electrolitica.
In multe din aceste procese se crede ca sunt implicati radicali liberi hidroxil HO-, apa oxigenata fiind rezultatul unirii a doi astfel de radicali:
![]()
Peroxidul de hidrogen in stare pura este un lichid incolor cu punct de topire 272,5 K si densitate de 1,4 g/cm3. La incalzire la presiune atmosferica se descompune inainte de a atinge punctul de fierbere; o crestere brusca a temperaturii poate determina explozii, descompunerea fiind o reactie extrem de exoterma:
![]()
Aceasta este o reactie de disproportionare, puternic catalizata de lumina si de o serie de alte materiale, printre care metalele (Cu, Fe, etc.), in special materiale cu suprafata specifica mare. Atentie marita datorita faptului cu unele dintre acestea pot determina explozie.
Peroxidul de hidrogen poate fi conservat pur in sticle brune, la intuneric sau in vase de aluminiu care au suprafata lucioasa.
Ca structura peroxidul de hidrogen se prezinta astfel:
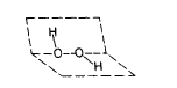
Datorita instabilitatii puternice in stare pura si a solutiilor foarte concentrate, peroxidul de hidrogen este utilizat in special sub forma unor solutii diluate. Concentratia acestor solutii este adesea exprimata in termenii volumici de oxigen eliberat atunci cand acesta se descompune din solutie:
![]()
Astfel o solutie "10 volumica" este cea care dintr-un cm3 formeaza 10 cm3 de oxigen la presiune normala.
Solutiile apoase de peroxide de hidrogen se descompun lent, descompunerea fiind catalizata de alcalii, lumina sau de catalizatori heterogeni, precum praful, platina pulbere (neagra) sau oxidul de Mn(IV), acesta din urma fiind utilizat in laborator pentru prepararea oxigenului din solutii de apa oxigenata.
Aciditatea acestor solutii este slaba, fiind un acid dibazic slab, constanta de disociere:
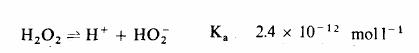
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1833
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved