| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
IONUL SODIU (NATRIU) Na+
Numar de oxidare + 1. Pentru executarea reactiilor se foloseste o solutie ce contine ionul Na+, de exmplu NaCl.
Reactii pe cale uscata
Reactia de culoare a flacarii
Sarurile de sodiu coloreaza flacara incolora a unui bec in galben intens. Aceasta reactie este foarte sensibila.
Reactii pe cale umeda
Hexahidroxostibiatul de potasiu K Sb(OH)6 formeaza in solutie neutra sau slab alcalina un precipitat alb, cristalin, de hexahidroxostibiat de sodiu, Na Sb(OH)6 . Precipitarea se poate grabi frecand peretii interiori ai eprubetei cu o bagheta de sticla.
(Na+ + Cl-) + (K+ + Sb(OH)6 Na Sb(OH)6 + (K+ + Cl)
Hexahidroxostibiatul de sodiu se descompune sub actiunea acizilor, formand acid stibic (precipitat alb, amorf).
Na Sb(OH)6 + (H+ + Cl-) H3SbO4 + 2 H2O + (Na+ + Cl-)
Datorita acestei comportari reactia nu se efectueaza niciodata in mediu acid. Hexahidroxostibiatul de potasiu este reactivul specific al ionului de sodiu, insa solutia nu trebuie sa contina alti ioni.
IONUL POTASIU (KALIU) K+
Numarul de oxidare: 1+. Pentru executarea reactiilor se foloseste o solutie ce contine ionul K+ , de exemplu KCl.
Reactii pe cale uscata
Reactia de culoare a flacarii
Sarurile de potasiu coloreaza flacara incolora a unui bec in albastru violet. In prezenta sarurilor de sodiu, culoarea galben intens mascheaza culoarea violeta. Culoarea violet se poate observa privind flacara printr-o sticla de cobalt, care absoarbe radiatiile galbene ale sodiului, lasand sa treaca numai pe cele violete ale potasiului.
Reactii pe cale umeda
1. Acidul percloric, HClO4, formeaza cu ionul K+ un precipitat alb, cristalin, de perclorat de potasiu.
(K+ + Cl) + (H+ + ClO4-) = KClO4 + (H+ + Cl-)
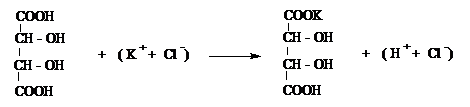
2.
Acidul tartric, C4O6H6, formeaza
in solutii neutre si nu prea diluate ale sarurilor de potasiu
si in prezenta acetatului de sodiu un precipitat alb de tartrat acid
de potasiu (bitartrat de potasiu) usor solubil in acizi minerali sau
hidroxid de sodiu, greu solubil in acid acetic si alcool.
(H+ + Cl-) + (Na+ + CH3COO-) = CH3COOH + (Na+ + Cl-)
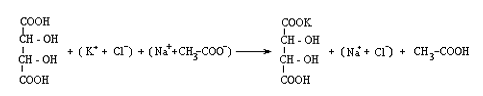
Deoarece
precipitatul este dizolvat de catre acidul mineral care rezulta din
reactie, precipitarea este incompleta; pentru a inlatura
dizolvarea partiala a bitartratului, precipitarea se face in
prezenta acetatului de sodiu care formeaza cu acidul acetic rezultat
din reactie un amestec tampon care mentine o concentratie a
ionilor hidroniu favorabila precipitarii.
Aparitia precipitatului este favorizata de frecarea peretilor eprubetei cu o bagheta.
3. Hexanitrocobaltiatul trisodic, Na3 Co(NO2)6 , formeaza in solutii neutre sau slab acetice un precipitat galben cristalin, de hexanitrocobaltiat de sodiu si potasiu.
2(K+ + Cl-) + (3Na+ + Co(NO2)6 ) = K2Na Co(No2)6 + 2(Na+ + Cl-)
Aceasta este una din cele mai sensibile reactii pentru identificarea potasiului (reactia specifica). Solutia nu trebuie sa fie alcalina, pentru ca precipita Co(OH)3 verde brun, de asemeni nu trebuie sa contina ioni NH4+ care formeaza cu reactivul un precipitat galben cristalin.
IONUL AMONIU (NH4+)
Pentru efectuarea reactiilor se foloseste o solutie ce contine ionul NH4+, de exemplu NH4Cl.
Reactii pe cale uscata
Sarurile de amoniu se descompun prin incalzire in acid (sau derivati ai acestuia) si in amoniac (ce se recunoaste dupa mirosul caracteristic).
De exemplu: NH4Cl NH3 + HCl
NH4NO3 N2O + 2H2O
3(NH4)2SO4 3SO2 + 4NH3 + N2 + 6H2O
Reactii pe cale umeda
1. Bazele: NaOH, KOH, Ca(OH)2, descompun prin incalzire sarurile de amoniu, degajand amoniacul. Acesta se recunoaste dupa miros sau prin inalbastrirea hartiei umede roz de turnesol.
(NH4+ + Cl-) + (Na+
+
2.
Reactivul Nessler, care este o solutie alcalina de
tetraiodomercuriat de potasiu
(NH4+ + Cl-) + (Na+
+
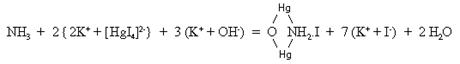
Este o reactie sensibila si serveste la identificarea urmelor de amoniac din apele de baut (reactie specifica).
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2927
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved