| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Structura compusilor organici
Structura reprezinta modul de aranjare a atomilor in spatiul molecular.
Legaturi chimice in compusii organici. Legatura covalenta
Majoritatea legaturilor chimice din compusii organici sunt de natura covalenta.
Teoria electronica a covalentei
Fizicianul german Kssel si chimistul american Lewis au aratat independent unul de celalalt ca in transformarile chimice ale atomilor intervin electronii stratului de valenta (ultimul strat). Realizarea configuratiei stabile de dublet sau de octet se poate face in doua moduri:
a) Prin transfer de electroni de la metal la nemetal, cu formare de ioni, intre care apar atractii electrostatice, realizandu-se legatura electrovalenta (ionica):
Li + F Li+ + F LiF
b) prin punerea in comun de electroni, realizandu-se legatura covalenta (covalenta).
Aceasta este o legatura chimica propriu-zisa pe care ne-o putem explica prin atractia celor doua nuclee pozitive pentru de electronii dintre ele:
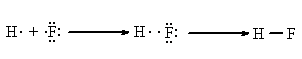
Observatii
Atomii de carbon si hidrogen realizeaza cu preponderenta covalente in detrimentul legaturii ionice, datorita electroneutralitatii lor si volumului atomic mic care permite intrepatrunderea orbitalilor (apropierea avansata a atomilor).
- ionul C4+ nu exista datorita disproportiei mari dintre sarcina si volum
- ionul C4- exista in carburile metalice, in absenta apei (de ex:Al4C3)
Al4C3 + 12H2O 3CH4 + 4Al(OH)4
- ionul H+ exista numai legat covalent de moleculele de apa in solutii apoase (ion hidroniu) si apare in reactiile protolitice.
- ionul H--(hidrura) se intalneste in hidruri metalice, in absenta apei (NaH, CaH2).
H:-- + H2O H2 + OH-

Atomul de carbon prezinta capacitatea unica de a crea catene
de carbon de diferite forme si dimensiuni. Siliciul formeaza catene a caror
stabilitate este cu 50% mai mica decat a atomului de carbon (datorita volumului
mare). De asemenea, vecinii din perioada a doua formeaza legaturi slabe
datorita repulsiilor dintre e- neparticipanti:
Daca un atom legat covalent poseda electroni care nu au participat la realizarea covalentei (electroni neparticipanti) poate genera cu acestia legaturi coordinative sau poate exercita efecte electronice.
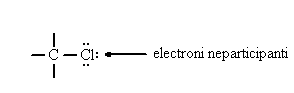

Nu se poate face o distinctie neta intre
chimia anorganica si chimia organica in ceea ce priveste natura legaturilor. De
exemplu in chimia anorganica se intalnesc ioni complecsi formati prin
covalenta:
In chimia organica apar ioni in substante ionice si in intermediari de natura ionica.

Exemple
de intermediari:
Kernelul reprezinta sarcina nucleara a unui atom egala cu grupa in care se gaseste atomul. La stabilirea sarcinilor fiecarui atom scadem din sarcina kernelului numarul de electroni implicati (un electron pentru fiecare legatura si doi electroni pentru electroni neparticipanti).
Teoria cuantica a covalentei
Teoria cuantica a covalentei are la baza ideea ca electronii in vecinatatea a doua sau mai multor nuclee isi modifica functia de unda prin deformarea orbitalilor atomici (O.A) care prin intrepatrundere genereaza orbitali moleculari (O.M). Matematic teoria orbitalilor moleculari se realizeaza prin metoda L.C.A.O. (combinatia liniara a orbitalilor atomici), metoda in care se obtin tot atati orbitali moleculari cati orbitali atomici au participat la combinare.
fAB=CAfA+CBfB fAB - orbital molecular de legatura
fA fB - orbitali atomici
f AB= CAfA- CBfB CA, CB- parametri variabili in asa fel incat sistemul sa prezinte valoarea energetica minima.
Y*AB - orbitali moleculari de antilegatura.
Orbitalul molecular de legatura are un puternic caracter de atractie si valoare energetica mica. Orbitalul molecular de antilegatura are caracter de repulsie, valoare energetica ridicata si este ocupat cu electroni numai in starile excitate ale moleculei.
Caracteristicile legaturilor covalente
1. Polaritatea
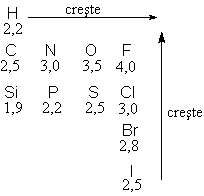 Kernelul atomic manifesta o anumita
atractie pentru electronii covalentei, aceasta reprezentand
electronegativitatea atomului.
Kernelul atomic manifesta o anumita
atractie pentru electronii covalentei, aceasta reprezentand
electronegativitatea atomului.
Valori ale electronegativitatii (x)
<x>=eV
In legatura heteronucleara apare un dezechilibru electric al sarcinii, legatura se transforma intr-un dipol, capata un partial caracter ionic, atomii se incarca cu sarcini electrice fractionare. Procentul ionic al covalentei depinde de diferenta de electronegativitate a atomilor si se calculeaza cu relatia:
![]()
Exemple C-H 5% H O 40%
C-O 22% N-O 6%
Polaritatea se masoara printr-un moment de dipol (m), marime vectoriala (marime cu directie, sens, valoare).
m =e*d
<m>=1D (Debye) = 10-18unitati electrostatice
Notatii:
CH3-Cl sau CH3-Cl
 Polaritatea
respecta de obicei diferenta de electronegativitate a atomilor, existand insa
si o exceptie la carbonul hibridizat sp3 legat de hidrogen (dipol
inversat):
Polaritatea
respecta de obicei diferenta de electronegativitate a atomilor, existand insa
si o exceptie la carbonul hibridizat sp3 legat de hidrogen (dipol
inversat):
Valoarea momentului de dipol al covalentei depinde si de tipul de hibridizare a atomilor legati (cu cat procentul de orbital s creste in hibrid, cu atat creste electronegativitatea atomului). Aceasta reprezinta "momentul de dipol atomic".
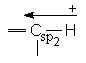
![]()
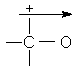
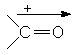
(%s = 33,3) (%s = 50) m = 1,43D m = 2,7D
m = 0,6D m = 1D
Momentul de dipol molecular este o rezultanta a momentelor de dipol ale legaturilor, astfel in cazul moleculelor simetrice momentul de dipol molecular este nul:
m CCl4 = 0D
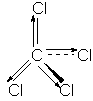 m CH3Cl = 1,86D
m CH3Cl = 1,86D
m CH3Cl = 1,86D
m CH2Cl2 = 1,56D
m CHCl3 = 1,02D
m o-C6H4Cl2 = 2,26D
m m-C6H4Cl2 = 1,48D
m p-C6H4Cl2 = 0D
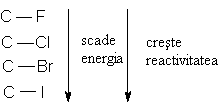
2. Lungimea covalentelor
Reprezinta distanta internucleara la care valoarea energetica a sistemului este minima (vezi 2.1.2.) sau este egala cu suma razelor atomice covalente.
Caracteristici:
Lungimile covalentelor pentru atomi de acelasi tip variaza foarte putin de la compus la compus; regula aditivitatii nu se aplica in cazul moleculelor in care apare conjugare si mai ales conjugari izovalente.
Lungimile legaturilor covalente ale elementelor perioadei a 2-a cu hidrogenul sunt de aproximativ 1 Å.
Lungimile legaturilor simple intre atomii elementelor perioadei a 2-a sunt de aproximativ 1,5 Å.
Lungimile legaturilor multiple pentru elementele perioadei a 2-a sunt de aproximativ 1,2-1,3 Å.
Lungimile legaturilor realizate cu orbitali hibrizi sp2 sau sp sunt cu aproximativ 0,1 Å mai scurte decat cele realizate cu hibrizi sp3.
Lungimile legaturilor covalente cresc in grupa de sus in jos odata cu cresterea razei atomice.
3. Energia de legatura
Energia de disociere reprezinta energia consumata la desfacerea unei anumite legaturi dintr-un compus sau energia degajata la formarea ei (depinde de structura compusului).
CH3OH DC-O=91kcal/mol
C6H5OH DC-O=112kcal/mol
CH3Cl DC-Cl=84kcal/mol
CH2=CH-CH2-Cl DC-Cl=69kcal/mol
(explicatia: vezi efectele electronice 2.2.5.)
Caracteristici:
Energiile de legatura ale covalentelor simple ale elementelor perioadei a 2-a sunt cuprinse intre 50 si 100 kcal/mol.
Obs: intre atomii cu electroni neparticipanti se realizeaza legaturi mai slabe:
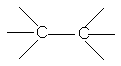
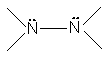
![]()
39 kcal/mol 35 kcal/mol 83 kcal/mol
Energiile de legatura ale legaturilor multiple sunt mai mari decat ale legaturilor simple, insa mai mici decat dublu sau triplu acestora:

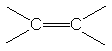
![]()
 83 kcal/mol 146 kcal/mol<2x83 200
kcal/mol<3x83 8din cauza legaturilor p mai slabe)
83 kcal/mol 146 kcal/mol<2x83 200
kcal/mol<3x83 8din cauza legaturilor p mai slabe)
Energiile de legatura scad in grupa de sus in jos:
- datorita intrepatrunderii mai slabe
Energiile de legatura aleelementele perioadelor mari sunt mai mici decat ale elementelor perioadei a 2-a (in special la legaturile multiple)
>C=C< >C=S
146 kcal/mol 128 kcal/mol
Forte intermoleculare
Sunt de natura electrostatica si natura fizica si influenteaza proprietatile fizice ale compusilor organic.:
Forte van der Waals
Apar intre molecule nepolare sau foarte slab polare, in stare lichida sau solida cand distantele intermoleculare sunt de 3-4 Å. Fortele apar datorita unui moment de dipol indus fenomenul de polarizabilitate (atractia nucleului dezecranat a unei molecule pentru electronul celeilalte molecule). Taria fortelor depinde de marimea moleculelor si de forma acestora.
CH4 C4H10 nC5H12 neo C5H12
M=16 M=58 M=72 M=72
p.f.= -161 C p.f.= 0 C p.f.= 36 C p.f.= 9,4 C
Forte dipol-dipol
Apar intre molecule cu dipolmoment permanent si sunt mai puternice decat fortele van der Waals
C4H10 CH3-CO-CH3
M=58 M=58
(forte van der Waals) forte (dipol - dipol)
p.f.= 0 C p.f.= 54 C
Legaturi de hidrogen (punti de hidrogen)
In cazul in care atomul de hidrogen este legat de un atom cu electronegativitate mare si volum atomic mic (O,N), acesta se comporta ca o sarcina izolata pozitiva care manifesta atractie pentru un centru negativ (orbitali cu electroni neparticipanti sau o sarcina partial negativa). Puntea de hidrogen este formata dintr-un atom de hidrogen cuprins intre doi atomi cu electronegativitati mari si ea depinde de diferenta de electronegativitate si este mai puternica cand este liniara.
 Cand puntile de hidrogen se
realizeaza intramolecular ele se numesc legaturi chelatice.
Cand puntile de hidrogen se
realizeaza intramolecular ele se numesc legaturi chelatice.
Stereochimie
Generalitati. Clasificarea izomerilor
Izomerii sunt substante cu aceeasi formula moleculara, dar cu structuri si implicit proprietati diferite. Dupa sediul deosebirilor structurale exista doua mari clase de izomeri:
- izomeri de constitutie (de catena) - diferentiati dupa modul de aranjare a atomilor in catena sau dupa succesiunea atomilor in catena;
- izomeri sterici (stereoizomeri) - diferentiati dupa modul de aranjare a atomilor in spatiu
Izomerii de constitutie:
de catena
de pozitie
de functiune
dinamici (tautomeri)
de compensatie
Izomerii sterici:
izomeri de configuratie - enantiomeri
- diastereoizomeri
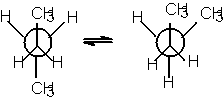
izomeri de conformatie
Formule stereochimice
Modelul spatial al unei molecule organice este reprezentat in planul bidimensional al hartiei prin formule conventionale.
a) Formule de configuratie:
- redau modelul tetraedric al atomului de carbon;
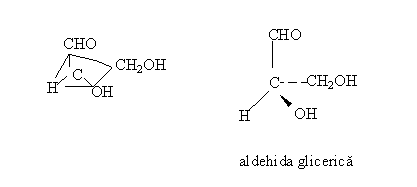
- sunt utile pentru molecule mici, dar devin incomode in
cazul moleculelor mari.
b) Formule perspectivice:
- provin din formule de configuratie prin aducerea atomului de carbon in planul hartiei;

- covalentele situate deasupra planului hartiei se
reprezinta prin linii ingrosate (pana) sau continue, iar cele situate
dedesuptul planului prin linii subtiri sau intrerupte.
c) Formule de proiectie:
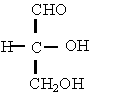
- provin din formule de configuratie sau perspectivice prin
rabaterea tuturor atomilor in planul hartiei.
In concluzie covalentele orizontale sunt situate deasupra planului hartiei, iar covalentele verticale dedesuptul planului hartiei. Se mai utilizeaza formulele de proiectie axiale sau formulele de proiectie "capra" (dupa capra de taiat lemne ) pentru moleculele cu doi sau mai multi atomi de carbon, care redau dispozitia atomilor fata de o axa de torsiune.
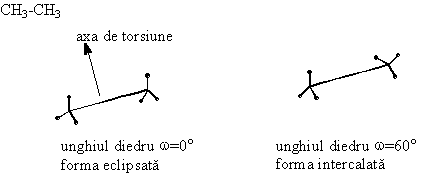
Formulele de
proiectie Newman provin din formule axiale prin proiectarea lor de-a lungul
axei de torsiune. Capatul apropiat al axei se reprezinta printr-un punct, iar
capatul departat printr-un cerc.
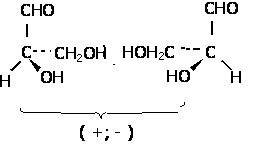
Enantiomeri
Enantiomerii sunt izomeri sterici de configuratie a moleculelor chirale.
A. Caracteristici
a) Molecula cu aceeasi geometrie (unghiuri, lungimi de legatura intre atomii legati si atomii nelegati, energii) si deci cu aceleasi proprietati fata de factorii achirali. Sunt in relatie de nesuperpozabilitate, deci relatia obiect - imagine in oglinda.
b) Fata de factorii chirali au comportamente diferite. De exemplu fata de planul luminii polarizate actioneaza diferit (rotesc planul luminii polarizate cu acelasi unghi a, insa in sensuri opuse). Valoarea unghiului a pentru substante optic active depinde de:
- lungimea stratului strabatut, l - dm
- concentratia solutiei, g - g/100 cm3 solutie
- densitatea substantei pure, d - g/cm3
- temperatura, t
- lungimea de unda a luminii
Valoarea unghiului a (citita la polarimetru) se transforma pentru toate substantele optic active in "rotatie specifica"
a Dt a/l x d (substanta solida )
a Dt a/l x g) x 100 (solutii)
Se numeste substanta "optic pura" substanta formata dintr-un singur enantiomer. Puritatea optica a probei se calculeaza:
%Puritate = ( a Dtproba / a Dt enantiomer pur ) x 100
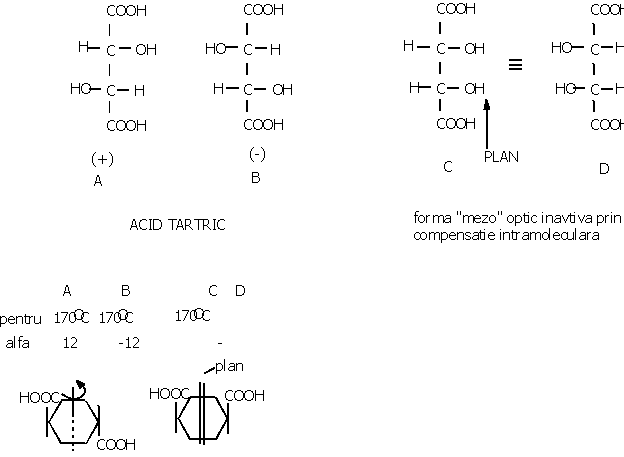
Enantiomerul care roteste planul luminii spre dreapta se numeste dextrogir si se noteaza cu d sau (+). Enantiomerul care roteste spre stanga se numeste levogir si se noteaza cu l sau (-). Amestecul echimolecular a celor doi enantiomeri se numeste "amestec racemic" si este optic inactiv, prin compensatie intermoleculara si prezinta proprietati diferite fata de cei doi enantiomeri. Notatie: d, l sau R, S sau
|
Acid tartric |
Punct de topire |
a |
|
d |
C | |
|
l |
C | |
|
d,l |
C |
¾ |
Dedublarea, scindarea in enantiomeri a racemicului se face prin mai multe metode:
metode mecanice - exista putine cazuri in care cei doi enantiomeri cristalizeaza astfel incat cristalele unui enantiomer sunt vizibil distincte de cele ale celuilalt;
metode biochimice - exista enzime care consuma sau transforma doar unul din enantiomeri, celalalt ramanand neschimbat;
metode chimice - transformarea amestecului racemic acid sau bazic in diastereoizomeri care avand proprietati diferite pot fi usor separati;
A (-) A (+) + B (-) A (-) B (-) + A (+) B (-)
acid baza diastereoizomeri
A (-) B (-) + acid A (-) + B (-) acid
- dizolvarea selectiva in solventi chirali sau absortia pe materiale optic active.
B. Chiralitatea = nesuperpozabilitate; proprietatea geometrica de nesuperpozabilitate; relatie obiect-imagine in oglinda. Termenul deriva de la numele grecesc al mainii "cheir".
Exista chiralitate: - centrala
- axiala (la difenili substituiti)
- planara (la alene)
- elicoidala (la proteine)
Chiralitatea centrala este generata de existenta unui atom
asimetric. Este asimetric un atom de carbon sp3 cu 4 substituenti
diferiti.
Apare activitate optica chiar daca substituentii carbonului asimetric sunt foarte putin diferiti.

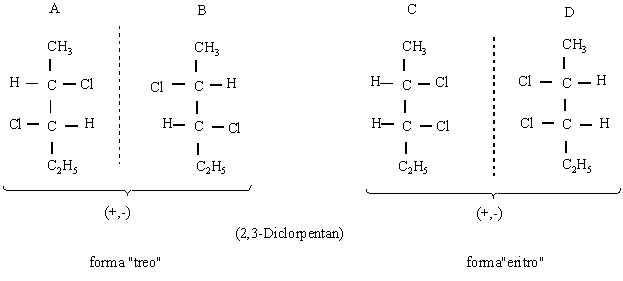
C. Molecule cu doi atomi
de carbon asimetrici. Numarul izomerilor sterici este
dat de relatia 2n (n-numarul de atomi de carbon chirali).
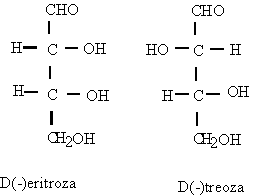
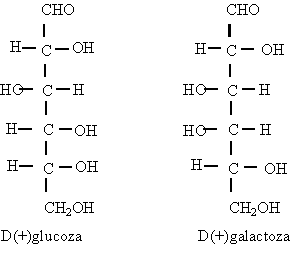
Notiunea de ²treo² si ²eritro² provine de la eritroza si treoza si se utilizeaza la nomenclatura
stereochimica a moleculelor cu doi atomi de carbon chirali.
A-B; C-D - enantiomeri.
A-C; A-D; B-C; B-D - diastereoizomeri (izomeri de distanta). Distantele intre atomii nelegati direct sunt diferite si au cel putin un atom de C chiral in aceeasi configuratie (sunt superpozabili).
Epimerii sunt diastereoizomeri care difera intre ei doar prin configuratia unui carbon chiral.
Relatia 2n nu se aplica in cazul moleculelor in care apare un element de simetrie, plan de simetrie sau axa de simetrie de tip Cn, in care n este valoarea la care se imparte 360 obtinandu-se unghiului in jurul caruia rotind molecula obtinem identitate.
Diasteroizomeri. Izomeri de distanta
A.Caracteristici
-sunt molecule cu geometrii diferite (distantele dintre atomii nelegati direct sunt diferite);
-nu sunt in relatii de nesuperpozabilitate;
-au proprietati fizice si chimice diferite.
B.Clasificare:
Diastereoizomerii:-molecule cu mai multi atomi de C chirali;
-izomeri geometrici;
-conformeri;
C.Izomeri geometrici:
a)Cauza aparitiei :blocarea rotirii atomilor de C datorita prezentei unui element structural rigid (planul dublei legaturi sau planul unui ciclu).
b)Conditia aparitiei:
Substituentii atomilor de C trebuie sa fie diferiti:
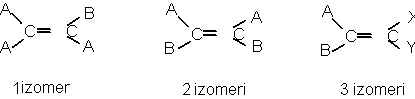
Numarul diastereoizomerilor este dat de relatia 2n, in care n este numarul elementelor structurale rigide.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4296
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved