| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Sisteme tampon
Cu toate ca apa pura este o sursa de protoni (H+) si teoretic ar trebui sa aiba implicatii de tamponare a sistemelor biologice care sunt sensibile la modificarea pH-ului, acest fenomen nu poate avea loc datorita ionizarii foarte mici a acesteia. De fapt apa are o comportare atat de acid cat si de baza, avand astfel un comportament amfoter.
![]()
Totusi, citoplasmele si fluidele celulare ale organismelor vii tamponeaza sistemele in jurul unei valori ale pH -ului de 7-8.
Solutiile tampon se definesc drept solutii ale electrolitilor slabi care tind sa reziste sa-si modifice pH-ul la adaugarea de cantitati mici de baze sau acizi. Aceasta proprietate se bazeaza pe reglarea echilibrului, conform principiului lui Le Chatelier, in jurul valorii pKa.
Principiul lui Le Chatelier arata ca daca se intervine asupra unui sistem aflat la echilibru, acesta va raspunde prin modificarea echilibrului in vederea contrabalansarii efectului exercitat asupra lui.
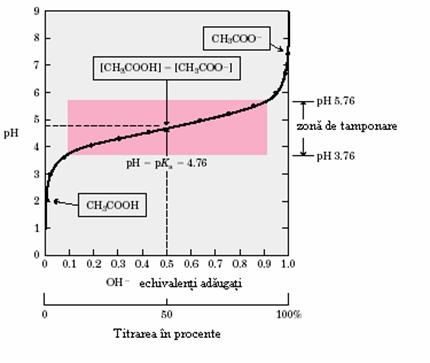
Figura 2.6. Curba de titrarea a acidului acetic
Spre exemplificare sa consideram exemplul acidului acetic (acidul slab - donor de protoni) si al ionului acetat (baza conjugata - acceptor de protoni). Observand curba de titrare (figura 2.6.), la punctul de echivalenta, concentratia acidului acetic va fi egala cu cea a ionului acetat.
Curba de titrare a acidului acetic are in jurul acestei valori o regiune destul de lina a variatiei pH-ului, pana la valori de plus sau minus o unitate de pH fata de punctul de echivalenta de 4,76. In aceasta zona a titrarii o cantitate de H+ sau HO adaugata sistemului va avea un efect mult mai slab asupra pH-ului fata de aceiasi cantitate adaugata in afara acestei zone. pH acestui punct reprezinta de fapt pKa acidului respectiv. Modul de actiune al sistemului tampon acid acetic - acetat este reprezentat in figura 2.7.
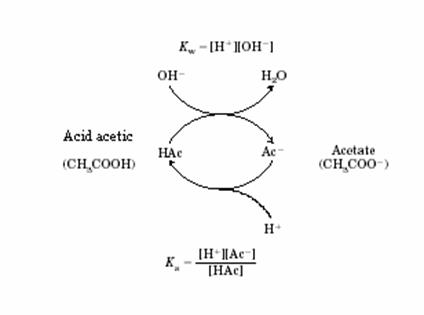
Figura 2.7. Modul de actiune a sistemului tampon acid-acetic - acetat
1. Sisteme tampon in sistemele biochimice
Sistemele tampon joaca un rol deosebit de important in sistemele biochimice. Importanta lor deriva din faptul ca lichidele extracelulare din organismele multicelulare au caracteristica o anumita valoare pH, aproape constanta. Aceste sisteme tampon sunt primele care intervin in mecanismele de aparare impotriva modificarii pH-ului intern.
In compozitia citoplasmatica a majoritatii celulelor se gasesc proteine, de fapt poliaminoacizi cu numeroase grupari functionale cu comportament de acizi slabi, respectiv baze slabe. In afara de acestia, atat adenozin-trifosfatul (ATP) cat si alti metaboliti mai mici contin, de asemenea, grupari ionizabile capabile de a manifesta efecte de sisteme tampon. Exemplele nu se opresc insa aici, ele fiind mult mai numeroase in biochimia sistemelor vii.
Pentru mentinerea constanta a pH-ului intracelular actioneaza doua sisteme tampon: sistemul fosfat si sistemul histidinic, in timp ce pH-ul intercelular este controlat la tesuturile animale prin interventia sistemului bicarbonat-acid carbonic.
Sistemul fosfat
Sistemul fosfat serveste la tamponarea lichidului intracelular deoarece in etapa a doua de ionizare valoarea constantei este aproape de cea pH-ului fiziologic.
![]()
Avand pKa2 de 6,86, domeniul lui de tamponare se intinde pe plaja 5,9-7,9 in timp ce pH-ul lichidelor intracelulare din mamifere au pH-ul cuprins intre 6.9 si 7,4.
Ionul fosfat este mult intalnit in celule, atat in forma sa anorganica dar si in grupari functionale grefate pe diferite biomolecule care servesc ca metaboliti sau precursori macromoleculari.
Sistemul acid carbonic / bicarbonat
Plasma sanguina este tamponata partial de sistemul acid carbonic / bicarbonat, in care acidul carbonic joaca rolul furnizorului de protoni iar ionul bicarbonat de cel al acceptorului de protoni
![]()
Acest sistem tampon este mult mai complex decat pare perechea conjugata acid - baza prezentata anterior. Aceasta se datoreaza faptului ca acidul carbonic se formeaza prin solubilizarea in apa a unui gaz, CO2 printr-o reactie reversibila. In cazul animalelor care poseda plamani, sistemul acid carbonic / bicarbonat este un sistem tampon fiziologic efectiv aproape de pH 7,4 deoarece acidul carbonic aflat in plasma sanguina este in echilibru cu o mare cantitate de CO2(gazos) din aerul existent in plamani. Sistemul de tamponare implica trei echilibre intre CO2(gazos) din plamani si ionul bicarbonat din sange, reprezentate in figura 2.8.
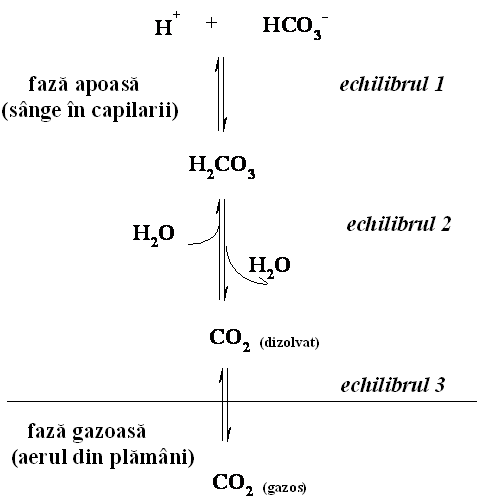
Figura 2.8. Echilibrul dintre bioxidul de carbon din aerul din plamani si sistemul de tamponare acid carbonic - bicarbonate din sangele capilar.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 6330
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved