| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Teoria multipletilor
Principiul corespondentei geometrice
O conditie necesara a reactiei catalitice este corespondenta parametrilor geometrici ai moleculelor (a fragmentelor moleculare) ce sufera transformarea, cu parametrii geometrici ai centrilor de adsorbtie, ce constituie centrul activ multiplet. Acest principiu permite interpretarea selectivitatii catalizatorilor. Rezulta ca realizarea principiului corespondentei geometrice nu presupune participarea moleculelor reactante in totalitatea lor, ci numai a atomilor intre care are loc redistribuirea legaturilor si care realizeaza un contact direct cu suprafata. Totalitatea acestor atomi poarta numele de grupare index.
Principiul corespondentei energetice
Teoria admite faptul ca legaturile chimice nu se rup, ci doar se deformeaza. Astfel, energia de activare are valori mai mici.
Un rol important in dezvoltarea conceptelor moderne asupra catalizei eterogene, si anume asupra teoriei multipletilor a fost facuta de catre Balandin in 1929. Conform acestei teorii a multipletilor, care se bazeaza in mare parte pe factorul geometric, cataliza nu se realizeaza pe toata suprafata disponibila a catalizatorului, cu numai pe anumite portiuni denumite centrii activi. O confirmare a teoriei centrilor activi a fost facuta experimental de catre Oblad, care a aratat ca pentru catalizatori de tip alumino-silice numai aprox.4% din suprafata este activa. Desi experimental toate cazurile, teoria centrilor activi a fost preluata de toate conceptele aparute ulterior asupra catalizei de contact.
Premisele acestei teorii sunt:
Ø centrii de adsorbtie si centrii activi catalitic sunt nenechivalenti;
Ø molecula reactantului se adsoarbe pe cativa centrii de adsorbtie prin cateva
portiuni ale sale, fapt care cere drept consecinta, slabirea si redistribuirea legaturilor;
Ø centrul activ catalitic consta dintr-un numar determinat de centrii de adsorbtie
(multiplet), dispusi in corespondenta geometrica cu atomii din molecule ce sufera transformarea catalitica.
Adsorbtia moleculelor ce sufera transformarea catalitica pe centrii activi catalitic conduce la formarea complexului multiplet, care se formeaza in urma unui proces endoterm.
Conform acestei conceptii, centrii activi sunt grupe de atomi multipleti situati intr-o ordine geometrica bine definita functie de natura retelei cristaline a catalizatorului. Intr-o reactie chimica la reactie nu participa intreaga molecula ci numai o parte din atomi denumit grupul index. Acesta trebuie sa realizeze contactul cu suprafata catalizatorului. Dimensiunile reale ale catalizatorului fac imposibila realizarea constactului prin legaturi covalente ale moleculelor de reactant si un singur atom al suprafetei catalitice. La realizarea contactului trebuie sa participe mai multi atomi ai catalizatorului, atomi ce formeaza grupul multiplet.
Astfel, reactia chimica poate avea loc numai daca exista o corespondenta geometrica intre asezarea atomilor si distantele interatomice in grupul index si asezarea atomilor si distantele interatomice in multiplet. Suprapunerea atomilor din grupul index peste atomii din multiplet formeaza complexul multipletin care legaturilse de valenta din grupul index sunt slabite, ceea ce conduce la micsorarea barierei energetice pentru reactia chimica. Valentele slabite ale complexului multiplet se rearanjeaza formandu-se produsi de reactie.
De exemplu, pentru o reactie in care grupul index contine patru atomi se pot forma doua legaturi chimice.

Consecinte ale teoriei multipletilor
Substituentii ce nu fac parte din grupul index nu se schimba in urma
reactiei si nu este influentat cursul reactiei.
De exemplu, dehidrogenarea alcoolilor pe Cu decurge cu o viteza de acelasi ordin de marime indiferent de lungimea catenei.
Cataliza este selectiva
Centrii de activitate maxima nu coincid cu centrii de capacitate
maxima deoarece pe suprafata catalitica sunt si atomi ce nu sunt grupati in multiplet, sunt asezati dezorientat, si care pot adsorbi molecula de reactant. Deci, exista o diferenta intre capacitatea de adsorbtie si activitatea catalitica.
Modificarea distantelor interatomice in reateaua cristalina cu ajutorul
promotorilor poate conduce la o corespondenta geometrica mai buna intre multiplet si index.
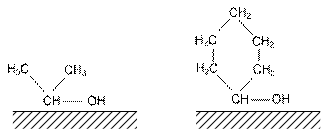
Exemplul clasic de reactii al caror mecanism poate fi explicat cu ajutorul teoriei multipletilor este dehidrogenarea si deshidratarea alcoolilor. Reactiile au loc simultan, preponderenta uneia dintre ele depinzand de natura catalizatorilor.
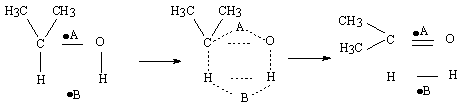
La deshidratare grupul index este: CH-C-O
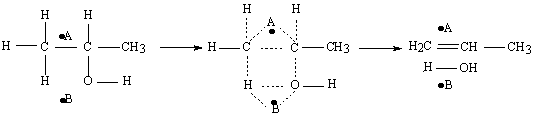
La dehidrogenare grupul index este: CH-O-H
Alte reactii au loc pe multiplet dublet.
Deshidratare
Dehidrogenare
|
C-C |
1,54 Å |
in grupul index pentru deshidratare |
|
C-O |
1,43 Å |
|
C-O |
1,43 Å |
in grupul index pentru dehidrogenare |
|
O-H |
1,01 Å |
Deoarece distantele C-C si C-O in grupul index pentru dehidrogenare sunt mai mari, este de asteptat ca acest lucru sa se reflecte in vitezele relative ale reactiilor pe catalizatori diferiti ca distante interatomice. Acest lucru s-a verificat experimental pentru reactii ale alcoolului butilic pe catalizator MgO preparat cu diferite valori ale constantei retelei, prin promotare cu CaO.
Un alt experiment este dehidrogenarea ciclohexanului la benzen. Activitate catalitica pentru aceata reactie nu pot avea decat retelele cristaline la care dispunerea atomilor formeaza sextet cu distante interatomice cu limite bine determinate.
In dezvoltarea acestei teorii, studiindu-se diverse sisteme catalitice s-a constatat ca exista sisteme similare din punct de vedere ale caracteristicilor geometrice, dar care favorizeaza reactii diferite pentru acelasi reactant sugerand corespondente cu grupari index diferite. Astfel, ThO2 si CaCl2 au caracteristici geometrice similare, dar ThO2 catalizeaza deshidratarea, in timp ce CaCl2 favorizeaza dehidrogenarea. Desi se respecta concordanta geometrica, comportarea diferita se datoreaza lipsei corespondentei energetice.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1229
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved