| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Transformarile chimice
Reactiile chimice transforma substantele in alte substante cu compozitie, structura, proprietati fizice si chimice diferite de cele ale substantelor initiale.

 Reactiile chimice sunt de diferite tipuri:
Reactiile chimice sunt de diferite tipuri:
- reactii de combinare a doua substante sau mai multe substante (reactivi) din care rezulta o noua substanta (produs de reactie):
A + B = A B
- reactii de descompunere a unei substante in doua saumai multe substante noi:
AB = A + B
- reactii de substitutie prin care un element inlocuieste un alt element din alt compus chimic:
A B + C → A C + B
- reactii de dublu schimb in care elementele unui compus binar inlocuiesc cate un alt element din celalat compus binar, rezultand doi noi compusi chimici:
A B + C D → A C + B D
|
Criteriul de clasificare |
Exemple |
|
Fenomene vizuale |
Reactii de precipitare, reactii cu degajare de gaze, reactii de culoare |
|
Mecanism de transformare bruta: - reactii elementare - reactii compuse |
Disociere, asociere, eliminare, aditie, substitutie. |
|
Dupa natura substantelor |
Oxidare si reducere, reactii cu schimb de protoni, hidratare, clorurare, nitrare, etc. |
|
Sub aspect energetic |
Reactii exoterme, reactii endoterme. |
Reactia de precipitare
Reprezinta ordonarea ionilor liber deplasabili din solutia unei sari greu solubile, in cristale care se depun ca precipitat (produsul concentratiilor ionilor din solutie este mai mare decat produsul de solubilitate al sarii).
![]()
![]()
Prin precipitare se urmareste trecerea ionilor din solutie in combinatii greu solubile, numite precipitate.
Un precipitat este potrivit pentru analiza cantitativa daca:
Solubilitatea lui este neglijabil de mica;
Structura precipitatului permite o usoara filtrare si spalare;
Compozitia sa corespunde formulei sale chimice (daca se cantareste ca atare) sau poate fi transformat usor si complet in forma de dozare;
Nu este impurificat cu ioni straini.
Compozitia chimica a materiei
In natura, elementele chimice se gasesc fie sub forma de substante libere simple (hidrogenul, clorul, oxigenul, sodiul), fie sub forma de substante compuse (carbonati, azotati, sulfati, apa).
In scoarta pamantului (litosfera), invelisul apos (hidrosfera) si invelisul gazos al pamantului (atmosfera), elementele predominante din natura, sunt: oxigenul(50%), siliciul (25%), precum si aluminiul, fierul, calciul, sodiul, potasiul, magneziul, hidrogenul, titanul, clorul si fosforul ( cca. 25%).
Compozitia chimica a materiei vii
Ca urmare a procesului de evolutie, materia vie, vegetala si animala, are o compozitie chimica deosebit de complexa, cu forme diverse determinate de continutul de apa si de substanta uscata constituita din:
substante organice: glucide, protide, acizi nucleici, enzime, vitamine, lipide, hormoni, fitohormoni, pigmenti, lignine, taninuri, terpenoide, alcaloizi;
substante anorganice (substante minerale) clasificate in macroelemente, oligoelemente si microelemente.
Tesuturile vegetale si animale contin cca. 60 de elemente chimice, din care un numar de 12 elemente constituie 99% din materia vie, denumite macroelemente, plastice sau de constitutie, si anume: carbon, hidrogen, oxigen, azot, fosfor, sulf, clor, potasiu, sodiu, calciu, magneziu, siliciu.
Alte 20 elemente chimice reprezinta 0,27% din substanta uscata a materiei vii, reprezinta categoria de microelemente (oligoelemente), printre care: fluor, fier, zinc, cupru, mangan, cobalt, titan, bor, iod, plumb, staniu, molibden.
Elemente chimice se regasesc in cantitati extrem de mici, microelementele, reprezinta un procent de aprox. 0,074% din materia vie.
Elementele minerale din organismele vii sunt denumite bioelemente, majoritatea fiind asociate sub forma de biomolecule. Functie de tipul elementelor chimice care reactioneaza intre ele sau cu alte substante, se formeaza biomolecule anorganice sau organice, cu proprietati diferite de cele ale componentelor. In tabelul 1 este prezentat procentual, continutul principalelor biomolecule in organismele vegetale, animale si a organismului uman.
Tabelul 1. Continutul procentual al principalelor biomolecule din organismele vegetale, animale si organismul uman.
|
Clasa de compusi |
Continut (%) |
|||
|
Plante |
Animale |
Om |
||
|
A |
Biomolecule anorganice | |||
|
Apa | ||||
|
Compusi minerali | ||||
|
B |
Biomolecule organice | |||
|
Glucide | ||||
|
Lipide | ||||
|
Protide | ||||
In organismele animale si vegetale predomina patru elemente chimice, denumite elemente cuaternare: oxigen, carbon, hidrogen si azot, care reprezinta 96,2% din masa organismelor vii.
In tabelul 2 este prezentat continutul procentual al elementelor cuaternare din plante si animale:
Tabelul 2. Continutul procentual al elementelor cuaternare in plante si animale.
|
Element: |
C |
O |
H |
N |
||
|
Organism | ||||||
|
Plante | ||||||
|
Animale |
In tabelul 3 este prezentat continutul in procente a biomoleculelor in lumea vie, iar in tabelul 4, raspandirea elementelor chimice in litosfera si respectiv, in organismul uman.
Tabelul 3. Distributia bioelementelor in lumea vie.
|
Elemente |
Continut % |
|||
|
Separat |
Pe grupe | |||
|
O | ||||
|
C | ||||
|
H2 | ||||
|
N | ||||
|
Ca | ||||
|
P | ||||
|
K | ||||
|
Na | ||||
|
S | ||||
|
Mg | ||||
|
Cl | ||||
|
F,Fe,Zn,Cu,Mn.Co | ||||
|
Ti,B,I,As,Pb,Sn,Mo,V | ||||
|
Si,Br | ||||
Tabelul 4. Raspandirea elementelor chimice in litosfera si in organismul uman.
|
Scoarta terestra |
Organismul uman |
|||||
|
Element chimic |
Continut % |
Element chimic |
Continut % |
|||
|
O |
H | |||||
|
Si |
O | |||||
|
Al |
9 |
C |
9,5 |
|||
|
Fe |
4,5 |
N |
1,4 |
|||
|
Ca |
3,5 |
Ca |
0,31 |
|||
|
Na |
2,5 |
P |
0,22 |
|||
|
K |
2,5 |
Cl |
0,08 |
|||
|
Mg |
2,2 |
K |
0,06 |
|||
|
Ti |
0,46 |
S |
0,05 |
|||
|
H |
0,22 |
Na |
0,03 |
|||
|
C |
0,19 |
Mg |
0,01 |
|||
In materia vie, carbonul reprezinta 37-50% din substanta uscata. Hidrogenul este elementul cu cea mai mare raspandire ca numar de atomi; oxigenul este singurul element care patrunde in tesuturile plantelor si animalelor sub forma de molecule gazoase sau dizolvate in apa, iar azotul este prezent in procent de 73,3% in tesuturile vegetale si animale prin gruparea amino ( - NH2 ) a aminoacizilor.
Apa reprezinta un component vital al organismelor vegetale, animale si al organismului uman. Organismul unui adult contine pana la 70% apa, iar a unui copil, pana la 87% din greutatea corpului.
Compozitia chimica a alimentelor
Alimentele sunt definite ca substante sau produse, procesate, semiprocesate sau neprocesate ce pot fi ingerate de catre oameni.
Alimentele contribuie la desfasurarea metabolismului uman, fiind formate din substante organice si anorganice de provenienta si in proportii diverse, fie ca reprezinta materii prime agroalimentare, fie produse prelucrate.
Tinand cont de provenienta naturala sau de procesare, componetele alimentelor se clasifica in urmatoarele categorii:
A. substante native: componente anorganice (apa, sarurile minerale, acizi anorganici, substante minerale), componente organice (glucide, lipide, substante azotate-proteice si neproteice, acizi organici, vitamine, enzime);
B. substante incorporate-aditivi alimentari (conservanti, antioxidanti, organoleptizante, consrevanti, antioxidanti etc);
C. substante accidentale, contaminante, adaugate neintentionat, accidental in produsele alimentare sau datorita poluarii mediului (aer, apa, sol).
Substante chimice native anorganice (substante minerale) din alimente
Clasificare
Functie de cantitatea substantelor minerale aflate in produsele alimentare, acestea se clasifica in :
a) macroelemente ( g/100g produs): potasiu, sodiu, magneziu, etc.;
b) microelemente (mg/100g produs) denumite si oligoelemente: fierul, iodul, manganul, cuprul, zincul, cobaltul, bariul, molibdenul, siliciul, fluorul etc.;
c) ultramicroelemente (micrograme/100g produs): elemente cu radioactivitate naturala (radiu, toriu etc).
Functie de rolul lor in metabolismul uman, substantele chimice native anorganice din alimente (substantele minerale), sunt considerate:
a) esentiale
- macroelemente, in concentratie de peste 1% produs alimentar: calciu, clor, magneziu, fosfor, potasiu, sodiu, sulf;
- microelemente, in concentratie mai mica de 1%: crom, cobalt, cupru, fluor, iod, fier, manngan, molibden, seleniu, siliciu, zinc;
b) posibil esentiale: bariu, brom, nichel, strontiu, staniu, vanadiu;
c) substantele de contaminare, in cantitati infime: plumb, aluminiu, aur, argint, bismut, galiu.
Continutul de substante minerale din produsele alimentare
Continutul de substante minerale din produsele alimentare este determinat prin analiza chimica a continutului de cenusa, obtinuta prin calcinarea probei de analizat, si anume: a) continutul global de substante minerale al produsului din cenusa totala sau bruta; b) continutul de substante minerale native sau incorporate, din cenusa solubila in HCl 10% sau cenusa neta; c) impuritati, materii necomestibile (nisip, pietris, pamant) din cenusa insolubila in HCl 10%.
De exemplu, semintele de cereale contin substante minerale in cantitati
importante ( tabelul 5).
Tabelul 5. Continutul mediu in substantele minerale si in cenusa la unele cereale, procente substanta uscata
|
Continutul mediu in % substanta uscata | ||||||||
|
Specia | ||||||||
|
P2O5 |
SO3 |
K2O |
Na2O |
CaO |
Cl |
SiO2 |
Cenusa |
|
|
Grau | ||||||||
|
Secara | ||||||||
|
Orz | ||||||||
|
Ovaz | ||||||||
|
Porumb | ||||||||
Substantele minerale existente in legume si fructe determinate din cenusa rezultata dupa incinerare, sunt bazice ( oxizi de sodiu, potasiu, calciu, magneziu, fier), acide ( oxizi de sulf, carbon, siliciu, fosfor), sau microelemente ( cupru, zinc, mangan, aluminiu, titan, bor). In tabelul 6 sunt prezentate cateva elemente chimice din unele specii de fructe si legumel proaspte.
Tabel 6. Continutul de elemente minerale ale unor specii de fructe si legume, in mg, la 100g material proaspat.
|
Specia |
K |
Na |
Ca |
Mg |
Fe |
P |
|
|
Banane | |||||||
|
Capsuni | |||||||
|
Cirese | |||||||
|
Mere | |||||||
|
Pere | |||||||
|
Piersici | |||||||
|
Portocale | |||||||
|
Prune | |||||||
|
Struguri | |||||||
|
Ceapa | |||||||
|
Castraveti | |||||||
|
Fasole | |||||||
|
Gulii | |||||||
|
Morcovi | |||||||
|
Mazare boabe | |||||||
|
Spanac | |||||||
|
Salata | |||||||
|
Tomate | |||||||
|
Telina |
| ||||||
|
Varza alba | |||||||
In tabelul 7 este prezentat continutul total de substante minerale exprimat in procente care se observa ca variaza intre 0,3 si 2,6% .
Tabelul 7. Continutul mediu in substante minerale totale ale fructelor si legumelor, la 100g material proaspat
|
Specia |
Subst.minerale % |
Specia |
Subst.minerale % |
||||
|
Afina |
Mure | ||||||
|
Agrise |
Pere | ||||||
|
Alune |
Piersici | ||||||
|
Ananas |
Portocale | ||||||
|
Banane |
Prune | ||||||
|
Caise |
Smochine | ||||||
|
Castane |
Struguri | ||||||
|
Capsuni |
Visine | ||||||
|
Cirese |
Zmeura | ||||||
|
Coacaze negre |
Ardei | ||||||
|
Coacaze rosii |
Castraveti | ||||||
|
Grape fruit |
Cartofi | ||||||
|
Gutui |
Ceapa | ||||||
|
Lamai |
Conopida | ||||||
|
Mandarine |
Dovlecei | ||||||
|
Mere |
Fasole pastai | ||||||
|
Migdale |
Gulii | ||||||
|
Nuci |
Mazare verde | ||||||
|
Marar | |||||||
|
Morcovi radacini | |||||||
|
Patlagele vinete | |||||||
|
Patrunjel | |||||||
|
Patrunjel radacini | |||||||
|
Praz | |||||||
|
Ridichi de luna | |||||||
|
Ridichi de iarna | |||||||
|
Spanac | |||||||
|
Sparanghel | |||||||
|
Salata | |||||||
|
Tomate | |||||||
|
Usturoi | |||||||
|
Telina radacini | |||||||
|
Varza alba | |||||||
|
Varza rosie | |||||||
|
Varza Bruxelles | |||||||
Continutul de apa din alimente
Continutul de apa din alimente determina calitatea alimentelor si de asemenea, influenteaza proprietatile si stabilitatea acestora.
Apa din alimente se gaseste sub doua forme: apa libera si apa legata.
Apa libera exista in organismele vii, sub forma de solutii ale substantelor solubile din sucul celular sau intercelular, in micro- si macrocapilare. In plus, datorita higroscopicitatii componentelor hidrofile, alimentele contin apa higroscopica. Apa libera poate fi indepartata usor din produsele alimenzare prin stoarcere, uscare, fara modificarea majora a celorlalti componenti ai alimentelor.
Apa legata poate fi fixata in produsele alimentare, prin legaturi fizice in microcapilare si prin legaturi fizico- chimice in macromolecule, datorita gruparilor organice functionale hidrofile: hidroxilice, -OH, carboxilice, -COOH, aminice -NH2 , amidice -CONH2 , formand solutii coloidale. Eliminarea apei legate din alimente se face greu, dar daca se indeparteaza in cantitati mari, au loc un procese ireversibile, cum sunt: pierderea capacitatii alimentelor de rehidratare, denaturarea proteinelor,degradarea solutiilor solutiilor coloidale,etc.
Alimentele proaspete au valori diferite ale continutului de apa, si anume :
- carne 55- 74% ( carne de vita 60-75%, carne de porc 50- 73%, carne de pui 67-72%)
- peste 62-845
- lapte 87-91%
- legume proaspete 65-95% (salata - 94,3%, ridichi - 93,3%, cartofi - 75,9%, castraveti - 95,36%)
- zahar 0,15-0,40%
- paine coapta 22-48%
- fructe proaspete 79-90% (pepeni - 88,89%, mere - 84,85, struguri - 79%)
- cereale boabe 12-15% (seminte de grau - 13,4%, porumb - 13,3%, floarea soarelui - 8,58%)
- amidon 13-20%
Intre moleculele de apa din mediu inconjurator si moleculele de apa din alimente exista un schimb permanent pana se atinge un echilibru (umiditatea relativa de echilibru) valoare caracteristica fiecarui tip de produs.
Valenta. Numarul de oxidare
Valenta este un numar intreg si caracterizeaza capacitatea de combinare a unui atom cu un alt atom.
Elementele ai caror atomi au mai putin de 4 electroni pe ultimul strat au valenta egala cu numar de electroni de pe ultimul strat. De exemplu elementele din grupa 1 principala au valenta, 1, cele din grupa 2 au valenta 2, iar cele din grupa 3 au valenta 3.
Elementele ai caror atomi au mai mult de 4 electroni pe ultimul strat au valenta egala cu 8 - numarul grupei, exprimat in cifre romane: de exemplu oxigenul este in grupa a VI-a principala (grupa 16) si are valenta 8-6 = 2.
Atunci cand atomii cedeaza sau accepta electroni si se transforma in ioni pozitivi si respectiv negativi ei sunt caracterizati prin electrovalenta.
Cand atomii pun in comun electroni ei sunt caracterizati prin covalenta. Covalenta este numarul de electroni pe care un atom ii pune in comun cu un alt atom.
Toate aceste notiuni de electrovalenta si covalenta au fost reunite in notiunea de numar de oxidare sau stare de oxidare. Numarul de oxidare este o masura a numarului de electroni pe care un atom ii poate ceda, accepta sau pune in comun pentru a se lega cu alti atomi identici sau diferiti.
Oxizi
Clasificare
Oxizii sunt combinatiile oxigenului cu un alt element chimic cu formula generala a oxizilor este X2O, in cazul uniu elementul chimic monovalent.
Exemple de oxizi: oxid de sodiu, NaO, oxid de calciu, CaO, oxid de magneziu, MgO, oxid feros, FeO, oxid feric, Fe2O3, oxid de carbon, CO, dioxid de carbon, CO2, dioxid de sulf, SO2, monoxid de azot, NO, dioxid de azot, NO2, trioxid de azot, N2O3, pentoxid de azot, N2O5.
Peroxizii sunt combinatii care contin in molecule gruparea - O - O - numita peroxidica, caracteristica apei oxigenate (H2O2).
Functie de comportarea oxizilor cu apa, oxizii sunt clasificati in oxizi acizi (anhidride acide), oxizi bazici (anhidride bazice) si oxizi amfoteri.
Proprietati generale
Oxizii acizi reactioneaza cu apa, formand un acid, conform unor reactiei generale, cum sunt:
X2O + H2O = HXO
X O2 + H2O = H2XO3
Exemple:
- reactia cu apa a monoxidului de clor gazos trecut peste oxid mercuric, la 4C
Cl2O + H2O = 2HClO
Monoxid apa acid hipocloros
de clor(gaz) (lichid) (solutie)
- reactia dioxidului de sulf cu apa
SO2 + H2O = H2SO3
Oxizii bazici reactioneaza cu apa, formand o baza:
M O + H2O = M(OH)2
Exemplu:
CaO + H2O = Ca(OH)2
Oxid de hidroxid de calciu
calciu
Oxizii amfoteri formeaza cu apa acizi sau baze, in functie de conditii;
Exemplu: formarea hidroxidului de aluminiu prin reactia cu apa a oxidului de aluminiu care poate disocia atat ca o baza, cat si ca un acid:
Al2O3 + H2O = Al(OH)3 care poate disocia ca o baza → Al3+ + 3OH-
sau H3AlO3 care poate disocia ca un acid → 3H+ + AlO33-
Exista oxizi care nu sunt anhidride nici de baze si nici de acizi, denumiti oxizi indiferenti, cum sunt: oxidul de carbon, monoxidul de azot.
Acizi
Acizii sunt substante care contin in molecula lor ioni de hidrogen, care in solutie apoasa disociaza astfel:
acizii tari:
HX → H+ + X-
unde HX poate fi de exemplu: acid clorhidric, HCl, acid sulfuric, H2SO4 in prima treapta de ionizare, acid percloric, HClO4.
acizii slabi
HX + H2O → H 3O+ + X-
In solutie, molecula de acid disociaza in ion de hidroniu (H3O+) si ion radicalul acid, X-:
HX + H2O → H 3O+ + X-
unde HX poate fi de exemplu: acid fosforic, H3PO4 , acid sulfhidric, H2S, etc.
Clasificare
a) Functie de compozitia moleculara, acizii sunt clasificati in:
- hidracizi( HX ), compusi binari, in molecula carora ionul de hidrogen este legat direct de elementul central, nemetalul fiind notat cu X (de ex.: HCl, H2S) ;
- oxoacizii ( H - O - X ) , compusi multiatomici in molecula carora protonul este legat de atomul de oxigen care este legat si de atomul central, nemetalul X, ( de exemplu: H2CO3, H2SO4, HNO3, H3PO4, H3AsO4).
b) Functie de numarul de protoni (H+) din molecule, pe care ii poate pune in libertate in solutie sau care pot fi inlocuiti de cationi, acizii se clasifica in:
acizi monobazici:
HCl → H + + Cl-
HCl + Na+ → H + + NaCl
- acizi bibazici:
H2SO4 + H2O → H3O+ + HSO4-
HSO4- + H2O → H3O+ + SO4 2-
- acizi tribazici:
H3PO4 + H2O → H3O+ + H2PO4-
H2PO4- + H2O → H3O+ + HPO42-
HPO42- + H2O → H3O+ + PO4 3-
Molecula de acid disociaza punand in libertate a unui proton sau a mai multor protoni si radicalul acid, format din elementul central sau gruparea formata din atomii elementului central si cei ai oxigenului ( de exmplu: Cl-, SO4 2-, CO3 2- , NO3-, PO4 3-).
Radicalul acid se comporta ca o grupare stabila si participa in aceeasi compozitie si structura in reactii chimice:
De exemplu: H2SO4 + 2NaOH = Na2SO4 + 2H2O
Proprietati generale
Acizii sunt caracterizati prin:
- reactia cu bazele, cu formare de saruri si apa:
HX + M OH = M X + H2O
acid baza sare apa
HCl + KOH = KCl + H2O
- reactia cu oxizi bazici, cu formare de saruri si apa:
2HX + M O = M X2 + H2O
acid oxid sare apa
2HCl + CuO = CuCl2 + H2O
- reactia cu metale, cu formare de saruri si degajare de hidrogen:
2HX + M = M X2 + H2 ↑
acid metal sare hidrogen
2HCl + Zn = ZnCl2 + H2 ↑
- ionizarea in solutie:
Cu cat concentratia de ioni din solutie la o dilutie data, este mai mare, acidul este mai puternic disociat, fiind considerat un acid tare. Acizii tari sunt complet disociati in ionul de hidroniu si radicalul acid, pe cand acizii slabi sunt caracterizati de prin constanta de echilibru:
HX + H2O → X- + H3O+
K = [ X- ] ∙ [ H3O+ ] / [HX ] ∙ [H2O ]
Valoarea concentratiei de apa fiind constanta intr-o solutie diluata, constanta de echilibru devine constanta de aciditate, Ka denumita si constanta de ionizare:
Ka = [ X- ] ∙ [ H3O+ ] / [HX ]
In cazul acizilor polibazici, fiecare etapa de ionizare succesiva in care se desprinde cate un proton si ionul radicalului acid corespunzator, are cate o constanta de ionizare (acidul sulfuric, H2SO4 are doua constante de ionizare , H3PO4 are trei constante de ionizare).
Baze
Conform teoriei disociatiei electrolitice, bazele sunt compusi chimici care au in molecula ioni de hidroxid, OH- (gruparea hidroxil, OH), si care in solutie, disociaza astfel:
MOH → M + + OH-
In molecula hidroxidului, gruparea hidroxil este legata de atomul metalic prin atomul de oxigen: M - O - H, caz in care metalul este monovalent.
Clasificare
a) Functie de solubilitatea bazelor in apa, se clasifica in:
- baze solubile: hidroxizii metalelor alcaline (LiOH, NaOH, KOH, RbOH, CsOH) denumiti alcalii; hidroxizii metalelor alcalino-pamantoase sunt mai putin solubili in apa ( BeOH)2, Mg(OH)2,Ca(OH)2, Sr(OH)2, Ba(OH)2.
- baze insolubile: hidroxizii de cupru, fie, aluminiu.
a) Functie de gradul de disociere in solutie apoasa, deci de concentratia ionilor de hidroxid in solutie, la o concentratie data, se clasifica in:
- baze tari
- baze slabe
Proprietati generale
Bazele alcaline sunt caracterizare prin:
- reactia cu acizii, cu formare de saruri si apa:
MOH + HX = MX + H2O
NaOH + HCl = NaCl + H2O
- reactia cu un oxid acid, cu formare de acid si apa:
2MOH + XO2 = M2XO3 + H2O
2NaOH + CO2 = Na2CO3 + H2O
- reactia cu o sare ( reactie de dublu schimb), cu formare de o alta baza si o alta sare:
MOH + NX = NOH + MX
2KOH + MnCl2 = 2KCl + Mn(OH)2
- reactia cu un metal, cu formare de sare si degajare de hidrogen
2MOH +2 N + 6H2O = 2 M [ N (OH)4 ] + 3H2
2NaOH + 2Al + 6H2O = 2Na [ Al (OH)4 ] + 3H2
Saruri
Prin reactia dintre un acid si o baza rezulta, pe langa apa, o substanta denumita sare, MX, formata din cationul bazei ( ionul de metal, M)) si anionul acidului ( radicalul acid, X):
De exemplu, reactia:
NaOH + HCl = NaCl + H2O
baza acid sare
Clasificare
Functie de comportamentul in reactiile chimice la care participa, sarurile se clasifica in saruri acide, bazice si neutre.
Sarurile acide provin din acizi care contin in molecula lor doi atomi de hidrogen ( acizi bibazici sau biprotonici) si respectiv, trei atomi de hidrogen (acizi tribazici sau triprotonici), prin inlocuirea unui singur atom de hidrogen si respectiv, a doi atomi de hidrogen, si anume.
- saruri primare sau biacide
ex.: carbonatul acid de sodiu, NaHCO3 care provine de la acidul carbonic, H2CO3 , sulfatul acid de potasiu, KHSO4 care provine de la acidul sulfuric, H2 SO4 ;
- saruri secundare sau monoacide
ex.: fosfat acid de sodiu, Na2HPO4 care provine de la acidul fosforic, H3PO4, arsenat acid de sodiu, Na2HAsO4 care provine de la acidul arsenic, H3AsO4.
Sarurile bazice
Moleculele sarurilor bazice contin una sau mai multe grupari de hidroxid (OH) de la baza din care provine sarea respectiva. Astfel, exista saruri monobazice si saruri bibazice a caror molecule contin o grupare OH si respectiv, doua grupari OH; de exemplu: BiOH(NO)3 , Bi(OH)2NO3 care provin de la Bi(NO)3 .
Sarurile neutre
Prin reactia dintre cantitati echivalente de acid si respectiv, baza, rezulta o substanta a carei molecula contine ionul metalului din molecula bazei si anionul acidului (radicalul acid), denumita sare.
H2SO4 + NaOH = Na2 SO4 + H2O
acid baza sare
Sarurile care contin in molecula doi cationi de metale diferite, sarurile se numesc saruri duble, ca de exemplu: sulfatul dublu de potasiu si aluminiu., KAl(SO4)2.
Proprietati generale
Majoritatea sarurilor sunt substante solide, majoritatea fiind substante cristaline de diferite solubilitati. In solutii, sarurile disociaza in cationi metalici (M) si anioni (radicali acizi, X):
MX → M+ + X-
Sarurile au urmatoarele proprietati generale:
- reactia cu metale:
CuCl2 + Zn = Cu + ZnCl2
Functie de potentialele standard ale metalelor, o solutie de sare poate reactiona cu un metal mai activ. Metalele mai active, care se afla inaintea hidrogenului in seria activitatii electrochimice cunoscuta ca seria Beketov- Volta
(zincul), pot inlocui din saruri, metalele mai putin active (cuprul):
Zn + Cu2+ = Cu + Zn2+
Functie de potentialele standard ale metalelor, o solutie de sare poate reactiona cu un metal mai activ. Metalele mai active care se afla inaintea hidrogenului in seria activitatii electrochimice cunoscuta ca seria Beketov-Volta, de exemplu zincul, pot inlocui din saruri, metalele mai putin active, de exemplu, cuprul.
- reactia cu hidroxizi alcalini (reactie de dublu schimb), cu formare de sare si o alta baza:
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
- reactia cu acizi (reactie de dublu schimb), cu formare de sare si un alt acid:
2NaNO3 + H2SO4 = Na2SO4 + 2HNO3
- reactia cu o alta sare:
2NaCl + CuSO4 = Na2SO4 + CuCl2
- reactia cu apa (hidroliza), cu formare de acid si o baza:
MX + H2O → HX + MOH
In cazul in care acidul sau baza din care s-a format sarea este electrolit slab, hidroliza are loc astfel:
- hidroliza unei sari care provine dintr-un acid slab si o baza tare:
X- + H2O → HX + OH-
anion acid
De exemplu, hidroliza acetatului de sodiu ( CH3COONa ) are loc astfel:
CH3COONa ![]() CH3COO- + Na+
CH3COO- + Na+
2 H2O → OH- + 3H3O+
CH3COO- + H3O+ → CH3COOH + H+ + OH- sau
CH3COO- + H2O → CH3COOH + OH-
Prin hidroliza sarurilor se formeaza cantitatile echivalente de acid slab, acid acetic (CH3COOH) care disociaza putin si hidroxid de sodiu (NaOH) complet disociat in ioni de Na+ si OH- . Reactia este bazica, deoarece in solutie se gasesc un numar mare de ioni de hidroxid.
- hidroliza unei sari care provine dintr-un acid tare si o baza slaba:
MH+ +
H2O ![]() MOH + H3O+-
MOH + H3O+-
sare baza
De exemplu, prin hidroliza azotatului de aluminiu, Al(NO3)3 se formeaza cantitatile echivalente de acid azotic, HNO3 complet disociat si hidroxidul de aluminiu, un electrolit slab partial disociat. Deci, reactia este acida:
Al(NO3)3 ![]() Al3+ + 3NO3-
Al3+ + 3NO3-
6H2O → 3OH- + 3H3O+
Al3+ + 3 OH-
![]() Al(OH)3
Al(OH)3
Al(NO3)3 + 6 H2O
![]() Al(OH)3 + 3H3O+ + 3 NO3- sau
Al(OH)3 + 3H3O+ + 3 NO3- sau
Al3+ + 6
H2O ![]() Al(OH)3 + 3H3O+
Al(OH)3 + 3H3O+
- hidroliza unei sari care provine dintr-un acid slab si o baza slaba
MH+ + X-
![]() M + HX
M + HX
solutie de sare baza acid
De exemplu, in solutia de acetat de amoniu (CH3COONH4 ) exista ionii de CH3COO- si amoniu, NH4+, sarea fiind complet disociata si ionii rezultati din ionizarea apei:
CH3COO NH4 ![]() CH3COO- + NH4+
CH3COO- + NH4+
2H2O → OH- + H3O+
In solutie, prin combinarea cationilor NH4+ si H3O+ se combina cu anionii OH- si respectiv, CH3COO- , formand hidroxidul de amoniu, NH4 OH si acidul acetic, CH3COOH.:
CH3COO- + H3O+ → CH3COOH + H2O
NH4+ + OH- → NH3 + H2O
Atat acidul acetic, cat si hidroxidul de amoniu sunt electroliti slabi., deci slabi disociati.In acest caz, datorita diferentelor foarte mici dintre gradele de disociere ale celor doi electroliti slabi, solutia are un caracter aproape neutru.
Reactia de hidroliza poate fi considerata ca reactia inversa reactiei de neutralizare:
sare + apa ![]() baza + acid
baza + acid
Apa

Una din cele mai raspandite substante din natura este apa, sub forma gazoasa (vapori), lichida (apele de suprafata, apele freatice, apele subterane, apele minerale) si solida (zapada, grindina).
Din punct de vedere chimic, apa din natura nu este pura, continand substante chimce, in special saruri in cantitati mai mici ( ape moi) sau mai mari ( ape dure). Substantele minerale greu solubile (ex. carbonatii de calciu si magneziu) se indeparteaza prin procesul de dedurizare.
Pentru indepartarea substantelor dizolvate in apa, se procedeaza la distilarea apei, adica aducerea apei in stare de vapori, urmata de condensarea acestora prin instalatii de racire. De asemenea, deionizarea apei se realizeaza prin indepartarea anionilor si cationilor care impurifica apa, uitlizand schimbatori de ioni.
Apa este indispensabila vietii organismelor vegetale si animale, activitatea vitala scazand o data cu reducerea cantitatii acesteia.
Apa potabila trebuie sa indeplineasca conditia de fi inodora, incolora, insipida, fara impuritati anorganice sau organce, fara microorganisme patogene.
Continutul impuritatilor apei potabile trebuie sa se incadreze in limittele prevazute in normele legale, si anume: reziduu uscat 500-600 mg/L, oxid de calciu 130-150 mg/L, oxid de magneziu 40-50 mg/L , clor 20-30 mg/L, acid sulfuric exprimat in mg SO3 70-80 mg/L, oxigen 2-4 mg/L, duritatea in grade 18-20.
Structura moleculei de apa
Molecula de apa nu are o structura lineara, continand un atom de oxigen central si doi atomi de hidrogen care formeaza intre ei un unghi de 1040 30', (formula chimica, H2O). La formarea celor doua legaturi covalente O − H participa doi electroni necuplati de doi orbitali px si p z ai atomului de oxigen si doi electroni ai celor doi atomi de hidrogen.
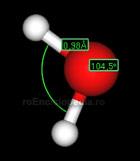
In stare lichida, moleculele de apa sunt asociate datorita legaturilor de hidrogen.
In stare solida, conform cercetarilor lui L.Pauling, un atom de oxigen este inconjurat de inca patru atomi de oxigen intr-o structura spatiala tetraedica, legati prin atomi de hidrogen pozitionati intre fiecare pereche de atomi de oxigen. Molecula de apa poate forma patru legaturi de hidrogen, atat in stare solida, cat si in stare lichida.
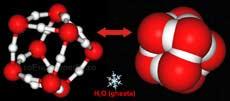
Orientarea tetraedrica a atomului de oxigen in gheata (alaturi este prezentata sub forma compacta)
Proprietati generale
Punctul de topire: 0ºC.
Punctul de fierbere: 100ºC.
Densitatea maxima: 1g / cm3.
Densitatea la 25ºC: 0,99701g / cm3.
Tensiunea de suprafata: 72.75 mJ/m2
Temperatura critica: 674K
Masa: 18.01g
Neelectrolit: apa pura nu conduce curentul electric.
Apa reactioneaza cu metale, nemetale, oxizi si unii compusi organici ( ex. metanul):
- reactia cu metalele cu punere in libertate a hidrogenului are loc in conditii diferite de temperatura, functie de potentalul electrochimic al metalelor (seria Beketov- Volta).
Astfel, sodiu si potasiu reactioneaza violent cu apa in stare lichida (reactie puternic exoterma), calciu reationeaza mai lent la temperatura obsjnuita, magneziu numai prin incalzire, aluminiu nu reactioneaza nici la fierbere, pe cand fierul reactioneaza numai in conditii speciale de temperaturi inalte.
Na + H2O = NaOH + H2 ↑
- reactia cu nemetale, de exemplu carbon are loc in conditii speciale ( la temperaturi inalte) , formand gazul de apa:
C + H2O = CO + H2 ↑
- reactia cu oxizi ai metalelor:
MgO + H2O = Mg(OH)2
- reactia cu oxizi ai nemetalelor:
SO3 + H2O = H2SO4
- reactia cu metanul, la temperaturi inalte:
CH4 + H2O = CO + 3H2
gaz de apa
Cristalohidrati
Unele substante contin in cristale, molecule de apa denumita apa de cristalizare, de exmplu: CuSO45H2O (piatra vanata), CaCl26 H2O, MgCl26 H2O, FeSO47 H2O, Na2CO310H2O(soda cristalizata), Ca(SO)42H2O (gipsul), Al2(SO4)318 H2O.Aceste substante numite cristalohidrati, au proprietati diferite de substantele de la care deriva.
Dupa modul in care se leaga molecula de apa de substanta anhidra, exista apa cationica ( prin legaturi coordinative), apa ionica ( prin legaturi de hidrogen), apa de retea (nelegata de cationi sau anioni). In cazul rasinilor schimbatoare de ioni, apa se afla in golurile retelelor cristaline fara a le modifica structura.
Cristalohidratii pot pierde apa de cristalizare fie la temperatura camerei, prin eflorescenta, precum Na2CO310H2O, fie prin fierbere precum CuSO45H2O, tranformandu-se in substantele anhidre respective.
Na2CO310H2O = Na2CO3 + 10H2O
CuSO45H2O = CuSO4 + 5H2O
Substantele care absorb vaporii de apa din atmosfera transformandu-se in cristalohidrati, se numesc higroscopice ( de exemplu MgCl2 care devine MgCl22H2O, MgCl24H2O , MgCl26H2O).
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 7240
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved