| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Fizica-Sub rezolvate
8. O stare a unui sistem fizic (termodinamic) pentru care valorile parametrilor caracteristici raman constante (in timp) este numita stare de echilibru termodinamic.
9. Un sistem termodinamic care nu schimba nici substanta si nici energie cu mediul ambiant (inconjurator) este numit sistem termodinamic izolat (inchis).
Experientele efectuate arata ca - dupa o anumita durata finita (numita timp de relaxare, τ) - orice sistem termodinamic izolat ajunge intr-o stare de echilibru termodinamic, in care ramane (pentru totdeauna). Acest rezultat - care este valabil doar pentru sistemele termodinamice uzuale (macroscopice), dar nu este valabil pentru sistemele fizice microscopice si nici pentru sistemele cosmologice - se numeste primul postulat al termodinamicii.
10. Astfel, parametrii termodinamici sunt clasificati in:
a)parametri externi (simbol ai), care depind in principal de corpurile care delimiteaza sistemul considerat (spre exemplu, de natura peretilor unei cuve cu gaz) si doar intr-o masura neglijabila de natura sistemului (sau de cantitatea de substanta a sistemului),
parametri interni (simbol Aj), daca - dimpotriva - respectivii parametri depind in principal de natura sistemului studiat sau de cantitatea de substanta a sistemului.
b) O alta clasificare importanta a parametrilor termodinamici este cea care evidentiaza:
parametrii de stare, avand valori specifice pentru fiecare stare de echilibru termodinamic,
parametrii de transformare, care nu depind numai de starile initiala si finala, ci de intreaga transformare termodinamica
11.Energia interna: suma energiilor cinetice si potentiale ale tuturor particulelor -molecule ,atomi,electroni,nuclee atomice.-care formeaza un sistem termodinamic fiind un parametru de stare.
Lucru mecanic si caldura sunt parametrii de transformare(proces) deoarece depind de natura transformarilor intre starea initiala si starea finala.
12. Pentru a defini notiunile de proces cuasistatic, respectiv de proces (transformare) nestatic(a), vom considera (drept exemplu particular) transformarile termodinamice ale unei anumite cantitati de gaz, inchisa intr-un cilindru de catre un piston mobil. Vom admite ca - la momentul initial - pistonul se gaseste in pozitia 1 (v.figura 5.1), gazul fiind intr-o stare de echilibru termodinamic. Fie Δt1 si τ12 durata miscarii pistonului din pozitia initiala 1 pana in pozitia 2 si - respectiv - durata de relaxare necesara gazului pentru a atinge starea de echilibru termodinamic corespunzand pozitiei 2 a pistonului, pornind de la pozitia initiala 1. Daca Δt1≥ τ12, tranzitia gazului de la starea de echilibru initial la starea de echilibru final poate fi considerata drept o succesiune continua de stari de echilibru (putand fi reprezentata printr-o curba in diagrama parametrilor de stare), motiv pentru care aceasta transformare termodinamica va fi numita cuasistatica. Dimpotriva, daca Δt1<τ12,, nu exista timpul necesar atingerii starilor de echilibru si transformarea 1 →2 va fi numita nestatica.
18. Expresia generala a principiilor I si II ale Termodinamicii
Pornind de la expresia cantitativa obtinuta pentru primul principiu al Termodinamicii:
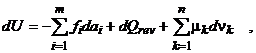
respectiv pentru cel de al doilea
principiu al Termodinamicii: ![]() (formularea lui
Clausius), aceste doua principii
pot fi sintetizate prin expresia:
(formularea lui
Clausius), aceste doua principii
pot fi sintetizate prin expresia:
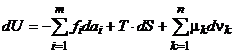 .
.
22. Pentru a defini temperatura termodinamica, trebuiesc masurate presiunile p3 si p(T) ale gazului din termometru, ajuns in echilibru termodinamic cu starea tripla a apei, respectiv in echilibru (termodinamic) cu starea termodinamica studiata. In conformitate cu definitia actuala (Giaucque) a temperaturii termodinamice, valoarea in Kelvini (K) a acestei temperaturi este:
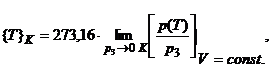 limita - pentru p3→
0 K - fiind necesara pentru a asigura ca gazul
termometric poseda proprietatile unui gaz perfect.
limita - pentru p3→
0 K - fiind necesara pentru a asigura ca gazul
termometric poseda proprietatile unui gaz perfect.
23+24. Experientele efectuate asupra sistemelor termodinamice uzuale au aratat ca "toti parametrii interni (Ai) ai unui sistem termodinamic pot fi calculati pornind de la valorile parametrilor externi (aj), de la numerele de compozitie (νk) si de la temperatura termodinamica T:
Ai=f(aj ,νk , T) . "
Ecuatia Clapeyron: fV ≡ p = νRT / V reprezinta ecuatia termica (de stare) a gazelor perfecte.
Expresia: U = i.νRT/2 reprezinta ecuatia calorica de stare a unui gaz perfect.
U-energia interna,i-nr. gradelor de libertate.
25. : 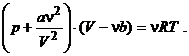 ecuatia termica de stare a unui
gaz real de tipul Van der Waals.Volumul propriu al moleculelor umol de gaz
(covolumul) este:
ecuatia termica de stare a unui
gaz real de tipul Van der Waals.Volumul propriu al moleculelor umol de gaz
(covolumul) este:
![]() Pentru a obtine o anumita estimare a valorii medii
Pentru a obtine o anumita estimare a valorii medii ![]() , vom presupune ca volumul V al vasului este impartit
intr-un numar de cuburi (de latura a) egal cu numarul N al
moleculelor gazului. :
, vom presupune ca volumul V al vasului este impartit
intr-un numar de cuburi (de latura a) egal cu numarul N al
moleculelor gazului. : ![]() .
.
Reluand consideratiile
anterioare, se gaseste ca - in acest caz - presiunea suplimentara
va fi: ![]() , deci ecuatia termica de stare a acestui
gaz real (de tipul Diterici) va fi:
, deci ecuatia termica de stare a acestui
gaz real (de tipul Diterici) va fi:
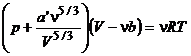 .
.
Se
poate constata ca valoarea parametrului critic pentru un gaz real Diterici
este egala cu ![]() , deci este situata in vecinatatea centrului
intervalulului valorilor experimentale (2,54,5); din acest motiv, ecuatia termica de
stare a lui Diterici este mai indicata pentru a descrie gazele reale in
vecinatatea starii critice decat ecuatia lui Van der Waals.
Determinarile experimentale arata ca - pentru cele mai multe
gaze reale - valorile parametrului critic sunt cuprinse intre 2,5 si 4,5.
Se constata astfel ca, modelul teoretic al lui Van der Waals nu
descrie foarte exact proprietatile gazelor reale in vecinatatea
punctului critic. Pentru a descrie mai exact gazele reale in vecinatatea
punctului critic, trebuie sa se tina seama ca - in
aceste conditii - gazul incepe sa se lichefieze, mai intai prin
formarea unor "fire" subtiri de lichid.
, deci este situata in vecinatatea centrului
intervalulului valorilor experimentale (2,54,5); din acest motiv, ecuatia termica de
stare a lui Diterici este mai indicata pentru a descrie gazele reale in
vecinatatea starii critice decat ecuatia lui Van der Waals.
Determinarile experimentale arata ca - pentru cele mai multe
gaze reale - valorile parametrului critic sunt cuprinse intre 2,5 si 4,5.
Se constata astfel ca, modelul teoretic al lui Van der Waals nu
descrie foarte exact proprietatile gazelor reale in vecinatatea
punctului critic. Pentru a descrie mai exact gazele reale in vecinatatea
punctului critic, trebuie sa se tina seama ca - in
aceste conditii - gazul incepe sa se lichefieze, mai intai prin
formarea unor "fire" subtiri de lichid.
26.Temperatura critica reprezinta cea mai inalta temperatura a substantei in faza lichida,volumul critic este cel mai mare volum al substantei in aceeasi faza (lichida).
27. Caldura
molara Cm si -
respectiv - caldura specifica a unei substante oarecare sunt
definite prin relatiile:![]() si
si ![]() ,unde Q este caldura primita de o cantitate
de ν (kilo)moli de substanta (avand masa m) intr-o transformare
termodinamica in cursul careia temperatura substantei
creste cu Δt grade Celsiuns
(
,unde Q este caldura primita de o cantitate
de ν (kilo)moli de substanta (avand masa m) intr-o transformare
termodinamica in cursul careia temperatura substantei
creste cu Δt grade Celsiuns
(![]() );
);
evident, caldura molara
poate fi exprimata in functie de caldura specifica prin
relatia:![]() .Pornind de la expresiile caldurilor caracteristice, se
pot deduce usor relatiile lui
Robert Mayer:
.Pornind de la expresiile caldurilor caracteristice, se
pot deduce usor relatiile lui
Robert Mayer: ![]() ,respectiv:
,respectiv: ![]() .
.
28. O
transformare termodinamica in cursul careia caldura
specifica: ![]() ramane
invariabila este numita transformare
politropa.
ramane
invariabila este numita transformare
politropa.
Ecuatiile proceselor politrope:
![]()
raportul ![]() este numit indicele transformarii politrope .
este numit indicele transformarii politrope .
Tinand
seama de ecuatia termica de stare a gazelor perfecte: ![]() , se obtine:
, se obtine:
![]()
In
final, inlocuind ![]() in prima
expresie:
in prima
expresie: ![]() a ecuatiei
transformarii politrope, se obtine o a treia expresie
(echivalenta cu precedentele) a acestei ecuatii:
a ecuatiei
transformarii politrope, se obtine o a treia expresie
(echivalenta cu precedentele) a acestei ecuatii:
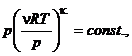 de unde:
de unde: ![]() sau:
sau: ![]()
Pentru a evidentia faptul
ca transformarile termodinamice elementare (studiate in licee) sunt
cazuri particulare (inclusiv ecuatiile lor specifice) ale
transformarii politrope (si ecuatiilor sale), vom sintetiza in
tabelul 2 (care urmeaza) valorile caldurii specifice, ale indicelui
transformarii poli-trope, precum si ecuatiile specifice
transformarilor termodinamice elementare, deduse pornind de la
ecuatiile generale: ![]() si:
si: ![]()
29. Pornind de la teorema lui
Clausius, care constata ca - pentru
gaze perfecte si transformari reversibile - avem: ![]() ,
,
unde ![]() reprezinta
diferentiala - pentru
transformari reversibile - a entropiei, Rudolf Clausius (1822-1888) a
presupus ca "pentru indiferent ce
sistem termodinamic (in faza de gaz, lichid, solid sau polifazic),
caldura diferentiala admite un factor integrant, egal cu
inversul temperaturii termodinamice
reprezinta
diferentiala - pentru
transformari reversibile - a entropiei, Rudolf Clausius (1822-1888) a
presupus ca "pentru indiferent ce
sistem termodinamic (in faza de gaz, lichid, solid sau polifazic),
caldura diferentiala admite un factor integrant, egal cu
inversul temperaturii termodinamice ![]() (al rezervorului care
furnizeaza sau primeste caldura), primitiva diferentialei
total-exacte
(al rezervorului care
furnizeaza sau primeste caldura), primitiva diferentialei
total-exacte ![]() fiind marimea de
stare - entropie termodinamica:
fiind marimea de
stare - entropie termodinamica: ![]() " (formularea lui Clausius a principiului II al
termodinamicii). Deoarece: đQ = đQrev + đQirev
, unde đQirev reprezinta variatia de energie (de
tipul unei calduri) a sistemului considerat, produsa prin
transformari ireversibile, se obtine ca:
" (formularea lui Clausius a principiului II al
termodinamicii). Deoarece: đQ = đQrev + đQirev
, unde đQirev reprezinta variatia de energie (de
tipul unei calduri) a sistemului considerat, produsa prin
transformari ireversibile, se obtine ca: ![]() , unde:
, unde: ![]() este "termenul de sursa" (entropia
generata prin transformari
ireversibile: reactii chimice
si fenomene de transport). Expresia
este "termenul de sursa" (entropia
generata prin transformari
ireversibile: reactii chimice
si fenomene de transport). Expresia ![]() reprezinta astfel
o alta formulare (a lui
Clausius), echivalenta cu precedenta, a
principiului II al termodinamicii.
reprezinta astfel
o alta formulare (a lui
Clausius), echivalenta cu precedenta, a
principiului II al termodinamicii.
Cel mai abstract enunt (posibil sa fie prezentat aici) al principiului II al termodinamicii este cel al lui Carathodory: "In orice vecinatate (indiferent cat de apropiata) a punctului reprezentativ al unei stari de echilibru termodinamic σ in spatiul parametrilor de univocitate (fig. 5.19) exista si puncte reprezentative ale unor stari de echilibru la care nu se poate ajunge (pornind din σ) prin transformari adiabatice".
30. Formularea
lui Sadi Carnot a principiului al doilea al termodinamicii afirma ca
"Randamentul maxim al motoarelor termice care functioneaza intre
temperatura maxima ![]() (a sursei "calde")
si temperatura minima
(a sursei "calde")
si temperatura minima ![]() (a sursei "reci")
corespunde motorului termic care functioneaza dupa un ciclu
Carnot, randamentul termic
(a sursei "reci")
corespunde motorului termic care functioneaza dupa un ciclu
Carnot, randamentul termic ![]() al motorului termic al
lui Carnot fiind egal cu:
al motorului termic al
lui Carnot fiind egal cu: ![]() " .
" .
In fine, ultimul (indicat aici) enunt important al principiului II al termodinamicii a fost formulat de catre William Thomson (1824-1907): "Intr-o transformare ciclica, lucrul mecanic se poate transforma integral in caldura: L→Q, in timp ce transformarea ciclica integrala a caldurii in lucru mecanic este imposibila: Q→L".
31."perpetum mobile de speta I"..Lex
"perpetuum mobile de speta a doua" (un motor termic care produce un lucru mecanic egal cu caldura primita in timpul unei transformari ciclice).
32. Pornind de la ecuatia: 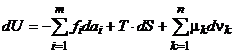 , se poate gasi diferentiala functiei
caracteristice corespunzand parametrilor de univocitate
, se poate gasi diferentiala functiei
caracteristice corespunzand parametrilor de univocitate ![]() , S si
, S si ![]() :
:
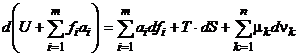 vom numi aceasta
functie caracteristica:
vom numi aceasta
functie caracteristica: 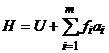 - entalpie
termodinamica. In mod
asemanator, diferentiala functiei caracteristice
corespunzand parametrilor de univocitate
- entalpie
termodinamica. In mod
asemanator, diferentiala functiei caracteristice
corespunzand parametrilor de univocitate ![]() , T si
, T si ![]() este:
este:
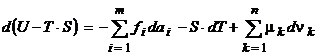 .
.
De regula, numele parametrului
de stare obtinut prin scaderea produsului T.S (temperatura
termodinamica inmultita cu entropia) este obtinut
adaugand adjectivul "libera" la denumirea precedentei marimi
fizice; spre exemplu, numele
functiei caracteristice: F = U - T.S va fi energie
(interna) libera (a lui
Helmholtz). Diferentiala
functiei caracteristice corespunzand parametrilor de univocitate ![]() , T si
, T si ![]() este:
este: 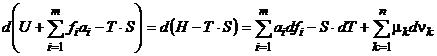 , numele respectivei functii caracteristice: G = H -
T.S fiind entalpie libera (sau functia lui Gibbs).
, numele respectivei functii caracteristice: G = H -
T.S fiind entalpie libera (sau functia lui Gibbs).
33. Dupa cum este cunoscut,
parametrii de univocitate care conduc la cea mai semnificativa expresie
(echivalenta cu principiul I al termodinamicii) a diferentialei
energiei interne sunt: parametrii
externi ![]() , entropia termodinamica si numerele de
compozitie
, entropia termodinamica si numerele de
compozitie ![]() . Deoarece se pot
asocia acestor parametri - prin relatiile:
. Deoarece se pot
asocia acestor parametri - prin relatiile: ![]() - o serie de parametri duali (de univocitate), exista
mai multe combinatii posibile de parametri de univocitate. Utilizarea unei anumite combinatii de
parametri de univocitate sau a altei combinatii poate prezenta avantaje
specifice diferitelor tipuri de fenomene termodinamice. Pentru o anumita combinatie de
parametri de univocitate, vom numi functie caracteristica -
parametrul de stare (cu dimensiunea fizica a unei energii) care are o
diferentiala (in raport cu parametrii de univocitate alesi) cu
coeficienti simpli (avand o semnificatie fizica directa) ai
diferentialelor parametrilor de univocitate.
- o serie de parametri duali (de univocitate), exista
mai multe combinatii posibile de parametri de univocitate. Utilizarea unei anumite combinatii de
parametri de univocitate sau a altei combinatii poate prezenta avantaje
specifice diferitelor tipuri de fenomene termodinamice. Pentru o anumita combinatie de
parametri de univocitate, vom numi functie caracteristica -
parametrul de stare (cu dimensiunea fizica a unei energii) care are o
diferentiala (in raport cu parametrii de univocitate alesi) cu
coeficienti simpli (avand o semnificatie fizica directa) ai
diferentialelor parametrilor de univocitate.
34. formula
lui Clapeyron-Clausius: 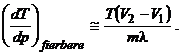
T - temperatura la care se produce tranzitia dintre fazele 1 si 2 la presiunea p, iar T+dT - temperatura tranzitiei de faza la presiunea p+dp.
λ este caldura latenta corespunzand tranzitiei de faza considerate.
35. Deoarece p2 < p1 , se poate spune ca procesul Joule-Thomson consta intr-o "depresurizare" izentalpica.
36. Se constata ca: 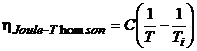 , unde C si Ti sunt constante fizice,
specifice substantei utilizate.
, unde C si Ti sunt constante fizice,
specifice substantei utilizate.
Se constata ca,
pentru: ![]() avem:
avem: ![]() deci efectul Joule-Thomson
deci efectul Joule-Thomson
permite obtinerea - in
conditiile specificate - unor
temperaturi mai joase decat cele initiale, in timp ce pentru: ![]() se gaseste
ca:
se gaseste
ca: 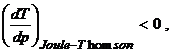 deci - in acest caz - acest proces este neinteresant din punct de
vedere tehnic. Deoarece
deci - in acest caz - acest proces este neinteresant din punct de
vedere tehnic. Deoarece ![]() reprezinta
temperatura la care se schimba semnul eficientei procesului
Joule-Thomson:
reprezinta
temperatura la care se schimba semnul eficientei procesului
Joule-Thomson: 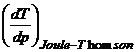 , aceasta
temperatura este numita temperatura de inversie a procesului
Joule-Thomson.
, aceasta
temperatura este numita temperatura de inversie a procesului
Joule-Thomson.
Pentru
gazele reale de tipul Van der Waals, avem (v. exercitiul 6): ![]()
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2490
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved