| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Principiul III al termodinamicii. Ecuatia lui Nerst
Teorema calorica Nernst constituie o concluzie a numeroase experimente din sisteme termodinamice la echilibru (sau in evolutie cvasistatica) si cu respectarea urmatoarelor conditii:
- participantii proceselor fizico-chimice sa fie specii chimice pure, solide, cristalizate; stabile.
- temperaturile scazute, incepand cu un domeniu variabil in functie de transformare sa coboare spre 0 K;
- presiunea sa fie mentinuta constanta.
Conform teoremei calorice Nernst, la scaderea temperaturii spre 0 K coeficientul termic al energiei Gibbs de transformare ΔrG tinde asimptotic catre zero si in acelasi timp valoarea ΔrG se apropie de efectul termic ΔrH.
Formularea matematica a teoremei calorice Nernst
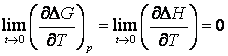
Se verifica la transformari de faza cum sunt cele polimorfe sau alotrope.
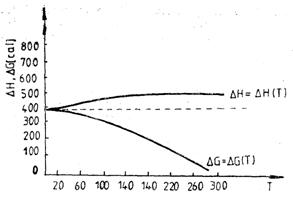
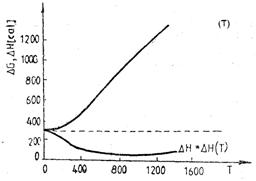
a) b)
Variatiile efectului termic ( rH) si ale energiei Gibbs de transformare ( rG) cu temperatura la trecerea staniului cenusiu in staniu alb (a) si la transformarea grafitului in diamant (b)
Interpretarea expresiei matematice a teoremei calorice Nernst
a) DH coincide ca valoare cu DG nu numai la 0 K, intrucat DG se apropie de
efectul termic DH) intr-un domeniu premergator temperaturii de K, domeniu
variabil in functie de natura procesului fizico-chimic.
![]()
![]() b) cand temperatura tinde catre 0 K, de la o anumita
temperatura:
b) cand temperatura tinde catre 0 K, de la o anumita
temperatura:
c) Din relatia generala:
![]() Tinand cont de cele mentionate anterior se
poate scrie:
Tinand cont de cele mentionate anterior se
poate scrie:
intrucat T≠0
![]() Pentru T 0 se obtine:
Pentru T 0 se obtine:
Aceasta ecuatie prevede anularea entropiei de transformare spre limita inferioara a temperaturilor si a condus la principiul III al termodinamicii.
d) In toate experimentele, tangenta la curbele DrG si DrH functie de temperatura,
in domeniul de coincidenta este paralela cu axa Ox. Nu s-au inregistrat cazuri
de abateri de la aceasta conditie de respectare a teoremei calorice Nernst.
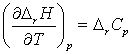 Din ecuatia
diferentiala Kirchoff:
Din ecuatia
diferentiala Kirchoff:
![]() combinata cu ecuatia
descrisa anterior:
combinata cu ecuatia
descrisa anterior:
si respectand conditiile impuse de valabilitatea teoremei calorice Nernst, rezulta:
![]()
![]()
sau
Aceasta ecuatie exprima anularea DrCP spre temperatura de 0 K si constituie una dintre formularile principiului III al termodinamicii.
![]() Ecuatia a fost extinsa de la procese
termodinamice la componentele sistemului care au fiecare aceeasi capacitate calorica egala cu zero:
Ecuatia a fost extinsa de la procese
termodinamice la componentele sistemului care au fiecare aceeasi capacitate calorica egala cu zero:
Teorema calorica Nernst conduce si la alta concluzie importanta referitoare la
variatia entropiei de transformare spre 0 K. Se utilizeaza expresia entropiei ca
derivata partiala cu semn schimbat a functiei de stare G, in raport cu temperatura
la presiune constanta:
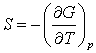
Pentru variatii stoechiometrice ale unei transformari, ecuatia de mai sus devine:
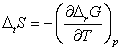
![]()
Se reia teorema calorica Nernst pentru a stabili alt enunt al principiului III:
Cand T 0, procesele fizico-chimice izoterme se desfasoara fara variatie de entropie a transformarii respective, deci entropiile reactantilor sunt compensate total de entropiile produsilor. La temperaturi care scad spre 0 K, entropia nu mai este functie de stare, tinde catre o valoare independenta de parametrii de stare.
Formularea matematica generala a teoremei Nernst sub forma unui sir de egalitati care constituie baza enunturilor principiului III este urmatoarea:
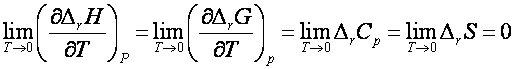
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1399
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved