| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
Úkoly:
Proměřte voltampérovou charakteristiku roztoku síranu měďnatého za podmínek, specifikovaných v postupu práce. Zjistěte hodnotu rozkladného napětí.
Provedením elektrolýzy roztoku síranu měďnatého stanovte hodnotu Faradayovy konstanty a porovnejte ji s tabelární hodnotou
Teoretická východiska:
Při pokusech s elektrolyty se zjišťuje, že při připojení zdroje malého napětí k elektrodám vznikne v obvodu velmi malý proud, který rychle zanikne. Děj se opakuje tak dlouho, dokud není na elektrodách napětí U větší než tzv. rozkladné napětí Ur elektrolytu. Potom se proud I s napětím U lineárně zvyšuje podle vztahu I=(U-Ur)/R, kde R je odpor elektrolytu. Odpor elektrolytu závisí nejen na druhu a koncentraci roztoku, ale i na velikosti a poloze elektrod a dalších činitelích. Se zvyšováním teploty klesá viskozity rozpouštědla, čímž se zmenšují síly, které brzdí pohyb iontů. Proto je při daném napětí elektrický proud větší. Výše uvedené jevy se vysvětlují tzv.polarizací, která může být různého původu a podle toho se jedná o polarizaci koncentrační a polarizaci chemickou. V našem případě se jedná o koncentrační polarizaci, jejíž vznik si vysvětlujeme na základě následující úvahy:
Předpokládejme roztok síranu měďnatého, do něhož jsou ponořeny dvě velké měděné elektrody. Přenos elektřiny zprostředkují ionty Cu2+ a SO42-. Kationty Cu2+ se pohybují směrem ke katodě, na ní odevzdávají svůj náboj a vylučují se jako kovová měď, anionty SO42- putují směrem k anodě, na ní se vybíjejí a rozpouštějí ekvivalentní množství mědi z anody. Celkově vzato vylučuje se při této elektrolyse na katodě měď a na anodě se rozpouští, přičemž chemické složení obou elektrod ani roztoku se nemění. To platí, pokud se elektrolýza provádí při velmi nízkých proudových hustotách, kdy koncentrační změny v okolí elektrod jsou malé a difuse ze vzdálenějších oblastí roztoku je stačí vyrovnávat. Při větších proudových hustotách se však koncentrace síranu měďnatého v okolí elektrod změní podstatně a difuse k vyrovnání změn nestačí. Tím se stane, že jedna měděná elektroda je ponořena do roztoku o koncentraci nižší, druhá do roztoku o koncentraci vyšší. Vzniká koncentrační článek, jehož elektromotorické napětí je namířeno proti napětí udělovanému elektrodám z vnějšího zdroje.
Kdybychom uvažovali jiné elektrolyty, např.zředěnou kyselinu sírovou, vylučovala by se z počátku na elektrodách malá množství vodíku a kyslíku, čímž vznikne galvanický článek, jehož elektromotorické napětí je stejně velké, avšak opačného směru, než vnější napětí. Proud soustavou prakticky neprochází, nastává chemická polarizace. Postupným zvyšováním napětí se konečně dosáhne stavu, že plyny se na elektrodách neudrží a začnou unikat do atmosféry. Tím bylo dosaženo rozkladného napětí daného elektrolytu za daných podmínek. Od tohoto okamžiku polarizace elektrod dále neroste a závislost proudu na napětí se řídí výše uvedeným vztahem.
Při výpočtech elektrolýzy se uplatňují Faradayovy zákony:
Hmotnost látky m, vyloučené na elektrodě při elektrolýze je přímo úměrná součinu stálého proudu I a doby t, po kterou proud elektrolytem procházel, tedy m=A.I.t, kde konstanta úměrnosti A se nazývá elektrochemický ekvivalent látky. Pro danou látku je to charakteristická konstanta s jednotkou kilogram na coulomb (kg/C), viz MFCHT. Např.pro měď je A=329mg/C. To znamená, že proudem 1A se za 1s vyloučí na katodě 329mg mědi.
Faradayův zákon: Hmotnosti různých prvků (nebo radikálů) vyloučených při elektrolýze týmž celkovým nábojem jsou chemicky ekvivalentní, tedy A=Mm/F.z, kde Mm je molekulová, resp atomová hmotnost, z je nábojové číslo iontu a F je Faradayova konstanta, má hodnotu 96493C/mol. Platí též, že F=e.NA, kde e … elementární náboj, NA je Avogadrova konstanta. Faradayovu konstantu lze určit elektrolýzou roztoku síranu měďnatého z přírůstku hmoty katody a úbytku hmoty anody. Atomová hmotnost mědi je 63,57g/mol, ve sloučenině je měď dvojmocná.
Pomůcky:
Přístroj pro elektrolýzu s elektrolytem, měděné elektrody, vysoušeč elektrod, váhy, závaží, líh, vodiče.
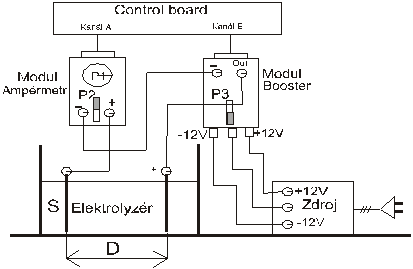
Modul ampérmetr, modul
booster, souměrný el.zdroj k modulu booster,
Popis:
P1 … přepínač rozsahu ampérmetru P2
… přepínač posuvu 0 A
P3 … přepínač rozsahu výstupního napětí S
… plocha elektrody
D … vzdálenost mezi elektrodami
Poznámka:
modul booster je nutno propojit se zdrojem přesně podle schématu , modul
booster je nutno zapojit jako zdroj pro elektrolýzu podle schéma .OUT je
kladným pólem, spojeným s anodou, modul ampérmetr je zapojen do série
s elektrodami (měří celkový proud)!!
Pracovní postup:
Po propojení modulu booster se zdrojem +12V – 0 - -12V viz schéma se spoji konektor modulu s control boardem na kanálu E, přepínač P3 se prozatím připojí na ±5V. Modul ampérmetr byl spojen s kanálem A, přepínač P2 byl nastaven na nulu dole a přepínač P1 na rozsah 1A. Následuje změření plochy elektrod, které budou později ponořeny do elektrolytu. [cca 25 cm2]. Elektrody byli očištěny smirkovým papírem, omyty v H2O a dokonale osušeny elektrickým vysoušečem. Takto zpracované elektrody byly zváženy laboratorními váhami a jejich hmotnost byla zaznamenána.
Elektrody byly uchyceny do držáku a ponořeny do připraveného elektrolytu, tak aby se dosáhlo vzájemné vzdálenosti 3 cm.Při zvýšené opatrnosti byl elektrický obvod podle obr. č. 1 uzavřen. Po kontrole učitele byl nastartován program ISES paralelně se sešitem EXCEL.
Byla nastavena konfigurace měření voltampérové charakteristiky takto: Doba měření 100s,vzorkování 100Hz start manuální, parametry výstupu E pila, počáteční hodnota 0V, koncová hodnota 5V, frekvence 0,01Hz, počet period 1.
Byla zapojena síťová šňůra do zásuvky.Měření bylo odstartováno a bylo důsledně dbáno na to, aby protékající proud byl menší než 1A. V takovém případě bylo měření ukončeno příkazem STOP z technických důvodů.
Výsledky byly uloženy a následně bylo zahájeno měření Faradayovy konstanty.Doba měření byla nastavena na 1200s, vzorkování 1 Hz, start manuální a na kanálu E(booster) ruční řízení s počáteční hodnotou 2V.
Po skončení doby měření byly elektrody opět zváženy a výsledky byly zapsány.
Výsledky měření:
měření č. 1:
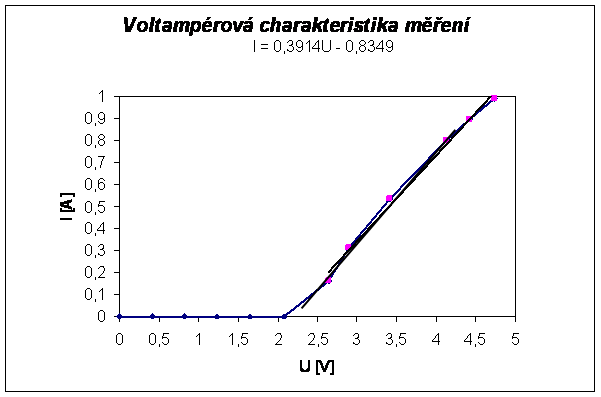
|
měření č. |
U [V] |
I [A] |
|
|
||
Rovnice regrese má hodnotu I = 0,3914U - 0,8349. Pokud za proud I dosadíme hodnotu nula dostaneme vztah 0=0,3914U-0,8349, tedy U=0,8349/0,3914 = 2,13 V. Toto napětí označujeme jako Ur a nazývá se tzv. rozkladné napětí, viz teoretická východiska. Pro kontrolu jsem proloženou přímku protáhl do osy x, aby byl předchozí výpočet dokázán i graficky.
měření č. 2:
|
Elektroda č: |
m1[g] před elektrolýzou |
m2[g] po elektrolýze |
∆m[g] |
použité vzorce:
Dm=(Dm1+Dm2)/2=(0,19+0,18)/2=0,185g
![]()
![]()
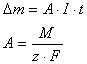
![]()
Závěr:
Během měření nevznikly žádné vážné problémy. Výsledná odchylka je způsobena krátkou dobou elektrolýzy, nepřesností měřidel, nepřesností měřeni a vnějšími chemickými vlivy.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1163
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved