| CATEGORII DOCUMENTE | ||
|
||
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
ALKOHOLE
Alkohole związki organiczne o wzorze ogólnym R-OH w których grupa hydroksylowa OH przyłączona jest bezpośrednio do łańcucha węglowego.
Alkohol nasycony alkohol, który posiada w łańcuchu węglowym tylko wiązania pojedyncze.
Alkohol nienasycony alkohol, który posiada w łańcuchu węglowym wiązania wielokrotne; szczególną grupę stanowią enole.
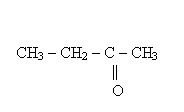
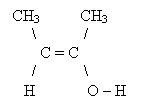
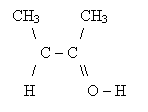
Enole związki zawierające przy atomie węgla z podwójnym wiązaniem grupę OH; są nietrwałe, szybko ulegają tautomerii do odpowiedniego aldehydu lub ketonu
![]()
![]()
![]()
![]()
Tautomeria zjawisko polegające na wzajemnym przechodzeniu jednego izomeru strukturalnego w drugi, aż do osiągnięcia stanu równowagi.
5) Alkohole jednowodorotlenowe posiadające jedną grupę -OH
- nazewnictwo
do członu oznaczającego alifatyczny łańcuch węglowy dodajemy końcówkę ol, a przed nią odpowiedni lokant; łańcuch główny numerujemy tak, aby grupa OH miała jak najniższy lokant; jeżeli grupa OH znajduje się na końcu łańcucha, a łańcuch jest nierozgałęziony, to nie podajemy lokantu, tzn. 1, przed końcówką ol; w przypadku alkoholi nienasyconych pierwszeństwo w numeracji ma grupa OH a nie wiązanie wielokrotne, tzn. grupa OH musi mieć jak najniższy lokant, np.
![]()
![]()
![]()
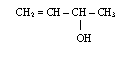
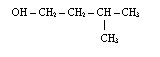
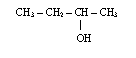
![]()
![]()
można również stosować nazwy zwyczajowe, np. alkohol metylowy dla metanolu, etylowy dla etanolu itd.
- właściwości fizyczne:
*alkohole są związkami polarnymi, ponieważ w cząsteczce związku występuje polarna grupa
OH
*atom wodoru obecny w grupie hydroksylowej powoduje, że pomiędzy cząsteczkami tych substancji powstaje wiązanie wodorowe
R
|
R O ----- ----- ------ H O
 |
|
H
wiązanie wodorowe
*wiązanie wodorowe powoduje, że substancje, w których ono występuje mają duże temperatury wrzenia pomimo małej masy cząsteczkowej; temperatura wrzenia obniża się, jeżeli w cząsteczce związku obecne są rozgałęzienia
*alkohole, które w cząsteczce posiadają małą ilość atomów węgla rozpuszczają się w wodzie bardzo dobrze; wraz ze wzrostem ilości węgli w łańcuchu związku rozpuszczalność substancji w wodzie maleje dobrze rozpuszczalne są tylko pierwsze trzy alkohole w szeregu homologicznym
*w wyniku zmieszania alkoholu z wodą następuje kontrakcja, czyli objętość mieszaniny jest mniejsza niż suma objętości składników
*wodne roztwory alkoholi nie przewodzą prądu elektrycznego
*alkohole mają odczyn obojętny
*pierwsze pięć alkoholi to ciecze, pozostałe są ciałami stałymi
metanol i etanol:
*lotne, bezbarwne ciecze o charakterystycznym zapachu i smaku, bardzo dobrze rozpuszczalne w wodzie;
*są dobrymi rozpuszczalnikami wielu substancji organicznych;
*metanol jest trujący (wchłanianie par albo wypicie kilkunastu gramów już może spowodować ślepotę lub nawet śmierć), gdyż w organizmie utlenia się do bardzo reaktywnego formaldehydu
![]()
*metanol wrze w temperaturze 65 C, a etanol w 78,5 C.
*metanol otrzymywany był dawniej w procesie suchej destylacji drewna, stąd nazywany tez jest spirytusem drzewnym; obecnie duże ilości metanolu powstają w reakcji katalitycznego uwodornienia tlenku węgla:
![]()
*etanol otrzymywany jest obecnie w wyniku fermentacji cukru:
![]()
lub też na drodze syntetycznej z etylenu w reakcji addycji wody w środowisku kwaśnym
![]()
*metanol wykorzystywany jest do produkcji formaldehydu i innych związków, jako rozpuszczalnik i ciecz zapobiegająca zamarzaniu
*etanol wchodzi w skład fermentowanych napojów (piwo, wino, wódka), stosowany jest jako rozpuszczalnik, jako miejscowy płyn antyseptyczny, wykorzystywany do produkcji eteru i estrów etylowych; handlowy etanol, zwany spirytusem, jest roztworem zawierającym 95% alkoholu i 5% wody; wody nie można usunąć w wyniku destylacji, dlatego też aby uzyskać alkohol absolutny (100%) dodaje się wapno palone (CaO), które w reakcji z wodą daje wodorotlenek wapnia
otrzymywanie alkoholi:
*w wyniku hydratacji alkenów w środowisku kwaśnym:
![]()
*w wyniku reakcji chlorowcopochodnej alkanu z mocnym wodorotlenkiem:
![]()
*w wyniku reakcji chlorowcopochodnej alkanu z wodą
![]()
*w wyniku redukcji związków karbonylowych
![]()
właściwości chemiczne:
*wodne roztwory alkoholi mają odczyn obojętny
*alkohole posiadają właściwości amfoteryczne (mogą w reakcjach zachowywać się jak słaby kwas lub słaba zasada)
*reakcje z rozerwaniem wiązania C-O (wskazujące na zasadowy charakter alkoholi)
![]()
etylen
![]()
![]() CH2=CH2 + H2O
CH2=CH2 + H2O
H+, temp
![]()
![]()
![]() CH3 CH2 OH
CH3 CH2 OH
eter dietylowy (etoksyetan)
CH3CH2OCH2CH3 + H2O
*reakcje z rozerwaniem wiązania O-H
![]()
![]()
*reakcje utleniania alkoholi
![]()
pomarańczowa barwa roztworu etanal
(aldehyd octowy) zielona barwa roztworu
![]()
purpurowa barwa roztworu brunatny osad
OH OH
K2Cr2O7 lub CrO3
|
|
![]() CH3 CH2 CH3 CH3
C CH3
CH3 CH2 CH3 CH3
C CH3
propan-2-ol purpurowa barwa roztworu
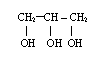
6) Alkohole wielowodorotlenowe posiadające wiele grup OH
propano-1,2,3-triol etano-1,2-diol
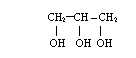
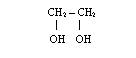 - nazewnictwo
takie same jak przy jednowodorotlenowych, tylko przed końcówką ol
występuje krotność występowania grup hydroksylowych i
wymienione są lokanty ich występowania, np.:
- nazewnictwo
takie same jak przy jednowodorotlenowych, tylko przed końcówką ol
występuje krotność występowania grup hydroksylowych i
wymienione są lokanty ich występowania, np.:
można stosować również nazwy zwyczajowe: glikol etylowy dla etno-1,2-diolu lub gliceryna (glicerol) dla propano-1,2,3-triolu
właściwości fizyczne i zastosowanie
*glikol etylowy ciecz o słodkim smaku, bezbarwna, rozpuszczalna w wodzie, trujący, o wysokiej temperaturze wrzenia (wyższej niż etanolu), stosowany do produkcji płynu borygo
*gliceryna syropowata ciecz o słodkim smaku, bezbarwna, rozpuszczalna w wodzie, jej kojące właściwości czynią ją bardzo przydatną w kosmetykach stosowanych przy goleniu, w mydłach toaletowych, a także w kroplach i syropach przeciwkaszlowych; ma właściwości higroskopijne
otrzymywanie:
*glikol otrzymujemy z
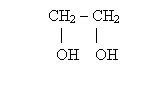
![]()
![]() CH2
CH2
![]()
![]() O + H2O
O + H2O
CH2
*gliceryna powstaje w reakcji 1,2,3 - trichloropropanu w reakcji z KOH

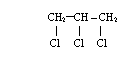
![]() 3KOH + 3KCl
3KOH + 3KCl
właściwości chemiczne:
*obecność większej ilości grup hydroksylowych zwiększa polarność alkoholi i ich reaktywność
*alkohole polihydroksylowe (wielowodorotlenowe) mają większe właściwości kwasowe, niż alkohole jednowodorotlenowe
*gliceryna reaguje z kwasem azotowym , tworząc triazotan (V) glicerolu (nitroglicerynę)
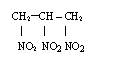
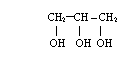
![]() 3HNO3 3H2O +
3HNO3 3H2O +
*gliceryna i glikol reagują z metalami alkalicznymi tworząc alkoholany: gliceryniany i glikolany, np.
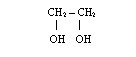
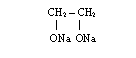
![]() + Na + H2
+ Na + H2
glikolan sodu
*gliceryna i glikol reagują z wodorotlenkami lub tlenkami metali ciężkich (np. CuO) dając alkoholany:
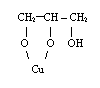
![]() + Cu(OH)2 2H2O +
+ Cu(OH)2 2H2O +
glicerynian miedzi (II)
*glikol etylenowy utlenia się do kwasu szczawiowego
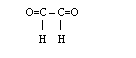

![]()
FENOLE
Fenole związki, w których grupa hydroksylowa jest bezpośrednio połączona z pierścieniem aromatycznym ArOH
Nazewnictwo
nazwy systematyczne dla fenoli tworzy się dodając przedrostek hydroksy do nazwy węglowodoru, np.
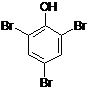
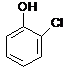
![]()
![]()
![]()
![]() Dla niektórych fenoli zachowano nazwy zwyczajowe:
Dla niektórych fenoli zachowano nazwy zwyczajowe:
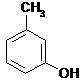
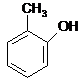
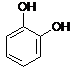
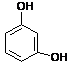
![]()
hydrochinon
![]()
![]()
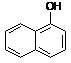
α-naftol β-naftol
Właściwości fizyczne
Fenole to przeważnie ciecze lub ciała stałe o niskich temperaturach wrzenia lub topnienia w porównaniu do alkoholi o porównywalnej masie cząsteczkowej. Słabo rozpuszczają się w wodzie. Są substancjami bezbarwnymi. Między cząsteczkami fenoli, podobnie jak w alkoholach, powstaje wiązanie wodorowe.
Fenol substancja stała, krystaliczna, o charakterystycznym zapachu, słabo rozpuszczalna w zimnej wodzie, zaś dobrze w ciepłej; działa bakteriobójczo
Otrzymywanie fenoli
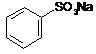 -poprzez stapianie sulfonianów z alkaliami:
-poprzez stapianie sulfonianów z alkaliami:
300 C
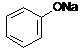
![]() + NaOH NaHSO3 +
+ NaOH NaHSO3 +
sulfonian sodu fenolan sodu
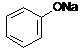
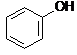
![]() + HCl NaCl +
+ HCl NaCl +
-z aromatycznych halogenopochodnych poprzez stapianie z NaOH reakcja zachodzi w bardzo drastycznych warunkach (temp 360C, ciśnienie 300 atm)
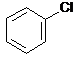
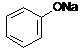
![]() + NaOH H2O HCl +
+ NaOH H2O HCl +
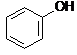
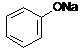
![]() + HCl NaCl +
+ HCl NaCl +
Właściwości chemiczne
-fenole wykazują bardziej kwasowe właściwości niż alkohole
-wodny roztwór fenolu wykazuje odczyn słabo kwaśny i nosi nazwę kwasu karbolowego
-fenole reagują z roztworami wodorotlenków dając sole zwane fenolanami (pod wpływem kwasów nieorganicznych fenolany przekształcają się z powrotem w odpowiednie fenole patrz otrzymywanie)
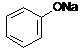
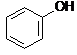
![]() + NaOH H2O +
+ NaOH H2O +
-w przeciwieństwie do alkoholi fenole reagują bezpośrednio z diazometanem z wytworzeniem eterów metylowo-arylowych (reakcja alkilowania)
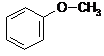
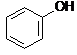
![]() CH2N2 N2 +
CH2N2 N2 +
metoksybenzen
 -reagują z chlorkami kwasowymi , a produktami są estry
(reakcja acylowania)
-reagują z chlorkami kwasowymi , a produktami są estry
(reakcja acylowania)
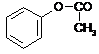
+
![]() CH3
CO Cl HCl +
CH3
CO Cl HCl +
octan fenylu
 -ulegają reakcji substytucji elektrofilowej (np. bromowania lub
nitrowania)
-ulegają reakcji substytucji elektrofilowej (np. bromowania lub
nitrowania)

![]() + Br2 + HBr
+ Br2 + HBr
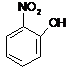
![]()
![]() + H2O
+ H2O
o-nitrofenol
![]()
![]() + HNO3(rozcieńczony)
+ HNO3(rozcieńczony)
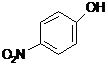
![]()
p-nitrofenol
+ H2O
- Fenol reaguje z chloroformem dając aldehyd salicylowy (substytucja)
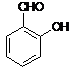
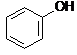
NaOH
![]() + CHCl3
+ CHCl3
redukuje się do benzenu w reakcji z płynem cynkowym
fenole dają charakterystyczne zabarwienie roztworu FeCl3, który barwi się pod wpływem fenolu na fioletowo
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5620
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved