| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Ghiduri pentru interventii coronariene percutane
Grupul de Lucru pentru Interventii Coronariene Percutane al Societatii Europene de Cardiologie
Sumar
La pacientii cu CI stabila, PCI poate fi considerata o metoda initiala valoroasa de revascularizare la toti pacientii cu ischemie importanta pentru aproape oricare subset de leziuni, cu o singura exceptie: ocluziile cronice totale, care nu pot fi trecute. In studiile timpurii, a existat un usor avantaj in supravietuire pentru bypass comparat cu PCI fara stentare. Adaugarea stenturilor si a noi medicamente adjuvante a imbunatatit evolutia post PCI. Decizia de a recomanda PCI sau bypass va fi ghidata de ameliorarile tehnice in cardiologie sau chirurgie, experienta locala si preferinta pacientului. In orice caz, pana la proba contrarie, PCI trebuie sa fie folosita cu rezerva la diabetici cu boala multivasculara si la pacientii cu boala de trunchi principal neprotejat. Folosirea stenturilor active farmacologic poate schimba aceasta situatie.
Pacientii prezentand NSTE-ACS (angor instabil sau IMA fara supradeniv. ST) trebuiesc stratificati, in primul rand, pentru riscul complicatiilor trombotice acute. Un beneficiu clar al angiografiei precoce (sub 48 h) si, la nevoie, PCI sau bypass a fost raportat doar la grupurile cu risc inalt. Amanarea interventiei nu amelioreaza evolutia. Stentarea de rutina este recomandata pe baza predictibilitatii rezultatelor si sigurantei imediate a acesteia.
La pacientii cu STEMI, PCI primara trebuie sa fie tratamentul de electie la pacientii care se prezinta intr-un spital cu facilitati de angioplastie si o echipa experimentata. Pacientii cu contraindicatie de tromboliza trebuiesc imediat transferati pentru PCI primara, deoarece aceasta poate fi singura lor sansa pentru deschiderea rapida a coronarei. In socul cardiogen PCI de urgenta pentru revascularizare completa poate fi salvatoare de viata si trebuie considerata intr-un stadiu timpuriu. Comparata cu tromboliza, trialuri randomizate care au transferat pacientii pentru PCI primara spre un "centru de atac cardiac" au observat o evolutie clinica mai buna, in ciuda timpului de transport ce a condus la o intarziere semnificativa intre randomizare si inceperea tratamentului. Superioritatea PCI primara asupra trombolizei pare a fi, in special clinic, relevanta pentru intervalul de timp intre 3 si 12 ore de la debutul durerii toracice sau altor simptome pe baza unei prezervari superioare a miocardului. Mai mult, cu cresterea timpului pana la prezentare, rata evenimentelor cardiace majore adverse dupa tromboliza creste, dar pare a ramane constanta dupa PCI. In primele 3 ore de la inceputul durerilor toracice sau altor simptome, ambele strategii de reperfuzie par a avea aceeasi eficienta in reducerea ariei infarctului si mortalitatii. In consecinta, tromboliza este inca o alternativa viabila la PCI primara, daca poate fi administrata in primele 3 ore de la debutul durerilor toracice sau altor simptome. PCI primara comparata cu tromboliza reduce semnificativ accidentul cerebral. In concluzie, preferam PCI primara fata de tromboliza in primele 3 ore de la debutul durerilor toracice pentru a preveni accidentul cerebral si la pacientii care se prezinta la 3-12 ore de la debutul durerilor toracice pentru salvare miocardica si prevenirea accidentului cerebral. La acest moment nu exista dovezi pentru a recomanda PCI facilitata. PCI de salvare este recomandata daca tromboliza este ineficienta in intervalul de 45-60 minute dupa debutul administrarii. Dupa tromboliza reusita, folosirea angiografiei coronariene de rutina in primele 24 de ore si PTCA, daca e posibil, este recomandata chiar si la pacientii asimptomatici fara ischemie demonstrabila pentru imbunatatirea evolutiei pacientului. Daca centrul de PCI nu este disponibil in primele 24 de ore pacientii care au fost trombolizati cu succes, pacientii cu evidenta de ischemie spontana sau inductibila, inainte de externare, trebuiesc coronarografiati si revascularizati in consecinta indiferent de terapia "maximala" medicamentoasa.
Preambul
Ghidurile si Documentele Consensului Expertilor au scopul de a prezenta toate dovezile relevante asupra unui anumit subiect cu scopul de a ajuta medicii in a cantari beneficiile si riscurile unui anumit diagnostic sau proceduri terapeutice. Ele ar trebui sa fie de ajutor in luarea deciziilor clinice curente.
Un mare numar de Ghiduri si Documente ale Consensului Expertilor au fost elaborate in anii din urma de catre Societatea Europeana de Cardiologie (ESC) si de diferite organizatii sau alte societati inrudite. Aceasta abundenta poate periclita autoritatea si validitatea ghidurilor care pot fi garantate numai daca acestea au fost dezvoltate printr-un proces de luare a deciziei indubitabil. Acesta este unul dintre motivele pentru care ESC si alte societati si organizatii au emis recomandari de formulare si redactare a Ghidurilor si Documentelor Consensului Expertilor.
Cu toate ca sunt bine definite standardele de publicare a Ghidurilor si Documentelor Consensului Expertilor de buna calitate, studii recente ale acestora publicate in reviste recenzate de colegi intre anii 1985 si 1998 au aratat ca standardele metodologice nu s-au conformat, in marea majoritate a cazurilor. De aceea este de mare importanta ca ghidurile si recomandarile sa fie prezentate in formate usor de interpretat. Astfel, programele de implementare ale acestora trebuiesc de asemenea sa fie bine dirijate. Au avut loc incercari pentru a determina in ce masura ghidurile imbunatatesc calitatea practicii clinice si utilizarea resurselor de sanatate.
Comitetul ESC pentru Ghidurile de Practica (CGP) supervizeaza si coordoneaza pregatirea noilor Ghiduri si a Documentelor Consensului Expertilor produse de Grupurile de Lucru, grupurile de experti sau consensul meselor rotunde. Expertii alesi in aceste ateliere de lucru pentru redactarea documentelor sunt solicitati sa furnizeze declaratii de interese a tuturor legaturilor pe care le-ar putea avea si care ar putea fi percepute ca fiind conflicte de interese reale sau potentiale. Aceste declaratii de interese sunt pastrate in dosare la Casa Europeana a Inimii, sediul central al ESC. Comitetul este responsabil si pentru aprobarea acestor Ghiduri si Documente ale Consensului Expertilor sau a declaratiilor.
Grupul de Lucru a clasificat si ordonat utilitatea sau eficacitatea procedurilor si/sau tratamentelor recomandate si Nivelul de Evidenta, asa cum sunt indicate in tabelele ce urmeaza:
Clasele de recomandare
|
Clasa I |
Evidenta si/sau acord general ca o procedura de diagnostic/tratament data este benefica, utila si eficienta |
|
Clasa II |
Evidente contradictorii si/sau divergente de opinii asupra utilitatii/ eficacitatii tratamentului |
|
Clasa IIa |
Balanta evidentei/opiniei inclina in favoarea utilitatii/eficacitatii |
|
Clasa IIb |
Utilitatea/eficacitatea sunt mai putin bine stabilite de evidente/opinii |
Nivele de evidenta
|
Nivel de evidenta A |
Date derivate din multiple trialuri clinice randomizate sau meta-analize |
|
Nivel de evidenta B |
Date derivate dintr-un singur trial clinic randomizat sau studii mari nerandomizate |
|
Nivel de evidenta C |
Consens de opinie al expertilor si/sau studii mici, studii retrospective, registre |
1. Introducere si definitii
Cu extraordinara crestere a publicatiilor accesibile, ghidurile devin din ce in ce mai importante pentru a face utilizabile clinicienilor cele mai relevante informatii cat timp imbunatatesc simultan calitatea ingrijirii pacientilor pe baza evidentelor1,2. Mai mult, ghidurile sunt din ce in ce mai folosite de catre furnizorii serviciilor de sanatate si politicieni pentru evaluarea "folosirii adecvate" si dezvoltarea programelor de management al bolilor. ESC are o traditie - initiata in 1992 - de a publica anual rapoarte si analize privind cardiologia interventionala3. Ghidurile ESC pentru interventii coronariene percutane (PCI), cu toate acestea, nu au fost stabilite. Este scopul acestor ghiduri pentru a da recomandari practice pentru efectuarea PTCA pe baza datelor publicate derivate din studii clinice randomizate si nerandomizate.
1.1. Metode de analiza
Analiza literaturii a fost efectuata folosind Medline (PubMed) pentru literatura recenzata publicata. Folosirea rezumatelor trebuie evitata in ghiduri. In conformitate cu recomandarile ESC pentru crearea grupului de lucru si producerea de rapoarte, trialurile clinice prezentate la reuniunile cardiologice importante au fost incluse pentru luarea deciziei cu conditia ca autorii sa furnizeze o schita a documentului final pentru a fi propus spre publicare4.
1.2. Definirea nivelelor de recomandare
Nivelele de recomandare au fost gradate pe baza recomandarilor4 ESC. In contrast cu nivelele de recomandare5 ACC/AHA, clasa III ("conditii pentru care este evidenta si/sau acord general ca procedura nu este utila/eficienta si in anumite cazuri poate fi daunatoare") este descurajata de ESC4 (Tabelul claselor de recomandare). Consensul poate fi obtinut pentru toate recomandarile pe baza evidentelor (Tabelul Nivelelor de Evidenta). Pentru verificarea aplicabilitatatii recomandarilor intr-o zona specifica, masa rotunda a expertilor a subliniat importanta endpoint-ului primar pentru trialurile randomizate, dandu-le importanta prioritara in a imbunatatii evolutia pacientilor ca si endpoint primar investigat in loturi de marimi adecvate.
2. Indicatii pentru PCI
2.1. Indicatii pentru PCI
in boala
coronariana stabila
2.1.1. Indicatii generale pentru PCI in boala coronariana stabila
2.1.1.1. PCI vs terapia medicamentoasa
Trei studii randomizate au comparat PCI cu tratamentul medicamentos. Studiul ACME6,7 a fost conceput pentru a evalua in ce masura PCI este superioara tratamentului medical optimizat in ameliorarea anginei la pacientii cu boala uni- sau bi-vasculara. PCI a oferit o mai precoce si o mult mai completa ameliorare a anginei decat tratamentul medicamentos si s-a asociat cu o toleranta la efort ameliorata si/sau ischemie redusa in timpul probei de efort6. Unele din beneficiile precoce ale PCI la pacientii cu boala uni-vasculara se mentin, facand-o o alternativa terapeutica atractiva pentru acesti pacienti7. Trialul ACIP8 s-a centrat pe pacientii cu ischemie cotidiana severa. Pacientii aveau atat ischemie indusa de stress cat si cel putin un episod de ischemie silentioasa la monitorizarea Holter pe 48 ore (Tabelul 1). La doi ani de la randomizare mortalitatea totala a fost semnificativ redusa de la 6,6% in angina ghidata la 4,4% in ischemia ghidata si la1,1% in strategia de revascularizare9. (Recomandari de PCI pentru a trata ischemia intinsa: I A).
La pacientii fara sau cu simptome usoare, in orice caz scenariul este diferit si putin probabil sa fie ameliorat de PCI, asa cum a fost aratat de trialul AVERT10,11. La 18 luni, 13% din pacientii cu terapie hipolipemianta agresiva au avut evenimente ischemice, in comparatie cu 21% din pacientii care au avut PCI conform planificarii. Aceasta diferenta a fost la inceput semnificativa statistic, dar si-a pierdut semnificatia dupa ce a fost ajustata pentru analiza interimara. Exista doua limitari majore in AVERT: (i) nu este o comparatie corecta a tratamentului medical cu PCI deoarece un tratament hipolipemiant mult mai agresiv a fost folosit la bratul medical; stentarea a fost utilizata in doar 30% din cazuri si restenoza, necesitand re-interventia, este mai probabil sa apara in grupul cu PTCA decat in grupul tratat conservativ. (ii) AVERT nu a demonstrat efectul antiischemic al statinelor, dar a aratat ca statinele pot preveni evenimentele coronariene acute. RITA-2 a fost un trial randomizat, care a comparat efectele pe termen lung ale PCI cu tratamentul conservativ (medicamentos) la pacientii cu CI considerata potrivita pentru ambele tipuri de tratament. Dupa o urmarire medie de 2,7 ani, decesul sau infarctul miocardic definit a survenit in 6,3% la pacientii tratati cu PCI si 3,3% la pacientii tratati medicamentos (p=0,02). Pe de alta parte, PCI a fost asociata cu o mai buna ameliorare simptomatica, mai ales la pacientii cu angina mai severa. RITA-2, oricum, nu poate fi aplicata la trat. interventional modern din zilele noastre. Numai 7,6% dintre pacienti au fost stentati. Ticlopidina, clopidogrelul, sau inhibitorii GP IIb/IIIa nu au fost nici macar mentionati in studiu.
O meta-analiza a trialurilor controlate randomizate a gasit ca PCI poate conduce la o mai mare ameliorare a anginei in comparatie cu tratamentul medicamentos, desi trialurile nu au inclus suficienti pacienti pentru estimarea informativa a efectului PCI asupra infarctului miocardic, decesului, sau revascularizarii subsecvente13. Indiferent de distribuirea spre PCI sau tratament medicamentos (studiul TIME14) si medicatie cu cel putin doua medicamente antianginoase, supravietuirea pe termen lung a fost similara la pacienti de 75 ani sau peste, prezentand angina clasa canadiana II sau peste. Beneficiile ambelor tratamente in ameliorarea anginei si imbunatatirea calitatii vietii au fost mentinute, dar evenimentele non-fatale au fost mai frecvente la cei tratati medicamentos. Indiferent daca pacientii au fost cateterizati initial sau numai dupa esecul terapiei medicamentoase, rata lor de supravietuire a fost mai buna, daca au fost revascularizati in primul an14. Costurile nu trebuie sa fie un argument impotriva managementului invaziv la pacientii varstnici cu angina cronica15.
Tabelul 1. Recomandari de indicatie a PCI in CAD stabila
|
Indicatie |
Clase de recomandare si nivele de evidenta |
Studii randomizate pentru nivelele A sau B |
|
Ischemie obiectiva intinsa |
I A |
ACMEa ACIPb |
|
Ocluzie cronica totala |
IIa C |
|
|
Risc chirurgical crescut, incluzand FE VS <35% |
IIa B |
AWESOME |
|
Boala multivasculara/diabetici |
IIb C |
|
|
LM neprotejat in absenta altor alternative de revascularizare |
IIb C |
|
|
Stentarea de rutina a leziunilor de novo pe coronarele native |
I A |
BENESTENT-I STRESS |
|
Stentarea de rutina a leziunilor de novo pe grafturile venoase |
I A |
SAVED VENESTENT |
|
Presupunand ca leziunile considerate cele mai semnificative sunt tehnic pretabile la dilatare si stentare, nivelele de recomandare se refera la utilizarea stenturilor metalice. aBeneficiul s-a limitat la ameliorarea simptomelor capacitatii de efort. bACIP nu e un trial pur pentru PCI vs. tratament medical avand in vedere ca jumatate din pacienti au fost tratati cu bypass. Stenturile active farmacologic vor fi discutate mai jos. |
||
2.1.1.2. PCI vs chirurgia de bypass
Date comparand PCI cu bypass-ul coronarian deriva din 13 trialuri, randomizand 7964 de pacienti intre 1987 si 1999. Pentru o perioada de urmarire de 8 ani, nu au fost diferente semnificative statistic pentru deces intre cele doua strategii de revascularizatie la 1, 3, sau 8 ani (exceptand anul 5)16. Folosirea stenturilor joaca un rol major: in trialurile timpurii, fara stenturi, a fost un trend favorizand bypassul fata de PCI la 3 ani care nu mai este prezent in trialurile mai recente cu stenturi16. Trendul in favoarea chirurgiei a disparut in ciuda reducerii mortalitatii in bratul cu bypass de la 5,2% in trialurile fara stent la 3,5% in trialurile mai recente cu stent. Stentarea a injumatatit diferenta riscului pentru repetarea revascularizatiei. Atat PCI cat si chirurgia ofera ameliorare buna a simptomelor.
2.1.2. Indicatii de PTCA in subseturi speciale de pacienti stabili
2.1.2.1. Ocluzii cronice totale
Ocluzia cronica totala (CTO) reprezinta inca un subset anatomic asociat cu cea mai mica rata de succes a PCI. Cand ocluzia poate fi trecuta cu ghidul si cand se ajunge in lumenul distal, rezultate satisfacatoare sunt obtinute cu implantarea stenturilor, asa cum o demonstreaza mai multe trialuri cu end-point primar angiografic (GISSOC17, PRISON18, SARECO19, SICCO20, SPACTO21, STOP22 si TOSCA23), desi costurile ratei mari de restenoza sunt cuprinse intre 32 si 55%. In aceasta privinta valoarea stenturilor active farmacologic se evalueaza in prezent. In studiul PACTO tratamentul CTO cu stent Taxus a redus considerabil evenimentele cardiace adverse majore (MACE) si restenoza si aproape a eliminat reocluzia - toate tipic survenind la stenturile metalice neacoperite24. Primele rezultate dinr-un registru cu stent Cypher au fost incurajatoare25. Inainte de abordarea CTO trebuie sa avem in minte posibilitatea riscului crescut al ocluziei ramului colateral sau perforatiei. (Recomandari pentru PCI la pacientii cu CTO: IIa C).
2.1.2.2. PCI la pacienti cu risc chirurgical crescut
Trialul AWESOME26 a testat ipoteza ca PCI este sigura si o alternativa eficienta la CABG (bypassul aortocoronarian) la pacientii cu ischemie refractara si risc crescut pentru evolutie nefavorabila. Intr-o analiza a unui subgrup de pacienti cu CABG anterior, prin repetarea CABG si PCI rata supravietuirii la 3 ani a fost de 73 si respectiv 76%27. Pacientii cu functie ventriculara stinga sever depreciata par a beneficia de pe urma revascularizatiei prin PCI, in particular cand exista evidenta de viabilitate restanta a miocardului disfunctional. "Registrul alegerii pacientului" a evidentiat ca PCI este preferabila fata de CABG pentru multi pacienti post-CABG27. Concluziile trialului AWESOME si registrului sunt aplicabile de asemenea subsetului de pacienti cu fractie de ejectie a ventriculului stang scazuta (LVEFs)28. (Recomandari pentru PCI la pacienti cu risc chirurgical crescut: IIa B).
2.1.2.3. PCI la pacient cu boala multi-vasculara si/sau diabet zaharat
La pacientii cu boala multi-vasculara si multe caracteristici de risc crescut, CABG a fost asociat cu o supravietuire mai buna decat PCI, dupa ajustarea pentru profilul de risc29. Diferentele timpurii in costuri si calitatea vietii intre CABG si PCI, oricum, nu mai au semnificatie la 10-12 ani de urmarire la pacientii cu boala multi-vasculara30. Decizia de a efectua revascularizatia leziunii vinovate sau revascularizatie completa poate fi facuta pe baza evaluarii individuale31.
Desi un trial oficial, evaluand valoarea PCI vs. CABG la diabetici, nu este inca disponibil, analiza fiecarui subgrup sau post hoc, au aratat invariabil ca evolutia dupa PCI este mai rea decat dupa CABG. In trialul ARTS32,33 prin compararea PCI cu chirurgia la pacientii cu boala multi-vasculara rezultatul a fost slab pentru diabetici in ambele brate de tratament, dar chiar mai slab dupa PCI. Dupa 3 ani mortalitatea a fost de 7,1% in grupul de PCI si 4,2% in cel de CABG cu o diferenta inca semnificativa in supravietuirea fara evenimente de 52,7% la grupul de PCI si 81,3% la grupul de CABG33. La pacientii cu boala multi-vasculara, PCI la cei cu 1 sau 2 leziuni semnificative hemodinamic dupa cum au fost identificate de FFR <0,75 (vezi sectiunea 4.6.2) a atins o evolutie favorabila similara cu CABG la pacientii cu 3 sau mai multe leziuni vinovate in ciuda intinderii angiografice similare a bolii34. (Recomandarea pentru PCI la pacientii cu boala multi-vasculara si/sau diabet zaharat: IIb C). Date recente referitoare la utilizarea stenturilor farmacologic active la pacientii cu boala multi-vasculara si/sau diabet zaharat pot schimba situatia.
2.1.2.4. PCI pentru trunchi principal neprotejat
Prezenta unei stenoze coronariene a trunchiului principal (LM) defineste un subgrup anatomic necesitand inca CABG pentru revascularizatie. PCI pentru LM protejat (adica partial protejat de bypass) poate fi efectuat, desi un MACE de 25% la 1 an este inca mai degraba mare, ceea ce poate reflecta o mortalitate crescuta la pacientii cu CAD severa ce au suferit un bypass anterior35,36. Mortalitatea de 2% periprocedurala si supravietuirea de 95% la 1 an pentru stentarea LM protejat apare comparabila ca evolutie cu repetarea CABG in timp ce evita eventualele morbiditati asociate cu repetarea interventiei chirurgicale36.
Stentarea pentru boala de LM neprotejat poate fi luata in considerare doar in absenta altor optiuni de revascularizatie36. In consecinta, PCI poate fi recomandat la aceste subgrupuri cand CABG are un risc perioperator mare (ex. EuroSCORE >10%). Datele initiale in utilizarea stenturilor active farmacologic la LM neprotejat par promitatoare37,38. (Recomandari de PCI la pacientii cu stenoza de LM neprotejat in absenta altor optiuni de revascularizatie: IIb C).
2.1.3. Stentare electiva sau de necesitate in CAD stabila?
Nu exista nici un dubiu ca stenturile sunt unelte valoroase in disectii care ameninta cu ocluzia vasului sau, dupa rezultate nesatisfacatoare dupa angioplastia cu balon. In general stenturile sunt superioare balonului (BENESTENT-I39, STRESS40, REST41 si altele42-45) pentru urmatoarele motive:
Fractura placii si disectia cauzata de angioplastia cu balon are ca rezultat frecvent o procedura pseudo-reusita si obtinerea unei largiri luminale insuficiente.
In timp ce ocluzia acuta la 48 de ore dupa angioplastia cu balon nu este neobisnuita (pana la 15% in prezenta disectiei reziduale severe), leziunile tratate demonsteraza o mai mare stabilitate acuta si subacuta.
Rezultatele angiografice ce pot fi obtinute dupa stentare sunt predictibile indiferent de complexitatea stenozei.
Pe termen mediu-lung implantarea stentului are ca rezultat mai putine ocluzii vasculare sau reocluzii si rate mai scazute de restenoza.
Intr-o meta-analiza a 29 de trialuri implicand 9918 pacienti, stentarea coronariana, comparata cu angioplastia cu balon, reduce rata de restenoza si necesitatea repetarii PCI cu aproximativ 50%46. O meta-analiza recenta41 a aratat ca stentarea este asociata cu reducerea mortalitatii comparativ cu angioplastia cu balon si pacientii, carora li s-a implantat stent, au avut un risc semnificativ mai scazut de MACE cand revascularizatia tinta este inclusa ca si end-point48. Beneficiul stentarii de rutina este si mai evident la coronarele mici49. Un beneficiu similar poate fi observat in cazul grafturilor venoase de bypass (SAVED50, VENESTENT51). Dupa implantarea de stent metalic neacoperit, evolutia clinica la 5 ani este legata de progresia bolii in alte segmente decat leziunea stentata, care ea insasi ramane relativ stabila52,53. (Recomandari pentru stentarea de rutina a leziunilor de novo in coronarele native sau grafturi venoase de bypass la pacientii cu CAD stabila:I A).
2.1.4. Cresterea troponinei dupa PCI in CAD stabila.
Eliberarea troponinei este relativ comuna dupa PCI si asociata cu complicatii procedurale, incluzand ocluzia arterelor colaterale, formare de tromb, interventii pe grafturi venoase, utilizarea mai multor stenturi si folosirea glicoproteinei IIb/IIIa54,55. La pacientii fara infarct miocardic acut, cresterea troponinei I dupa PCI nu e predictiva pentru mortalitate56 si cresterea post-PCI de mai mult de trei ori decat normalul nu are risc sporit de evolutie clinica nefavorabila la 8 luni57. O meta-analiza a 2605 pacienti sugereaza ca folosirea unei valori limita joase dupa PCI nu se coreleaza cu cresterea incidentei evenimentelor adverse compozite (moarte cardiaca, infarct miocardic, CABG, sau repetarea PCI asupra vasului tinta) si cativa multiplii ai valorii limita pot fi mai adecvati pentru predictia evenimentelor adverse58. Intr-un studiu recent, chiar cresterea troponinei-I de 5 ori peste normal nu a prezis evenimente dupa externare59. Din acest motiv, in ceea ce priveste cresterea markerilor cardiaci periprocedurali, exista tot mai multe evidente ca doar cresterea CK-MB de mai mult de 5 ori normalul (si nu orice nivel de crestere a troponinei I) se asociaza cu o mortalitate mai ridicata la urmarire, in timp ce cresterea usoara a CK-MB (1 pana la 5 ori normalul) este din ce in ce mai mult privita ca si un eveniment obisnuit datorat procedurii cu mica relevanta prognostica56.
In rezumat PCI poate fi considerata o modalitate initiala valoroasa de revascularizatie la toti pacientii cu CAD stabila si ischemie intinsa obiectivata la aproape toate subseturile de pacienti cu o singura exceptie: CTO care nu poate fi trecuta. In studiile timpurii a fost un usor avantaj pentru CABG din punct de vedere al supravietuirii comparata cu PCI fara stentare. Adaugarea stenturilor si a noilor terapii adjuvante au imbunatatit evolutia dupa PCI. Decizia de a recomanda PCI sau CABG se va ghida dupa ameliorarile tehnice in cardiologie sau chirurgie, experienta locala si preferinta pacientului. In orice caz, pana la proba contrarie, PCI trebuie folosita doar cu rezerve la diabetici cu boala multi-vasculara si la pacientii cu stenoza de LM neprotejat. Folosirea stenturilor farmacologic active poate schimba aceasta situatie.
2.2. Indicatii de PCI in sindroamele coronariene acute fara supradenivelare de ST (NSTE-ACS)
Recent ESC a publicat ghiduri de management general al sindroamelor coronariene acute (ACS) la pacienti fara supradenivelare persistenta de ST60. Ghidul prezent se concentreaza pe rolul PCI in optimizarea managementului pacientilor cu NSTE-ACS. Pacientii cu markeri serici crescuti [troponina (Tn-I, Tn-T) sau CK-MB] vor fi in continuare considerati ca avand infarct miocardic fara supradenivelare de ST (NSTEMI).
2.2.1. Stratificarea riscului in NSTE-ACS
Importanta stratificarii pacientilor cu angina instabila (UA) sau NSTEMI in grupuri cu risc inalt vs grupuri cu risc scazut se sprijina pe beneficiul clar al angiografiei precoce si, cand e necesar, PCI, raportat doar la grupul de risc crescut61-65.
In concordanta cu ghidurile ESC de tratament al NSTE-ACS60 caracteristicile pacientilor cu risc crescut de evolutie spre infarct miocardic sau deces, care ar trebui sa faca angiografie in 48 de ore, sunt redate in Tabelul 266-76.
Mai mult, urmatorii markeri de boala subjacenta severa, cum ar fi risc crescut pe termen lung, pot fi de ajutor in evaluarea riscului in NSTE-ACS63-73,77-80.
varsta >65-70 ani;
istoric de boala coronariana cunoscuta, infarct miocardic in antecedente, antecedente de PCI sau CABG;
insuficienta cardiaca congestiva, edem pulmonar, suflu nou de insuficienta mitrala;
markeri inflamatori crescuti (CRP, Fibrinogen, IL6);
BNP sau NT-proBNP in patrimea superioara;
insuficienta renala.
Tabelul 2. Caracteristicile pacientilor cu NSTE-ACS cu risc trombotic acut crescut pentru evolutie spre infarct miocardic sau deces care trebuiau sa efectueze coronarografie in 48 de ore
|
|
durere recurenta la repaus |
|
|
modificari dinamice ale ST: subdenivelare ST ≥0,1 mV sau supradenivelare tranzitorie (<30 min) de ST ≥0,1mV |
|
|
nivele crescute de Troponina-I, Troponina-T sau CK-MB |
|
|
instabilitate hemodinamica pe parcursul observatiei |
|
|
aritmii majore (tahicardie ventriculara, fibrilatie ventriculara) |
|
|
angina precoce post infarct |
|
|
diabet zaharat |
O analiza post hoc a TACTIS-TIMI 18 sugereaza ca strategia invaziva precoce de rutina amelioreaza semnificativ evolutia ischemiei la pacientii varstnici cu NSTE-ACS81.
2.2.2. Conservativ, invaziv precoce sau imediat invaziv?
Studii recent publicate au aratat ca mai putin de 50% din pacientii cu NSTE-ACS efectueaza proceduri invazive (GRACE82 si CRUSADE83). Sustinatorii strategiei conservative in managementul UA si NSTEMI isi bazeaza sugestiile lor pe rezultatele trialurilor TIMI IIB84, MATE85 si VANQWISH86. Mai multe fisuri metodologice apar in aceste studii (rata crescuta de crossover, utilizare redusa sau deloc a stenturilor, nefolosirea inhibitorilor GP IIb/IIIa), facand concluziile lor anacronice. In GUSTO IV-ACS, revascularizatia in intervalul de 30 de zile a fost asociata cu ameliorarea prognosticului87. Mortalitatea relativ crescuta la pacientii tratati medicamentos poate fi legata, in parte, de selectia pacientilor.
Pe langa doua studii europene reduse (TRUCS88 si VINO89), preferinta pentru abordarea timpuriu invaziva vs. abordarea initial conservativa se bazeaza pe rezultatele a 6487 pacienti in trei trialuri: FRISC II90, TACTIS-TIMI 1891 si RITA-392. (Tabelul 3 si 4 si Figura1). (Recomandari pentru PCI precoce la pacientii cu risc crescut NSTE-ACS: I A).
Desi precautia este necesara in interpretare, diferentele de sex pot exista93. Exista multe studii in derulare (ex. ICTUS), care includ un regim antiplachetar mai potent si in consecinta pot modifica recomandarilor curente de strategie invaziva. ISAR-COOL94 a comparat o strategie medicala ("de racire") vs PCI imediat la pacientii cu risc crescut cu subdenivelare de ST (65%) sau troponina T crescuta (67%). Durata medie pana la cateterizare a fost de 86 ore in grupul "de racire" si de 2,4 ore in grupul imediat invaziv. Numai 5,8% din grupul pacientilor amanati au trebuit cateterizati mai devreme. End point-ul primar, definit ca decesul din orice cauza si infarct miocardic intins non-fatal la 30 de zile, a survenit la 11,6% in grupul "de racire" (pre-tratament antitrombotic prelungit) vs 5,9% la pacientii randomizati in grupul cu strategie invaziva imediata (p=0,04). Aceasta evolutie a fost atribuibila evenimentelor survenite inaintea cateterizarii. Investigatorii au concluzionat ca la pacientii cu NSTE-ACS cu risc crescut, intarzierea interventiilor nu amelioreaza evolutia si pre-tratamentul antitrombotic trebuie mentinut la durata minima necesara pentru organizarea cateterizarii si revascularizatiei.
Tabelul 3.
Cele trei trialuri controlate, randomizate comparand strategia initial
conservativa (cateterizare la nevoie) cu strategia initial
invaziva
(cateterizare de rutina cu revascularizatie dupa
necesitati) la pacientii cu NSTE-ACS
|
|
FRISC II |
TACTIS-TIMI 18 |
RITA 3 |
|
Perioada de inrolare Numar de pacienti Cateterizarea pacientilor (criterii de includere) Anticoagulare Folosirea GP IIb/IIIa % Bazata doar pe cazurile cu PCI (conservativ timpuriu/invaziv timpuriu) Strategii Cateterizare efectuata (%) (conservativ/invaziv la 4 sau 6 luni) PCI efectuat% (conservativ/invaziv la 4 sau 6 luni) Utilizare stent% (conservativ/invaziv la 4 sau 6 luni) Orice revascularizatie% (conservativ/invaziv la 4 sau 6 luni) End point primar definit La momentul Rezultat al endpoint primar (%) (conservativ/invaziv) Endpoint primar atins |
UA/NSTEMI Initial marcat (UFH sau LMWH dalteparin) pana la 72 ore apoi randomizati in 4 grupuri Abciximab 10/10 Conservativa timpuriu (selectiv invaziva) vs. invaziva de rutina: (PCI<7 zile de la inceputul tratamentului deschis ) Deces/infarct miocardic (MI) 6 luni 12,1/9,4a Da |
UA/NSTEMI Toti UFH Tirofiban 59/94 Conservativa timpuriu (selectiv invaziva) vs. invaziva de rutina (<4-48 ore dupa randomizare si revascularizatie cand se impune) Deces/IM non fatal/respitalizare pentru ACS 6 luni 19,4/15,9a Da |
UA/NSTEMI Inaintea randomizarii: 84% LMWH (enoxaparin) 11% UFH (egal in ambele grupuri); Dupa randomizare: toti enoxaparina Oricare 25 Conservativa timpuriu (selectiv invaziva) vs. invaziva de rutina (coronarografie<72 ore dupa randomizare); majoritatea pacientilor au fost transferati in centre cu facilitati de PCI Deces/IM/ angina refractara 4 luni 14,5/9,6a Da |
|
Toate trei studiile si-au atims endpoint-ul primar ap<0,05 |
|||
Tabelul 4. Recomandari pentru PCI in NSTE-ACS (UA sau NSTEMI)
|
Procedura |
Indicatie |
Clase de recomandare si nivele de evidenta |
Studii randomizate pentru nivelele A si B |
|
PCI precoce |
NSTE-ACS risc crescut |
I A |
FRISC-II, TACTIS TIMI 18, RITA-3 |
|
PCI imediat |
NSTE-ACS risc crescut |
Iia B |
ISAR-COOL |
|
Stentare de rutina leziuni de novo |
Toate NSTE-ACS |
I C |
|
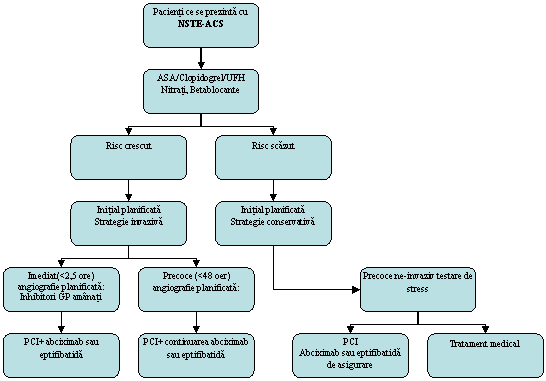
Figura 1. Diagrama pentru planificarea angiografiei si PCI, daca este indicat, in concordanta cu stratificarea riscului la pacientii cu NSTE-ACS (UA sau NSTEMI). GPI, inhibitori glicoproteina Iib/IIIa. Daca, din anumite ratiuni, intarzierea intre cateterismul de diagnostic si planificarea PCI este pana la 24 ore, abciximab poate fi de asemenea administrat. Enoxaparin poate fi considerat ca un inlocuitor pentru UFH la pacientii cu NSTE-ACS cu risc crescut, daca strategia invaziva nu este aplicabila. Nivelele de recomandare sunt date in Tabelele 4, 8 si 13.
(Recomandari pentru PCI imediat <2,5 ore la pacienti cu NSTE-ACS cu risc inalt: IIa B)
In majoritatea studiilor, folosind PCI in UA sau NSTEMI, stentarea a fost tratamentul definitiv cel mai frecvent aplicat. (Recomandari pentru stentarea de rutina a leziunilor de novo la pacienti cu NSTE-ACS cu risc crescut: I C).
In rezumat, pacientii ce se prezinta cu NSTE-ACS (UA sau NSTEMI) trebuie mai intai stratificati pentru riscul de complicatii acute trombotice. Un beneficiu clar in urma angiografiei precoce (<48 ore) si, la nevoie, PCI sau CABG a fost raportat doar la grupurile cu risc crescut. Intarzierea interventiei nu amelioreaza evolutia. Stentarea de rutina este recomandata pe baza predictibilitatii rezultatelor si sigurantei imediate.
2.3. Indicatii pentru
PCI in ACS cu
supradenivelare de ST (STEMI)
ESC a publicat recent studii pentru managementul general al pacientilor ce se prezinta cu STEMI, adica pacienti cu istoric de dureri toracice /disconfort asociat cu supradenivelare persistenta de segment ST sau (prezumat) bloc de ramura stanga nou aparut95. Prezentul ghid se concentreaza mai specific pe folosirea PCI in aceasta situatie (Figura 2).
PCI pentru STEMI necesita o echipa experimentata de cardiologi interventionisti lucrand impreuna cu un personal ajutator calificat. Aceasta inseamna ca doar spitalele cu un program interventional bine stabilit trebuie sa foloseasca PCI pentru STEMI in locul trombolizei intravenoase. Majoritatea trialurilor, comparand tromboliza cu PCI primar, au fost derulate in centre cu volum mare de cazuri, cu operatori experimentati cu timp de raspuns scurt. De aceea, rezultatele nu se aplica neaparat la toate spitalele. Au fost observate mari variatii de evolutie intre diferite spitale. In general PCI pentru STEMI necesita experienta mai mare decat pentru boala coronariana stabila. La pacienti cu boala multitronculara PCI primar trebuie efectuat numai asupra arterei implicate in infarct (vasul tinta), iar decizia de PCI asupra celorlate vase sa fie luata in conditii de obiectivare a ischemiei restante.
Din fericire, implementarea ghidurilor pentru STEMI a ameliorat standardul de ingrijire al pacientilor. Intr-un studiu s-a observat ca PCI primar inafara orelor de program avea rezultate mai slabe decat cel efectuat in timpul programului de lucru. Intr-un alt studiu s-a observat ca PCI primar in timpul de lucru a avut rezultate simlare (fluxul TIMI 3, mortalitate la 30 de zile si un an ameliorarea cineticii ventriculare) cu cel din afara orelor de lucru.
<12h de la
debutul simptomelor
Figura
2.
STEMI

Esuata Succes PCI primar PCI de salvare PCI post
tromboliza PCI de ischemie
![]()
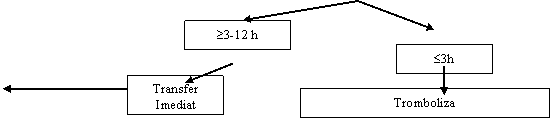
![]()
![]()

2.3.1. PCI primar
Se defineste ca interventia asupra vasului tinta efectuat in maximum 12 ore de la debutul durerii toracice, fara a fi insotita sau a urma unei terapii trombolitice. Primele PCI primare s-au efectuat in anul 1979 la 2 ani de la inceputul angioplastiei. De atunci mai multe trialuri randomizate au certificat ca PCI primar este superior trombolizei intravenoase pentru tratamentul STEMI (restaurarea mai frecventa a patentei coronariene, ischemie recurenta redusa, reocluzie coronariana redusa, recurenta de infarct redusa, ameliorarea functiei ventriculare stangi, evenimente clinice mai putine, inclusiv AVC). Se pare ca femeile, respectiv varstnicii beneficiaza in mod particular de PCI primar fata de tromboliza.
O meta-analiza a 23 trialuri randomizate care cumuleaza 7739 pacienti eligibili fie pentru tromboliza pentru STEMI fie pentru PCI primar sau tratament trombolitic arata ca: PCI a fost mai eficient ca tromboliza in redu cerea deceselor pe termen scurt - 4-6 saptamani - (9,3 vs 7,0% , P = 0,0002) a infarctelor non fatale (6,8 vs, 2,5%, P <0,0001), a AVC-urilor (2,0 vs 1,0% P = 0,0004) si a end-poitului combinat (14,5 vs 8,2%, P = 0,0001). Pe termen lung (6-18 luni) rezultatele obtinute cu PCI primar raman mai bune decat cele cu tromboliza, deces 12,8 vs 9,6%, infarct non fatal 10,0 vs 4,8%, iar endpointul combinat 19 vs 12%.
Cea mai impresionanta diferenta intre tromboliza si PCI primar a fost reducerea ischemiei recurente de la 21% cu tromboliza la 6% dupa PCI primare pe termen scurt (P <0,0001) si deasemenea pe termen lung (39 vs 22 %; P <0,0001).
Recomandare pentru PCI primar in STEMI: I A
Studiile privot care au contribuit la nivelul de evidenta A pentru PCI priamar in STEMI sunt: PAMI, GUSTO II b, C-PORT, PRAGUE - 1, PRAGUE 2, DANAMI -2.
2.3.1.1. Transferul pacientilor pentru PCI primar
Este sigur ca pacientii cu STEMI prezentati in spitalele fara facilitati de PCI si care au contraindicatii pentru tromboliza trebuie transferati de urgenta pentru coronarografie si daca e posibil PCI intr-un alt spital, deoarece angioplastia poate fi singura sansa de deschidere a arterei coronare. Contraindicatiile absolute de tromboliza sunt: disectiile de aorta, stare dupa AVC hemoragic, chirurgie sau trauma recenta, singerari gastrointestinale in ultima luna si sindroame hemoragipare. Pacientii cu contraindicatii pentru tromboliza au o mortalitate si morbiditate mai mare decat cei eligibili. PCI primar nu a fost evaluat prin trialuri randomizate la pacienti cu indicatie de tromboliza dar a fost dovedit ca e fezabil intr-un mare numar de cazuri. Recomandari de PCI primar la pacienti cu contraindicatii de tromboliza: I C.
Decizia de a transfera pacientul spre centre cu facilitati de PCI depinde de stratificarea riscului individual. Alegerea intre PCI si tromboliza este dictata de probleme de logistica si intarzieri de transport. Trialurile care au investigat superioritatea PCI primar in ciuda necesitatii transferului dintr-un spital secundar spre un spital cu facilitati PCI sunt: LIMBURG, PRAGUE 1, PRAGUE 2, AIR-PAMI, DANAMI 2.
Trialul DANAMI-2 a fost primul care a demonstrat reducerea end-pointului de deces, reinfarctizare, AVC, deces la 30 de zile dupa PCI primar in ciuda intarzierii date de transport.
Trialul PRAGUE 2 a fost oprit prematur din cauza unui exces de mortalitate in grupul cu trombolitic la pacientii cu debut al simptomelor peste 3 ore. La acesti patienti, mortalitatea a atins 15,3% comparat cu 6% in grupul cu PCI primar. (P = 0,02) Pacientii randomizati sub 3 ore de la debutul simptomelor nu au avut diferente de mortalitate intre diferitele tipuri de tratament: 7,4% tromboliza, 7,3% transfer spre PCI primar. Aproximativ 2/3 din pacienti au fost randomizati sub 3 ore de la debutul simptomelor astfel incat PRAGUE 2 nu a avut sanse de a atinge end-pointul primar.
In primele 3 ore de la debutul durerii toracice tromboliza e alternativa viabila asa cum arata PRAGUE 2, STOPAMI 1 si 2, MITRA, MIR si CAPTIM cu tromboliza pe spital. Deci in primele 3 ore de la debutul simptomelor ambele strategii de reperfuzie par sa fie echivalente in reducerea marimii infarctului si a mortalitatii. Superioritatea PCI primar, fata de tromboliza in primele 3 ore a fost urmarita de analiza combinata a trialurilor STOPAMI 1 si 2. Indexul de salvare miocardica nu a fost diferit intre tromboliza si PCI primar in primele 165 de minute (0,29 vs 0,56), a aratat o superioritate usoara a PCI intre 165 si 280 minute (0,29 vs 0,57, P = 0,003) si dupa 280 de minute (0,2 vs 0,57). Aceasta superioritate timp dependenta a PCI primar comparativ cu tromboliza (cu trecerea timpului de la debutul simptomelor evenimentele cardiovasculare majore adverse cresc la tromboliza dar raman constante la PCI primar) a fost observata si in metaanaliza PCAT: 2635 pacienti cu prezentare peste 3 ore (registre MITRA si MIR). Deci "tarziu nu e prea tarziu probabil".
Motivul principal pentru care este de preferat PCI primar fata de tromboliza este prevenirea AVC-urilor. Metaanaliza a 23 trialuri a aratat ca PCI primar fata de tromboliza reduce AVC-ul (2 vs 1%). Conform metaanalizei PCAT, avantajul reducerii AVC cu PCI primar 0,7% in primele 2 ore, 1,2% ore intre 2-4 ore si 0,7% pentru cei prezentati intre 4 si 12 ore. Aceste date coincid cu datele studiului CAPTIM; 1% AVC (4 din 419) la cei cu tromboliza si 0% (0 din 421) la cei cu PCI primar. Metaanaliza trialulrilor cu transfer de pacienti arata o reducere cu 1,2% a AVC de la 1,88% la cei cu tromboliza la 0,64% la cei cu PCI primar. De aceea ratiunea de a prefera PCI primar pentru cei prezentati intre 3-1 2 ore de la debutul simptomelor este de a preveni AVC-urile. Recomandari PCI primar intre 3-12 ore: I C.
Trialurile PRAGUE 2 si DANAMI 2 arata si faptul ca PCI primar poate fi aplicat in zonele urbanizate al Europei cu bune rezultate. PCI primar in grupele de risc inalt cum sunt cei cu STEMI pare sa fie sigur si eficient si pentru spitale fara chirurgie cardiaca.
Evolutia clinica pacientilor transferati pentru PCI primar fata de tromboliza in spital
|
|
|
PRAGUE-1 |
PRAGUE-2 |
AIR- PAMI |
DANAMI-2 |
|
Perioda de inrolare |
|
|
|
|
|
|
Numar de pacienti |
|
|
|
|
|
|
Criterii de includere |
STEMI <6 h |
STEMI <6h inclusiv BRS |
STEMI <12 h |
STEMI de risc inalt <12 h, inclusiv BRS |
STEMI <12 h |
|
Pacientii Tromboliza/PCI |
|
|
|
|
|
|
Timpul de la debut pana la randomizare |
|
|
|
N/A |
|
|
Trombolitic |
ALTEPLAZE (+PA) |
STREPTOKINAZA |
STREPTOKINAZA |
STREPTOKINAZA 32% ALTEPLAZE 68% |
Alteplaze (+PA) |
|
Stent (%) |
|
|
|
|
|
|
Distanta de transfer |
25-50 km |
5 - 74 km |
5-120 km |
51-58 km Aer: 92 80 km |
50 (3-150 km) |
|
Timp de transport minim |
20 (max.30 |
|
|
|
|
|
Intarziere CPU-Randomizate |
|
|
|
|
Non PCI 90 PCI 63 |
|
End-point definit |
Deces Reinfarctizare |
Deces Reinfarctizare AVC |
Deces |
Deces Infarct nou fatal AVC major |
Deces Reinfarctizre AVC major |
|
Urmarire |
42 zile |
30 zile |
30 zile |
30 zile |
30 zile |
|
Rezultate end-point primar Tromboliza/ PCI |
|
|
|
|
|
|
End poin primar atins |
N/A Studiu pilot |
N/A fara putere statistica |
N/A terminat prematur |
N/A terminat prematur |
DA |
2.3.1.2. Stentarea de rutina in STEMI
Un trial a sugerat ca stentarea directa fara predilatare e asociata cu o reducere mai importanta a supradeni velarii ST. Exista 3 studii ce au documentat utilitatea stentului in STEMI: ZVOLE, STENT- PAMI, CADILLAC. Recomandari pentru stentare de rutina in STEMI: I A.
2.3.2. PCI facilitat
PCI facilitat e definit ca si interventia planificata in primele 12 ore de la debutul durerii toracice, imediat dupa medicatie antitrombotica sau fibrinolitica, pentru a diminua intarzierea pana la PCI. Oricum, termenul PCI facilitat nu e utililizat uniform: trebuie definit ca si PCI facilitat planificat imediat dupa initierea trombolizei sau dupa administrarea inhibitorilor IIb/IIIa. Astfel, in studiile randomizate care urmaresc conceptul de PCI facilitat toti pacientii cu sau fara pretratament trebuie sa efectueze PCI.
2.3.2.1. PCI facilitat de tromboliza
Aceasta a fost urmarita in subgrupuri mici din PRAGUE 1 si SPEED. Noile concepte privind administrarea unei jumatati de doza de trombolitic inainte de interventie au fost urmate de ameliorarea fluxului coronarian la intrarea la cateterism, dar nu au avut impact clinic (PACT). In BRAVE pacientii au fost randomizati la jumatate de doza de Reteplaza + Ambciximab sau Abciximab singur inainte de transfer pentru PCI si stent, dar in aceasta strategie nu a scazut dimensiunile infarctului. Desi conceptul de doza mica trombolitica + Clopidogrel si Abciximab e interesant, studiile dedicate PCI facilitat nu au aratat beneficiul, ba chiar dimpotriva efecte nedorite, negative. Mai multe date din studiile in curs ASENT 4 (TNK + PCI vs PCI + Inhibitori GP IIb/IIIa) si FINNESSE (Reteplaza + PCI vs Abciximab + PCI vs PCI nefacilitat) vor aduce date noi. In acest moment nu exista evidente pentru PCI facilitat.
2.3.2.2 PCI primar facilitat de inhibitori GP IIb/IIIa
In studiul ADMIRAL analiza subgrupului cu Abcixi mab in urgenta a aratat rezultate mai bune decat la administrarea mai tarzie a acestora. In studiul ONTIME subgrupul cu Tirofibam administrat prespital a fost comparat cu cel administrat in laboratorul de cateterism. La coronarografia de diagnostic s-a decelat flux TIMI 3 la 19% in primul grup si 15% in al doilea (nesemni ficativ). Nu s-au decelat efecte benefice angiografice sau clinice post PCI. Cu toate ca studiile pilot TIGER PA si BRIDGING au sugerat ca administrarea timpurie a Tirofibanului sau Abciximabului amelioreaza rezultatele PCI primar si o metaanaliza a 6 trialuri randomizate a aratat ca adminsitrarea rapida a inhibitorilor amelioreaza patenta coronariana cu efecte benefice asupra evolutiei clinice, nu exista evidente pentru recomandarea conceptului de PCI facilitat prin inhibitori IIb/IIIa.
2.3.3. PCI de salvare dupa tromboliza esuata
PCI de salvare se defineste ca interventia de salvare a unui coronare care ramane ocluzata in ciuda trombolizei. Esuarea trombolizei e suspicionata de persistenta durerii toracice si lipsa scaderii supradenivelarii ST la 45-60 minute de la inceputul adminsitrarii. Confirmarea e angiografica (lipsa patentei coronarei, leziune restanta semnificativa, flux TIMI <3). Studiul CLEVELAND clinic a investigat valoarea PCI de salvare dupa o tromboliza esuata. Pacientii au fost randomizati la aspirina, heparina si coronarodilatatoare (grupuri medicale) sau aceleasi terapii + PCI. Aparitia decesului sau a insuficientei cardiace a fost semnificativ redusa la grupul cu PCI (17 vs 6%). O metaanaliza din RESCUE 1 si 2 sugereaza beneficiul clinic al PCI de salvare. Pe de alta parte MERLIN nu aduce argumente pentru scaderea mortalitatii prin PCI la 30 de zile, dar scade marcant necesarul de revascularizatie. Cea mai mare limita a studiului MERLIN este ca nu are putere statistica. Studiul REACT terminat recent (cu pacienti fara rezolutie 50 % a supradenivelarii ST la 90 de minute dupa tromboliza) a aratat ca PCI e superior repetarii trombolizei sau tratamentului conservativ dupa tromboliza esuata. La 6 luni toate evenimentele clinice au fost reduse la jumatate in grupul cu PCI (deces 18 vs 9%). Comparat cu MERLIN, folosirea stenturilor si a inhibitorilor IIb /III a a fost mai frecventa, iar in REACT intarzierea pana la cateterism a fost mai mica. Ca si in cazul PCI primar, stentarea este superioara balonului singur in PCI de salvare. Recomandare PCI de salvare in PCI esuata: I b.
2.3.4. PCI de urgenta in socul cardiogen
Este o stare de hipoperfuzie tisulara caracterizata prin TA sub 90 mmHg, presiune capilara peste 20 mmH si index cardiac sub 1,8 l/minut/m2. PCI de urgenta sau CABG poate fi salvatoare si trebuie avuta rapid in vedere, Daca nici una nu este disponibila sau sunt intarziate, se va administra trombolitic. Femeile au mortalitate mai mare decat barbatii.
Doua trialuri randomizate (SHOCK si SMASH ) au evaluat reperfuzia coronariana la pacientii cu disfunctia VS consecutiv STEMI. PCI din soc are doua diferente fata de PCI din STEMI: intervalul de timp de 12 ore pana la efectuare PCI se alungeste si revascularizatia completa la multivascular trebuie avuta in vedere. Toate trialurile cu PCI primar s-au oprit la revascularizatia leziunii responsabile. Numai in socul cardiogen exista consensul de efectuare a PCI pe toate leziunile coronariene. E recomandata utilizarea balonului de contrapulsa tie aortica. Daca boala multivasculara nu poate fi abordata prin revascularizatie completa interventionala trebuie avutain vedere chirurgia.
In Benchmark Counterpulsation Outcomes Registry (25136 pacienti), mortalitatea intraspitaliceasca a fost mai mare la pacientii care au primit doar tratament medicamentos (32,5%) comparativ cu cei carora li s-a efectuat PCI (18,8%) si interventie chirurgicala (19,2%)[i]. Trebuie retinut ca pacientii cu soc cardiogen si NSTEMI au o mortalitate intraspitaliceasca similara celor cu soc cardiogen si STEMI.[ii] Mortalitatea intraspi taliceasca la pacientii cu infarct miocardic acut complicat cu soc cardiogen ramane crescuta, chiar si in cazul efectuarii precoce a angioplastiei[iii]. Intre pacientii a caror varsta depaseste 75 de ani, cu infarct miocardic complicat cu soc cardiogen, rezultatele pot fi imbunatatite in cazul efectuarii angioplastiei precoce. In cadrul acestei populatii, 56% au supravietuit si au fost exter nati, dintre care 75% au fost in viata la un an[iv]. In cursul ultimilor ani, se observa un numar crescut de revascu larizari pentru infarct miocardic complicat cu soc cardio gen, probabil datorat internarilor in spitale dotate cu laborator de cateterism[v] (Recomandarea pt PCI de urgenta la pacienti cu soc cardiogen: IC ).
2.3.5. Angiografia de rutina precoce post tromboliza
Studiul ALKK[vi] a randomizat 300 de pacienti (initial fiind planuiti 800 pacienti) pentru un tratament medicamentos sau interventional. Inainte de randomizare, 63% din grupul de tratament invaziv si 57% din grupul medicamentos au primit tratament trombolitic. Angioplastia a fost efectuata in medie la 24 de zile dupa STEMI. Supravietuirea fara evenimente la un an a aratat o tendinta in favoarea angioplastiei (90% vs 82%). Dife renta s-a datorat in mare diferentei in necesarul de (re)interventie (5,4% vs 13,2%, p = 0,03). O analiza multistratificata al pacientilor inclusi in ASSENT-2 a aratat o mortalitate mai scazuta in tarile cu cele mai mari rate de angioplastie posttromboliza[vii]. O metaanaliza incluzand 20101 pacienti din studiile TIMI 4, 9 si 10B si studiile InTIME-II a aratat ca angioplastia in cursul spitalizarii a fost asociata cu o rata mai mica de infarct miocardic recurent intraspitalicesc (4,5% vs 1,6%, p <0,001) si o mortaliate la 2 ani mai mica (11,6 vs 5,6%, p <0,001)[viii]. Un studiu prospectiv de cohorta din registrul national danez al cauzei de moarte a subli niat utilizarea unei abordari invazive precoce dupa un infarct miocardic acut[ix] In GUSTO-I, rata cateterizarii cardiace si a revascularizatiei in timpul spitalizarii a fost de doua ori mai mare la pacientii din spitalele de pe teritoriul SUA decat cei de pe teritoriul Canadei[x]. Mortalitatea la 5 ani a fost de 19,6% la pacientii americani si de 21,4% la pacientii canadieni (p = 0,02). Astfel, un mod de abordare mai conservativ a avut un efect detrimental pe termen lung comparativ cu abordarea invaziva.
Patru studii randomizate au contribuit la recoman darea coronarografiei de rutina si daca e aplicabil angioplastia precoce posttromboliza: SIAM III[xi], GRACIA-1[xii], CAPITAL-AMI[xiii] si LPLS[xiv] (Leipzig Prehospital Lysis Study). Detaliile acestor patru studii sunt listate in Tabelul 6.
Astfel SIAM III, GRACIA-1 si CAPITAL-AMI impreuna cu studiul ALKK, analiza ASSENT-2, metaanaliza studiilor TIMI 4, 9 si 10B si InTIME-II precum si GUSTO-I au contribuit la solutionarea unei probleme vechi dar pivotale: incidenta reinfarctizarii, "calcaiul lui Ahile" al trombolizei. Astfel, tromboliza, chiar si daca este cu succes, nu ar trebui considerat ca si tratament final: "lizeaza acum, stenteaza mai tarziu"[xv]. (recoman darea angiografiei de rutina si angioplastiei, daca e aplicabila, la pacientii dupa tromboliza reusita: IA
2.3.6. Angioplastia posttromboliza ghidata de ischemie
Studiul DANAMI-1[xvi] a fost primul si singurul studiu randomizat prospectiv ce a comparat o strategie invaziva de angioplastie/CABG cu o strategie conservativa la pacienti cu ischemie inductibila la testele de stress preexternare dupa un prim episod de infarct miocardic trombolizat. Frecventa endpointurilor primare (mortalitate, reinfarctizare si internare pt angor instabil) a fost semnificativ redusa cu 15,4% vs 29,5% la un an, 23,5% vs 36,6% la 2 ani si 31,7% vs 44% la 4 ani. Astfel, pacientii care au primit tratament trombolitic dupa un prim episod de infarct miocardic si au ischemie inductibila ar trebui evaluati coronarografic si revascularizati, independent de tratamentul medicamentos maximal. (Recomandarea angioplastiei ghidata de prezenta ischemiei dupa tratament trombolitic reusit: IB).
2.3.7. Angioplastia in cazul pacientilor ce nu au primit tratament de reperfuzie in primele 12 ore
Pacientii deseori se prezinta tardiv dupa un episod de infarct miocardic si fie nu primesc tratament de reperfuzie la prezentare fie acest tratament esueaza in a recanaliza cu succes artera responsabila de infarct. Terapia de reperfuzie tardiva este definita ca tromboliza sau angioplastie efectuata dupa 12 ore de la debutul simptomelor (pentru angioplastia tardiva in soc cardiogen vezi sectiunea 2.3.4.). Terapia trombolitica pentru tratamentul tardiv al pacientilor cu STEMI nu reduce marimea infarctului si nici nu prezerva functia ventriculara, probabil datorat ineficientei acestei terapii de a restabili patenta arterei[xvii]
Interpretarea atenta a PCAT, PRAGUE-2 si CAPTIM ar putea indica un posibil efect benefic al angioplastiei tardive. Acesta, insa este in contradictie cu studiul TOAT[xviii], unde angioplastia tardiva a avut un efect advers pe remodelarea ventriculara. In DECOPI[xix], 212 pacienti cu un prim episod de infarct miocardic cu unda Q si un vas coronar ocluzat au fost randomizati la angioplastie, efectuata in 2-15 zile dupa debutul simptomelor sau la tratament medicamentos. Endpointul primar a fost indicele compozit de mortalitate cardiaca, infarct miocardic nonfatal sau tahiaritmii ventriculare. Desi la 6 luni, fractia de ejectie a ventriculului stang a fost semnificativ mai mare (5%) in grupul tratat invaziv comparativ cu cel tratat medicamentos si un numar semnificativ de pacienti au avut o artera patenta (82,8% vs 34,2%) la timp de urmarire in medie de 34 luni, frecventa endpointului primar a fost similar in ambele grupe (8,7% vs 7,3%). Pentru ca recrutarea pacientilor si rata evenimentelor a fost mai mica decat a fost planuit, studiul nu a avut putere stasistica. Astfel, desi "ipoteza arterei deschise tardiv" pare atragatoare[xx],va trebui sa asteptam rezultatele studiului OAT. Actualmente, nu exista un consens privind recomandarea la acest grup de pacienti.
Tabelul
6. Evolutia clinica si dimensiunea
infarctului la pacientii cu coronarografie si daca a fost
posibil PCI
post trombolica comparativ cu tromboliza izolata si o strategie
invaziva ghidata de ischemie.
|
|
SIAM III |
GRACIA 1 |
CAPITAL -AMI |
LPLS |
|
Numar de pacienti |
|
|
|
|
|
Criterii de includere |
STEMI la mai putin de 12 h |
STEMI la mai putin de 12 h |
STEMI la mai putin de 6 h |
STEMI la mai putin de 4 h |
|
Tromboliza |
intraspitaliceasca |
Intraspitaliceasca |
Intraspitaliceasca |
Prespitaliceasca |
|
Trombolitic |
Reteplaza, doza intreaga |
Alteplaza, doza accelerata |
Tenecteplaza, doza intreaga |
Reteplaza, jumatate de doza si Abciximab |
|
Intervalul de timp tromboliza-coronarografie in grupul cu terapie PCI |
<6 h |
<24 h |
Imediata |
Imediata |
|
End-point primar |
Combinatie de: moarte, reinfarct, evenimente ischemice, TLR |
Combinatie de: moarte, reinfarct, TLR |
Combinatie de: moarte, reinfarct,, ischemie recurenta, stroke |
Dimensiunile infarctului determinat prin RMN |
|
Durata studiului |
6 luni |
12 luni |
30 zile |
6 luni |
|
Rezultatea end-pointului primar |
50,6/25,6 %a |
21/9 %a |
21,4/9,3%a |
11,6/6,7%a |
|
End-point primar indeplinit |
Da |
Da |
Da |
Da |
|
Toate trialurile si-au atins and-pointul si-au atins end-point primar P <0,05 TLR = target lesion revascularization (revascularizarea leziunilor tinta) |
||||
Tabelul 7. Recomandari pentru PCI in STEMI
(a) Proceduri |
Indicatie |
Doza de recomandare si nivel de evidenta |
Studii randomizate pentru nivelele A si B |
|
PCI primar |
Pac. la mai putin de 12 h de la instalarea durerii toracice /alte simptome si preferabil la mai putin de 90 min de la contactul cu personal medical calificat; PCI efectuat de o echipa experimentata |
IA |
PAMI GUSTO IIb C-PORT PRAGUE 1 si 2 DANAMI -2 |
|
Stentare primara |
Stentare de rutina in timpul PCI primar |
IA |
Zwolle Stent -PAMI CADILLAC |
|
PCI primar |
Cand tromboliza e contraindicata |
IC |
|
|
PCI primar |
Folosita in dauna trombolizei la pacientii prezentati cu durere toracica/alte simptome >3h si <12h |
IC |
|
|
PCI de salvare |
Daca tromboliza a esuat in mai putin de 60 min de la inceputul administrarii acesteia |
IB |
REACT |
|
PCI de urgenta (boala coronariana multivasculara) |
Soc cardiogen in asociere cu balon de contrapulsatie aortic mentinut 12-36h |
IC |
|
|
Coronarografie de rutina, PCI (daca a fost posibil) post tromboliza |
Pana la 12 h posttromboliza independent de aparitia anginei si/sau ischemiei |
IA |
SIAM III GRACIA-1 CAPITAL -AMI |
|
PCI de necesitate dupa tromboliza reusita |
Angina si /sau ischemie inainte de externare dupa primul STEMI trombolizat |
IB |
DANAMI-1 |
2.3.8. Reducerea intarzierilor
Pentru toate formele de PCI in STEMI este postulat ca trebuie realizata reducerea cat mai mult cu putinta a intarzierilor dintre instalarea simptomatologiei si initierea reperfuziei eficiente si sigure la pacientii cu STEMI. scurtarea timpului ischemiei totale este primordiala nu numai pentru terapia trombolitica ci si pentru PCI primar (Figura 3). Minimalizarea timpului de prezentare al pacientului si de aplicare al tratamentului inbunatateste semnificativ rezultatul clinic, in timp ce timpul prelungit simptom + tratament este corelat cu deficit de perfuzie miocardica independent de fluxul miocardic. Efortul incepe cu educarea pacientului si cuprinde imbunatatiri in organizarea serviciului de ambulanta ca si optimizarea procedurilor spitalicesti sau private (Figura 3). Pana la luarea deciziei de efectuare a PCI trebuie facute eforturi pentru a mentine timpul mediu de la prezentarea pacientului si pana la efectuarea PCI sub 90 de minute. Suntarea camerei de urgenta si transferul direct al pacientilor la laboratorul de cateterism reduce timpul afectat. Oricum, pacientii care se prezinta la mai mult de 3 ore de la debutul simptomatologiei trebuie tratati cu PCI primar. Numai daca se intarzie substantial (mai mult de 2-3 ore) in initerea PCI primar atunci terapia de reoperfuzie cu trombolitice de generatia II-III trebuie avuta in vedere.
In concluzie, PCI primar ar trebui sa fie tratamentul de alegere la pacientii cu STEMI intr-un spital cu facilitati de efectuare a PCI si cu o echipa experimentala de interventionosti. Pacientii cu contraindicatii la tromboliza ar trebui imediat transferati pentru PCI primar, deoarece aceasta ar putea fi singura lor sansa pentru revascularizarea rapida coronariana.
In socul cardiogen PCI de urgenta pentru revascularizarea completa poate fi vital si ar trebui efectuat cat mai rapid. Comparativ cu tromboliza, trialurile randomizate care au transferat pacientii pentru PCI primar la un centru de specialitate au avut un rezultat mai bun in ciuda intarzierii datorate transportului . Superioritatea PCI primar in comparatie cu tromboliza este evidenta in special daca aceasta dintai se efectueaza in primele 3-12 ore de la paritia simptomatologiei, datorita unei mai bune miocardice. Mai mult, cresterea timpului de prezentare duce, in cazul trombolizei, la cresterea efectelor majore cardiovasculare, pe cand in cazul PCI acestea raman aproximativ constante.
In primele 3 ore de la instalarea simptomatologiei ambele alternative de revascularizare par a fi la fel de eficiente in reducerea dimensiunii infarctuluin si a mortalitatii. Astfel, tromboliza este inca o alternativa viabila a PCI daca se instituie in primele 3 ore de la aparitia simptomatologiei. PCI primar comparativ cu tromboliza reduce semnificativ incidenta AVC-urilor. In cele din urma, preferam PCI primar in dauna trombolizei in primele 3 ore de la debutul simptomatologiei pentru prevenirea AVC-urilor, iar la pacientii prezentati la 3-12 ore pentru salvarea miocardului si deasemenea pentru prevenirea AVC-urilor. La acest moment nu sunt dovezi pentru sustinerea PCI facilitat.
PCI de salvare este recomandat daca tromboliza esueaza in primele 45-60 de minute de la inceperea ei. Dupa o tromboliza reusita se recomanda efectuarea coronarografiei si a PCI in primele 24 de ore chiar daca pacientul este asimptomatic si nu are ischemie inductibila. Daca nu exista posibilitatea efectuarii PCI in primele 24 de ore la pacientii trombolizati si cu ischemie spontana sau inductibila, inaintea externarii acestia ar trebui indreptati catre un centru de cateterism cardiac.
Figura 3. Posibile cauze de intarziere a efectuarii PCI la pacientii cu STEMI. Solutii pentru a evita aceasta, care include organizarea serviciilor de ambulanta si optimizarea serviciilor de ambulanta si optimizarea serviciilor spitalicesti pentru minimalizarea timpului de la debutul simptomatologiei si apelarea serviciului de urgenta.
Problema
Solutie
(timp de la
aparitia simptomatologiei si apelul de urgenta)
Intarzierea pacientului
Educatia
pacientului
![]()
(timp de la apelul de urgenta la contactul cu
pacientul) Organizarea paramedicilor
![]()
(a) Intarzierea
transportului
![]()
![]()
-timp "usa-ac" (primul contact cu pacientul - ac) -timp "usa-balon" (primul contact
medical-balon
Intarzierea tratamentului
Organizarea spitalului de stat sau particular
![]()
3. Terapia adjuvanta in PCI
Este recomandat un pretratament cu bolus intracoronarian de nitroglicerina pentru a demasca vasospasmul, pentru a evalua dimensiunea reala a vasului, si pentru a reduce riscul reactiilor vasospastice in timpul procedurii. Bolusul poate fi repetat in timpul si la sfarsitul procedurii, in functie de presiunea arteriala. In rarele cazuri de spasm rezistent la NTG, verapamilul este o alternativa utila. In ceea ce priveste restabilirea lenta, sau lipsa de restabilire a fluxului, multe studii au investigat administarea intracoronariana a verapamilului si a adenozinei in doze variate. Donorul direct de NO, nitroprusiatul, pare sa fie, de asemenea, un tratament sigur si eficace pentru curgerea incetinita sau lipsa curgerii, asociata cu interventiile percutane. In plus, balonul de contrapulsatie poate fi util. Asocierea adenozinei cu nitroprusiatul a asigurat o imbunatatire mai semnificativa a fluxului coronarian, decat cea obtinuta doar cu adenozina.
3.1. Acidul acetil-salicilic (ASA)
Inca de la inceputurile cardiologiei interventionale, medicamentele antiplachetare au reprezentat o piatra de temelie a medicatiei adjuvante, deoarece leziunea endoteliala si a straturilor mai profunde ale peretelui vascular indusa de PCI are drept rezultat, in general, activarea plachetara. Farmacologia si aplicabilitatea clinica generala a agentilor antiplachetari la pacientii cu boala cardiovasculara aterosclerotica au fost recent elaborate intr-un ghid al ESC (ESC Consensus Document). Ghidurile PCI adreseaza indicatiile lor mai specific pentru plasarea unui stent.
3.1.1. ASA in angina stabila (acidul acetilsalicilic)
In metaanaliza elaborata de Antithrombotic Trialist Collaboration, ASA a redus mortalitatea de cauza vasculara, IM sau AVC printre pacientii cu risc inalt pentru evenimentele vasculare, la 22% comparativ cu placebo.
M-HEART II a fost singurul studiu PCI placebo controlat, cu ASA ca medicatie unica, aratand o imbunatatire semnificativa din punct de vedere al rezultatului, comparativ cu placebo. Rata IM a fost semnificativ redusa prin utilizarea ASA, de la 5,7% la 1,2%. In prezent, ASA continua sa joace un rol important in reducerea complicatiilor ischemice puse pe seama interventiilor coronariene percutanate. Daca pacientii nu sunt premedicati cronic sau in cazul in care exista o indoiala in ceea ce priveste complianta pacientului la tratament, o doza de incarcare de 500 mg orala ar trebui administrata cu cel putin 3 ore inainte sau minimum 300 mg. i.v. inainte de procedura. Acest lucru ar trebui omis doar in cazul pacientilor cu alergie cunoscuta la ASA. Dupa cum s-a evidentiat in ghidurile ESC pentru utilizarea cronica, nu sunt necesare doze mai mari de 100 mg zilnic.
3.1.2. ASA in NSTE-ACS
Metaanaliza realizata de Antithrombotic Trialists Collaboration a aratat o reducere de 46% a mortii de cauza vasculara, IM sau AVC (de la 13,3% la 8%). Desi aceste studii au fost realizate inainte de utilizarea larga de PCI, ele au condus la recomandarea utilizarii universale a ASA ca o terapie standard in NSTE-ACS, cu sau fara PCI.
3.1.3. ASA in STE-ACS
ASA si-a dovedit eficacitatea comparativ cu placebo in trialul ISIS-2, aratand ca ASA este aproape la fel de eficace ca si utilizarea streptokinazei. Administrarea ambelor droguri a avut efect aditiv. In ciuda limitarilor si efectelor adverse, ASA ar trebui administrata tuturor pacientilor cu STEMI (daca este justificabil din punct de vedere clinic) cat mai repede posibil dupa ce diagnosticul este stabilit.
Recent, a aparut problema rezistentei la aspirina. Oricum, mai multe studii prospective sunt necesare pentru a corela lipsa de raspuns la ASA cu evenimentele clinice adverse.
3.2. Ticlopidina si Clopidogrelul
3.2.1. Tienopiridinele in angina stabila
Ticlopidina si Clopidogrelul sunt medicamente antiagregante plachetare potente. Exista unele evidente nu prea convingatoare ca, pentru o reducere a trombozei acute sau subacute de stent, ce urmeaza interventiilor coronariene percutanate cu implantare de stent, terapia combinata cu tienopiridine si ASA, este superioara ASA in terapie unica sau ASA plus anticoagulant oral. (Milan /Tokio, ISAR, STARS, FANTASTIC si MATTIS). Conform a 3 studii controlate randomizate (CLASSICS, TOPPS, Bad Krozingen) si a mai multor metaanalize, Clopidogrelul pare sa fie cel putin la fel de eficient ca si Ticlopidina. Comparativ cu Ticlopidina, Clopidogrelul are mai putine efecte adverse, si este mai bine tolerat (recomandarea utilizarii pentru 3-4 saptamani a Ticlopidinei sau Clopidogrelului in asociere cu ASA dupa implantarea stenturilor metalice simple in angina stabila:
I A).
In prezent, deoarece marea majoritate a procedurilor PCI se termina in general prin implantarea unui stent, pentru fiecare pacient progamat pentru PCI ar trebui luata in considerare premedicatia cu Clopidogrel, indiferent daca exista sau nu intentia de a implanta un stent.
O premedicatie cu 300 mg in 2,5 ore, poate fi, oricum, insuficienta. Pentru a asigura activitate antiplachetara completa, premedicatia cu Clopidogrel ar trebui initiata cu cel putin 6 ore inainte de procedura, cu o doza de incarcare de 300 mg, ideal administrata in ziua precedenta PCI (CREDO Trial and Target Analysis). Daca acest lucru nu este posibil, o doza de incarcare de 600 mg, ar trebui administrata cu cel putin 2 ore inainte de procedura. (Pentru acesta atitudine exista date randomizate, publicate doar partial Studiul Armyda 2).
Daca angiografia diagnostica este negativa sau in cazul in care nu s-a realizat stentare sau daca interventia chirurgicala cardiaca este necesara, Clopidogrelul poate fi intrerupt. Pacientii care nu pot fi premedicati cu Clopidogrel ar trebui sa primeasca doza de incarcare (posibil mai mare) imediat dupa procedura. (Reco mandare pentru premedicatie cu 300 mg. Clopidogrel cu cel putin 6 ore inainte de PCI: I C).
Dupa stentare, nu este necesar sa se recomande tratament prelungit (peste 4 saptamani) pacientilor cu angina stabila, exceptand cazurile in care se efectueaza brahiterapie sau dupa implantare de stenturi farmacologic active (Recomandare pentru administrarea Clopidogrelului dupa brahiterapie pentru 12 luni sau dupa stenturi cu eliberare medicamentoasa pentru 6-12 luni: I C).
3.2.2. Clopidogrelul in NSTE-ACS
Timpul optim pentru initierea terapiei cu clopidogrel la pacientii cu NSTE-ACS este un subiect de discutie: pe de o parte trialul CURE a aratat ca frecventa evenimentelor adverse a fost semnificativ redusa in prima ora de la intrarea in studiu; pe de alta parte la pacientii programati pentru chirurgie cardiaca pe timpul terapiei cu clopidogrel, pierderea de sange perioperatorie sau in timpul interventiei chirurgicale reprezinta un motiv de ingrijorare.
In studiul CURE nu a aparut un numar semnificativ mai mare de episoade de sangerare majora dupa chirurgia cardiaca CABG (1,3 fata de 1,1%).
La pacientii care nu au oprit medicatia (necesara pentru studiu) cu pana la 5 zile inainte de studiu, rata sangerarilor majore a fost mai mare in studiul care utiliza clopidogrelul (9,6 fata de 6,3%).
In general, beneficiile initierii utilizarii de clopidogrel la internare, par sa depaseasca riscurile chiar si printre pacientii carora li se va efectua interventie chirurgicala CABG in timpul spitalizarii initiale.
In mai multe cazuri, este necesara administrarea de masa trombocitara.
O crestere clara a riscului sangerarii a aparut cand doza de ASA a fost crescuta de la 100 la 100-200 mg sau mai mare sau egal de 200 mg la pacientii tratati fie cu ASA in terapie unica, fie cu ASA + Clopidogrel. (3,0; 3,4; 4,9%).
Datele disponibile sugereaza ca la pacientii tratati pentru NSTE-ACS o doza zilnica de ASA de 75-100 mg poate fi optima.
Conform ghidurilor ACC/AHA pentru managementul pacientilor cu NSTE-ACS, in multe spitale in care pacientilor cu angina instabila sau NSTEMI li se efectueaza cateterizare diagnostica in primele 24-36 de ore de la internare, terapia cu Clopidogrel ar trebui initiata doar atunci cand este sigur ca chirurgia cardiaca CABG nu va fi programata pentru urmatoarele zile.
Preferinta actuala pentru o strategie invaziva rapida, combinata cu stentare si inhibitori GP IIb/IIIa scade probabilitatea interventiei chirurgicale de bypass pentru majoritatea acestor pacienti cu risc crescut.
Datorita efectului favorabil instalat foarte rapid al Clopidogrelului, se recomanda astfel, initierea administarii Clopidogrelului cat mai repede posibil, daca este justificabil din punct de vedere clinic. (Recomandarea pentru administrarea imediata a Clopidogrelului in NSTE-ACS: I B)
Dupa faza acuta a NSTE-ACS, continuarea tratamen tului cu ASA + Clopidogrel peste 9-12 luni este benefica (CURE, PCI-CURE). (Recomandarea pentru administare prelungita de Clopidogrel pentru 9-12 luni dupa NSTE-ACS: I B).
3.2.3. Clopidogrelul in STE-ACS (STEMI)
Desi nu exista studii-PCI, CHARITY (doza de incarcare 300 mg) si COMMIT/CCS-2 (fara doza de incarcare) au aratat ca asocierea ASA + Clopidogrel a fost mai eficienta in STEMI decat ASA in terapie unica. La pacientii cu STEMI la care se efectueaza PCI initial si stentare, Clopidogrelul va fi administrat suplimentar, preferabil cu o doza de incarcare de 600 mg.
In ceea ce priveste durata administarii Clopidogrelului, rezultatele aplicate pentru NSTE-ACS pot fi extrapolate pentru STE-ACS, dar acest lucru nu are deocamdata dovada stiintifica.
Cateva date de laborator initiale avertizeaza cu privire la combinarea Clopidogrelului cu statine metabolizate in ficat, in special atorvastatina, dar nu pare sa joace un rol clinic. Intrebarea cu privire la posibila rezistenta la Clopidogrel necesita deocamdata mai multe investigatii.
In concluzie, terapia dubla antiplachetara cu ASA si Clopidogrel este standard pentru pre-tratamentul pacientilor cu sindrom coronarian acut (angina) stabila premergatoare PCI-cu sau fara implantare de stent progamata. Dupa implantarea unui stent metalic simplu, Clopidogrelul trebuie continuat pentru 3-4 saptamani si ASA nelimitat. Pentru pacientii care se prezinta cu NSTE-ACS, ASA si, daca este justificabil clinic, administrarea imediata a Clopidogrelului reprezinta regimul antiplachetar standard primar.
Dupa faza acuta, continuarea cu 100 mg/zi ASA + 75 mg/zi Clopidogrel peste 9-12 luni este benefica. ASA ar trebui administrat i.v tuturor pacientilor cu STEMI, cat mai curand posibil dupa ce diagnosticul este stabilit daca este justificabil clinic.
Cu conceptul de PCI primar si stenting primar in STEMI, Clopidogrelul ar putea fi administrat suplimentar la acesti pacienti. Dupa brahiterapie, Clopidogrelul ar trebui administrat impreuna cu ASA pentru 12 luni si dupa implantarea de stent cu eliberare medicamentoasa pentru 6-12 luni, pentru a evita tromboza vasculara tardiva.
3.3. Heparina nefractionata (UFH)
3.3.1. Heparina nefractionata pentru PCI in angina stabila
Inca de la inceputul utilizarii PCI, heparina nefractionata (UFH) a fost folosita pentru a preveni tromboza la nivelul materialului folosit si pentru a minimiza formarea trombului la nivelul injuriri iatrogenice a peretelui vascular sau a placii rupte. Nu exista trialuri placebo-controlate evidente cu privire la PCI care sa arate faptul ca lipsa anticoagularii ar fi prohibitiva pentru efectuarea interventiile coronariene.
UFH este administrat in bolus iv, fie sub controlul ACT (activated clotting time), fie in functie de greutatea corporala (de obicei 100 UI/kg sau 50-60 UI /kg daca se administreaza inhibitori de GP IIb/IIIa)
Datorita variabilitatii marcate in biodisponibilitatea UFH, dozarea conform ACT este indicata, in special, pentru procedurile prelungite, cand bolusuri suplimentare de UFH ar putea fi necesare. Raspunsul terapeutic la UFH este, in general, greu de prezis. Exista evidente ca beneficiul sau este legat de o doza efectiva, desi dozele reduse (5000 u.i sau mai putin) sunt folosite in procedurile de rutina. Heparinizarea continua post-procedurala, fie inainte fie dupa indepartarea tecii arteriale, nu este recomandata.
3.3.2. UFH pentru PCI in NSTE-ACS
Adaugarea UFH ca si regim standard este de obicei recomandata pe baza unei metaanalize a 6 trialuri randomizate mai restranse, aratand o rata a mortii/ infarct miocardic de 7,9% la pacientii cu Angina Instabila tratati cu ASA + Heparina, comparativ cu o rata de 10,3% la cei tratati doar cu ASA. Intreruperea UFH la pacientii cu Angina Instabila se asociaza cu riscul inerent al unui efect de rebound.
3.3.3. UFH pentru PCI in STEMI
UFH este o terapie standard la pacientii cu STEMI, in special pentru cei la care se efectueaza PCI de prima intentie. UFH a fost folosit ca si control pentru numeroase studii care au investigat LMWH sau Bivalirudina.
3.4.
Heparinele cu greutate
moleculara mica (LMWH)
Atat UFH cat si LMWH actioneaza prin legarea de antitombina III, accelerand astfel inhibitia trombinei de catre Antitrombina III. UFH implica, totusi, mai multe dezavantaje: datorita legarii sale stranse de proteinele plasmatice, efectele sale antitrombotice sunt variabile, conducand la niveluri non-predictibile de heparina libera. Desi UFH-ul inhiba in egala masura atat Factorul Xa cat si trombina, LMWH inhiba predominant, si mai puternic, factorul Xa. Datorita nivelurilor plasmatice mai mari, LMWH sunt considerate a fi anticoagulante mai predictibile, nefiind necesara o monitorizare de laborator.
3.4.1. LMWH pentru PCI in Angina Stabila
Datele cu privire la LMWH, ca si anticoagulant unic, in timpul PCI, la pacientii cu Angina Stabila sunt limitate. Pentru siguranta, se sugereaza ca UFH-ul sa fie adaugat la pacientii pretratati cu LMWH, in conformitate cu intervalul de timp de la ultima doza de LMWH.
3.4.2. LMWH pentru PCI in NSTE-ACS
Rezultatele clinice care au comparat LMWH cu UFH, au fost investigate in 4 trialuri majore, care impreuna au cuprins randomizat un numar de 12.048 de pacienti,cu NSTE-ACS. Aceste 4 studii au fost cuprinse in extenso in guidelines-urile ESC-NSTE-ACS, precum si in alte articole. Este important de evidentiat, totusi, ca aceste trialuri nu se aplica interventiilor coronariene, PCI-ul fiind fie exclus (Dalteparina, FRIC), fie nerecomandat in primele 24 ore (Enoxaparina, TIMI-11 b) sau lasat la alegerea medicului (Enoxaparina, ESSENCE si Nadroparina, FRAXIS).
Dalteparina s-a dovedit superioara UFH la pacientii instabili (FRISC-II). Totusi, acest avantaj a fost demonstrat doar in cazul procedeelor non-invazive; la pacientii cu revascularizatie precoce, dalteparina nu s-a mai dovedit a fi superioara. Studiile ESSENCE si TIMI-11B au demnonstrat o superioritate a Enoxaparinei fata de UFH intr-o stategie predominant conservativa la pacientii cu risc crescut de NSTE-ACS, cu pretul unei cresteri semnificative a sangerarilor minore. In trialul SYNERGY, 9978 pacienti cu NSTE-ACS au urmat tratament randomizat, fie cu UFH, fie cu Enoxaparina (ASA) asociat unei strategii interventionale precoce. Criteriile de includere (risc inalt) au fost simptome ale ischemiei care durau cel putin 10 minute aparute in intervalul de 24 de ore dinaintea includerii in studiu, plus cel putin 2 din urmatoarele: varsta >= 60 ani, cresterea nivelurilor de troponina sau CK peste limita superioara a normalului sau modificari ale segm ST pe EKG. Dupa 30 de zile riscul combinat (the combined end-point) de moarte/ MI a fost de 14,5 % versus 14,0%. Hemoragiile majore (criteriile TIMI) au fost, totusi, crescute semnificativ de catre enoxaparina (7,6 versus 9,1%). Aceste rezultate sunt in conformitate cu trialul A la Z, in care pacientii cu NSTE-ACS si strategie early invasive care primeau ASA si tirofiban nu au avut nici un beneficiu clinic prin utilizarea Enoxaparinei versus UFH, dar rata hemoragiilor a fost semnificativ crescuta in grupurile PCI tratati cu enoxaparina (4,4 versus 2,2%).
Inlocuirea UFH cu LMWH sau viceversa ar trebui evitata in general.
Daca LMWH a fost administrat inainte de PCI, administrarea suplimentara a unei terapii anticoagulante depinde de intervalul de timp de la ultima doza de LMWH.
Combinand rezultatele studiilor ESSENCE, TIMI-11B, SYNERGY si A la Z, UFH este de preferat la pacientii cu risc crescut de NSTE-ACS care au programate strategii invazive. Mai mult, cu toate ca enoxaparina poate fi administrata inainte de PCI in NSTE-ACS, TASK-FORCE recomanda UFH datorita reversibilitatii sale mai usoare prin administrarea protaminei. Nu exista nici o dovada clara ca Enoxaparina poate fi folosita in siguranta in salile de cateterism, dar aceasta posibilitate este investigata in prezent.
Daca o strategie invaziva nu poate fi aplicata din diverse motive la un pacient cu risc crescut NSTE-ACS, Enoxaparina ar fi de preferat pentru reducerea complicatiilor ischemice.
3.4.3. LMWH pentru PCI in STE-ACS (STEMI)
Au existat cateva trialuri angiografice care au investigat LMWH in STEMI. Trialul HART II a demonstrat o imbunatatire a eficacitatii in cazul administrarii imediate a enoxaparinei sub controlul APT, comparativ cu utilizarea UFH, in obtinerea unui vas patent post-IM (flux TIMI-2 si -3) la 90 minute de la inceperea tratamentului. Pacientii din grupul Enoxaparina au avut o rata a reocluziei semnificativ mai mica in zilele 5-7 fara o crestere a hemoragiilor majore. La pacientii cu doza completa de TNK (tenecteplase) si doza redusa la jumatate de TNK + abciximab, Enoxaparina este asociata cu rata de flux TIMI 3 similara cu UFH. (ENTIRE - TIMI -23 Trial). Studiul PENTALYSE a investigat eficacitatea si siguranta administrarii de Fondaparinux la pacientii cu STEMI in curs. La pacientii la care se efectueaza angiografie coronariana la 90 de minute si in zilele 5-7 de la prezentare, ratele de flux TIMI 3 la 90 de minute au fost similare. Pana in momentul furnizarii mai multor date din studiile pivot, nu se poate sustine administrarea preferentiala a LMWH fata de UFH pentru PCI in STEMI.
In concluzie, UFH se administreaza in bolus iv sub control ACT. Datorita avantajelor farmacologice, LMWH sunt considerate a fi anticoagulante mai predictibile nefiind necesara monitorizarea de laborator. Totusi, datele care privesc administrarea de LMWH ca unic anticoagulant in timpul PCI cu angina stabila sunt limitate. Administrarea de UFH este de preferat la pacientii cu risc crescut de NSTE-ACS care au programate strategii invazive si la pacientii cu risc mai redus care au programate strategii conservative. Daca la pacientii cu risc crescut NSTE-ACS, o strategie invaziva nu poate fi aplicata din diverse motive, Enoxaparina ar putea fi de preferat, luand in cosiderare o posibila crestere hemoragiile minore.
La pacientii cu STEMI la care se utilizeaza PCI de prima intentie, UFH este terapia standard.
3.5. Inhibitorii glicoproteinei IIb/IIIa
Inhibitorii Gp IIib/IIIA sunt cei mai puternici antiagreganti care blocheaza receptorul fibrinogenului.
3.5.1. Inhibitorii Gp IIb/IIIa pentru PCI in angina stabila
Studiul ISAR-REACT a administrat randomizat abciximab sau placebo la pacientii cu risc scazut de CAD, cu excluderea ACS, diabeticilor insulino-dependenti sau a pacientilor cu trombi vizibili. Abciximab-ul nu a atins endpoint-ul primar la pacientii cu risc scazut la care se efectueaza de electie stentare coronariana.
Desi analiza retrospectiva a EPISTENT diabetics substudy, care cuprindea atat pacienti cu angina stabila cat si cu angina instabila, a sugerat un beneficiu prognostic a abciximabului in grupul pacientilor la care s-a implantat stent, studiul prospectiv ISAR-SWEET la pacientii cu angina stabila excluzand pacientii cu sindroame coronariene acute sau/si cu tromb vizibil, nu a putut sustine acest concept.
Datorita riscului scazut per total al PCI la pacientii cu angina stabila, a potentialului inhihitorilor de receptori Gp IIb/IIIa de a creste riscul complicatiilor hemoragice si costul considerabil pentru utilizarea lor, ei nu reprezinta o parte a medicatiei standard periprocedurala. In ciuda unor metaanalize culmulative largi, cuprinzand 20186 pacienti, sugerand administrarea de rutina a inhibitorilor Gp IIb/IIIa pentru PCI, si in ciuda unei metaanalize cu 8004 pacienti sugerand o reducere a mortalitatii dupa utilizarea inhib Gp IIb/ IIIa pentru pacientii cu boala coronariana non-acuta, folosirea inhibitorilor Gp IIb/ IIIa in PCI pentru angina stabila ar trebui luata in considerare de la caz la caz.
Ori de cate ori exista un risc mai inalt decat media, de complicatii in angina stabila, inhib Gp IIb/ IIIa sunt de folos in leziunile instabile ca si medicatie de scapare in cazul unei potentiale/actuale ocluzii vasculare, tromb vizibil sau fenomen de flux scazut/lipsa fluxului sanguin prin vas.
Inhib Gp IIb/IIIa sunt de asemenea utili in interventiile complexe (recomandarea pentru inhibitorii receptorului GpIIb/IIIa in angina stabila, leziuni complexe dupa interventii coronariene percutanate, posibila amenintare de ocluzie/ocluzie actuala, tromb vizibil, lipsa/flux incetinit: IIaC)
3.5.2. Inhibitorii de Gp IIb/ IIIa in NSTE-ACS
Studiile individuale care au investigat inhib Gp IIb/ IIIa la pacientii cu NSTE-ACS au fost discutate in detaliu in ghidurile ESC NSTE-ACS. In ceea ce priveste PCI, studiile care investigheaza utilizarea inhib Gp IIb/ IIIa in NSTE-ACS pot fi divizate in studiile in care PCI a fost planificat per protocol si, in studiile care descurajeaza strategia invaziva.
PCI nu a fost planificat sau chiar a fost descurajat in GUSTO-IV-ACS cu abciximab, PRISM si PRISM PLUS cu tirofiban si PARAGON-A cu lamifiban. PCI a fost lasat la latitudinea medicului in PURSUIT cu eptifibatide si PARAGON-B cu lamifiban. Astfel, ratele PCI in aceste studii sunt joase, variind intre 1,6 si 30,5%.
Studiile inhibitorilor GP IIb/IIIa cu PCI planificat sunt listate in Tabelul 10. In general, folosirea oricarui din cei 3 inhibitori de GP II b/III a este recomandat la pacientii care efectueaza interventii coronariene percutanate cu risc inalt pentru complicatii trombotice acute in NSTE-ACS.
Abciximab-ul, administrat la scurt timp inaintea interventiei, este superior placebo, in reducerea riscului acut de complicatii ischemice. (CAPTURE, EPIC, EPILOG, EPISTENT). Desi aceste studii au fost studii PCI, unul ar trebui retinut si anume ca stentarea planificata a fost un criteriu de excludere in EPILOG si rata stentarii a fost relative redusa cu 7,6% in CAPTURE si sub 2% in EPIC, in care stentarea a fost descurajata.
In EPISTENT 43% dintre pacienti aveau angina stabila, iar in ERASER cu stentare planificata, pacientii cu tromb intracoronarian evident au fost exclusi.
Rezultate similare au fost obtinute din analiza retrospectiva a studiilor realizate cu eptifibatide (ESPRIT, IMPACT II), unde evidenta pentru tirofiban este mai putin bine stabilita (RESTORE). Eptifibatide ofera eficacitate antiplachetara mai mare fata de ASA si Clopidogrel la pacientii NSTEMI (PEACE study). Oricum, administrarea de rutina a eptifibatidei in urgenta, cu o rata redusa PCI, nu a modulat masuratorile dimensiunilor infarctului la pacientii cu NSTE-ACS (EARLY Study).
In trialul TARGET, comparatia directa a abciximabului cu tirofiban la pacientii care efectueaza PCI a relevant o eficacitate mai mica a Tirofibanului la pacientii cu risc inalt.
IM non-fatal/moartea/revascularizatia de urgenta la 30 de zile au aparut semnificativ mai frecvent printre pacientii cu tirofiban, fata de pacientii cu abciximab (7,6 fata de 6,0%). Oricum, la 6 luni nu a fost o diferenta semnificativ statistic intre cele 2 grupuri. Aceste rezultate au fost puse pe seama subdozarii tirofiban-ului, acest inconvenient indepartandu-se prin cresterea dozei tirofiban-ului de 2-2,5 ori. Trialul TENACITY va studia rezultatele administrarii unui bolus mai mare de tirofiban decat cel administrat in studiul TARGET, si va compara indeaproape efectele sale cu cele ale abciximab-ului.
Cu privire la interventiile coronariene percutanate, ar fi necesar un trial investigand beneficiul initierii inhibitorilor de Gp IIb/IIIa, fie inaintea angiografiei diagnostice, fie inaintea interventiilor coronariene percutanate, in care sa fie inclusi numai a pacientii cu risc inalt cu NSTE-ACS, cu interventii coronariene percutanate si stentare planificata la toti pacientii.
3.6. Inhibitori directi ai trombinei
3.6.1. Inhibitorii directi ai trombinei in sindroamele coronariene acute cu supradenivelare ST
La momentul actual, chiar si analizand subgrupurile de pacienti dilatati, nu exista evidente care sa sustina utilizarea inhibitorilor directi ai trombinei in sindroamele coronariene acute cu supradenivelare ST.
Rezumand, dat fiind riscul global scazut al PCI in angina pectorala stabila, potentialul risc hemoragic al inhibitorilor GPIIb/IIIa si costului lor considerabil, acestia nu intra in tratamentul standard periprocedural. Folosirea inhibitorilor GPIIb/IIIa in angina stabila trebuie considerata pe baza electiva: cand exista risc de tromboza acuta mai crescut decat in mod normal in boala coronariana ischemica stabila (interventii complexe, leziuni instabile, risc de ocluzie acuta, tromb vizibil sau "no/slow-reflow".
In sindroamele coronariene acute fara supradenivelare de ST, inhibitorii de glicoproteina IIb/IIIa se administreaza doar la pacientii high risk la care se are in vedere o strategie invaziva. Daca se are in vedere initierea tratamentului la prezentarea bolnavului in spital iar coronarografia nu este disponibila sau planificata in decurs de 2,5 h, tirofibanul in eptifibatida aduc beneficii. Daca explorarea invaziva e probabila in 2,5 h, inhibitorii GP Iib/IIIa pot sa fie administrati in laboratorul de cateterism (abciximab sau eptifibatide). Daca intre coronarografie si angioplastie intarzierea ajunge pana la 24 h abciximabul poate fi administrat.
La pacientii cu STEMI, tirofibanul si eptifibatide au fost mai putin studiate. In STEMI, stentingul plus abciximab pare sa fie o strategie de reperfuzie mai buna cae se bazeaza pe evidente. Biralirudina poate inlocui heparina fractionata sau nefractionata datorita sangerarilor semnificativ mai reduse comparativ cu heparina nefractionata singura sau asociata cu inhibitori GPIIb/IIIa. Bivalirudina este unanim recomandata pentru PCI cu inlocuitor al heparinei (si formelor fractionate) in trombocitopenii induse de heparina.
Tabelul 12. Studii randomizate cu inhibitori directi ai trombinei in sindroame cr acute
fara supradenivelare ST la cere se efectueaza PCI
|
|
HELVETICA |
BAT per protocol |
BAT intentie de a trata |
|
Drog Rel. administrarii Cu PCI Drog control |
Hirudin(i.v/iv.+s.c.) Inainte de PCI Heparina nefract.:bolus 10000 U 24 h inf.15 U/kg/h |
Bivalirudin Imediat inainte de PCI Heparina nefract. Bolus 175 U/kg 18-24 h inf 15 U/kg/h |
Bivalirudin Imediat inainte de PCI Heparina nefract.:bolus 175 U/kg 18-24 h inf.15U/kg/h |
|
Caract clinice ale pacientilor Nr.pacienti |
Angina instabila |
Angor instabil/angor post IM |
Angor instabil/angor post IM |
|
PCI |
Propus pentru toti pacientii |
Propus pentru toti pacientii |
Propus pentru toti pacientii |
|
Stenting |
Criteriu de excludere |
Descurajat |
Descurajat |
|
Sangerari majore (control/drog/%) |
|
|
7 zile: 9,3/3,5 90 zile: 9,3/3,7 180 zile: 24,7/23,0 |
|
End point primar |
Supravietuire |
Deces/IM/ocluzie ac. |
Deces/IM/revascularizatie |
|
Timp |
7 luni |
Intraspital |
7, 90, 180 zile |
|
Rezultate end point primar (control/drog/%) |
|
|
7,90/80 zile 90 zile 18,5/15,7 180 zile 24,7/23 |
|
Atingerea end pointului primar |
Nu |
Nu |
Da (7 si 90 de zile) |
|
Medicatie |
Indicatie |
Clasa indicatiei si nivelul de evidenta |
Studii randomizate |
|
Abciximab, epifibatide, tirofiban in angina pectorala stabila |
Leziuni complexe, amenintare de ocluzie, trom vizibil, no/slow reflow |
II a C |
|
|
Abciximab, eptibatide in sindromul coronariene acute fara supradenivelare de segm.ST |
Imediat inainte de PCI in cazuri high risk |
I C |
|
|
Tirofiban, eptifibatide |
Tratamentul inainte de coronarografie si de o posibila angioplastie in decersul a 48 h la pacientii high risk |
I C |
|
|
Abciximab in NSTE-ACS |
La pacientii high risc cu aantomie coronariana cunoscuta cu 24 h inainte de PCI planificat |
I C |
|
|
Abciximab In STEMI |
In toate PCI primara (preferabil la pacientii cu high risk) |
II a A |
ADLMIRAL, ACE |
|
Bivalirudin |
|
|
|
4. Dispozitive complementare PCI
4.1. Brahiterapia intracoronariana
pentru restenoza intrastent
Restenoza in stent este produsa de hiperplazi intimala inauntrul stentului, adesea incluzand si marginile lui. Desi angioplastia cu balon este sigura pentru tratamentul restenozei in stent sunt bine stabiliti : leziuni lungi (>30 mm), lungime mare a stentului, diamentrul vasului redus (<2,5 mm), diametrul postdilatare mic, recanalizarea ocluziilor cronice, leziuni ostiale si de bifurcatie, prezenta diabetului zaharat.
Brahiterapia intracoronariana a demonstrat imbunatatirea semnificativa a rezultatului clinic si angiografic pe coronare native in mai multe trialuri randomizate controlate placebo (GAMMA I< WRIST, LONG-WRIST, START, INHIBIT) si pe grafturi venoase (SVG-WRIST). Aceste rezultate reflecta situatia "in lumea reala" confirmate prin registrul european RENO. Restenoza observata la marginile stentului a fost un motiv major de ingrijorare la inceputurile brahiterapiei. Riscul fenomenului marginilor este minimalizat prin utilizarea unor surse de lungim mare sau a tehnicii secventiale "pull-back" care iradiaza intreg segmentul vascular. Rezultatele clinice pe termen lung cu o semnificativa reducere a mMACE prin radiatii beta in start sunt comparabile cu cele obtinute prin gama iradiere in SCRIPS I, GAMMA I si WRIST.
Pentru gama radiatii au fost raportate rezultate bune pe termen lung dupa 3 si 5 ani. Pentru a preveni ocluzia tardiva a vasului, este largacceptata administrarea Clopidogrelului pe termen lung - 1 an postiradiere (Recomandarea pentru brahiterapie pentru restenoza in stent in coronare native 1 A si Recomandare pentru brahiterapia in restenoza in stent in grafturi venoase : I B.
Tabelul 14. MACE dupa 2 ani in studii randomizate cu brahiterapie
intracoronariana pentru restenoza in stent
|
Studiu |
Tipul radiatiei |
MACE % control |
MACE % brahiterapie |
|
SCRIPRS |
Gamma |
|
|
|
GAMMA - 1 |
Gamma |
|
|
|
WRIST |
Gamma |
|
|
|
START |
Beta |
|
|
4.2. Balonul cu
cutitase taietoare
(cutting baloon)
Cutting baloon-ul (CB) este prevazut pe lungimea sa cu 3 sau 4 lame metalice taietoare producand incizii ale placii ATS in timpul dilatatiei. Inciziile teoretic favorizeaza redistributia placii la inflatii la presiune joasa comparativ cu angioplastia cu balon.
Trialul randomizat global cu cutting baloon a testat conceptul de dilatare controlata la 1238 pacienti cu leziuni de novo.
Endpointul primar reprezentat de rata de restenoza binara la 6 luni a fost 31,4% pentru cutting baloon si 30,4 pentru angioplastia cu balon. Astfel , mecanismul propus de dilatatie controlata nu a redus rata restenozei angiografice cu cutting baloon. Dupa unele studii retrospective si trialuri randomizate mici, cuttingul a fost propus si pentru tratamentul restenozei in stent. Totusi, rezultatele trialului randomizat RESCUT nu justifica utilitatea cuttingului in restenoza in stent. El poate fi totusi de ajutor in cazul restenozei in stent: prin evitarea alunecarii balonului se reduce trauma vasculara; in combinatie cu brahiterapia, cuttingul este o alegere logica (Recomandare pentru cutting baloon pentru evitarea traumei vasculare cazuata de alunecarea balonului in restenoza in stent IIaC).
4.3. Rotablatia
Procedeul rotablatiei consta in pulverizarea "placii de aterom prin burghie de diamant cu viteza de rotatie extrem de mare (140.000-180.000 rpm). Datorita frecventei mari a spasmului coronarian si fenomenelor de slow/no reflow este necesara cunoasterea tratamentului acestor complicatii. Trialul COBRA a fost destinat sa dovedeasca eficienta rotablatiei in leziuni complexe de novo comparativ cu angioplastia cu balon. Rezultatele nu au aratat nici un beneficiu pe termen lung. STRATAS nu a demonstrat nici un avantaj prin folosirea unei rotablatii mai agresive, la fel si studiul CARAT in care s-au utilizat burghie de dimensiuni mai mari, rata complicatiilor fiind mai mare si rezultatele clinice mai nefavorabile comparativ cu utilizarea unor burghie mai mici. Rotablatia a fost propusa si pentru tratamentul restenozei in stent, ablatia tesuturilor prin rotablatie fiind mai eficienta comparativ cu compresia tisulara sau extruziunea realizata cu balon. Aceasta strategie reprezinta insa un subiect de controversa. Trialul ARTIST a evidentiat rezultate semnificativ mai nefavorabile in cazul ROTA fata de angioplastia cu balon. Pe de alta parte, in trialul ROSTER, MACE la 1 an au fost mai scazute in grupul ROTA. In ROSTER, IVUS-ul a fost obligatoriu pentru excluderea pacientilor cu stenturi subexpandate. In general, nu incurajam folosirea rotablatiei pentru restenoza in stent. Odata cu cresterea utilizarii stenturilor farmacologic active si necesitatii eliberarii omogene a substantelor active prin apozitia corecta a stentului in leziunile calcifice, rotablatia poate castiga teren. In practica clinica este bine de stiut ca leziunile pasate cu ghidul care nu pot fi pasate cu balon noncompliant pot fi in unele cazuri mult mai bine tratate cu rotablatie (Recomandare pentru rotablatie in leziuni fibrotice sau foarte calcificate care nu pot fi pasate cu balon sau dilatate adecvat inainte de stentare: I C).
4.4. Aterectomia directionala
Conceptul de extragere a placii obstructive coronariene pentru obtinerea unui lumen vascular corespunzator prin aterectomie coronariana directionala (DCA) pare atractiv; studiul CAVEAT I a demonstrat insa complicatii precoce mai numeroase cu costuri procedurale ridicate si fara beneficii clinice. CAVEAT II a comparat DCA cu angioplastia cu balon pentru grafturi venoase fara a exista diferenta in ce priveste rata de restenoza la 6 luni. Studiile BOAT, CCAT si OARS nu au dovedit niciun impact asupra evolutiei clinice la 18 luni dupa DEA. In trialul AMIGO au existat diferente interinstitutionale considerate considerabile care pot explica unele rezultate nefavorabile. Pentru cercetare aterectomia este singura metoda percutana de indepartare cu conditii de siguranta a placii de aterom (Recomandare pentru DCA in leziunile de novo ostiale sau bifurcatii pentru interventionisti cu experient: II b C).
4.5. Dispozitive de protectie pentru embolii
Multi pacienti la care li se efectueaza angioplastie sunt expusi embolizarii coronariene distale, in special in interventiile pe grafturi venoase safene. O analiza a 5 trialuri clinice randomizate a aratat ca inhibitorii GP IIb/IIIa nu amelioreaza rezultatele PCI in grafturi venoase. Folisirea stenturilor acoperite cu PTFE nu reduce rata evenimentelor clinice datorate embolizarilor distale (STING, RECOVERS, SIMBIOT-III).
Fenomenul no-reflow se caracterizeaza prin flux inadecvat la nivel tisular desi astera coronara epicardica este complet dilatata sau redeschisa. Aceste zone miocardice de "no-reflow" pot fi cauzate de disruptii microvasculare, disfuntie endoteliala, edem miocardic sau embolizari de material trombotic sau aterosclerotic. Se poate produce o deteriorare hemodinamica critica. Au fost studiate mai multe abordari terapeutice pentru preventia embolizarilor distale. Mai multe dispozitive care filtreaza sau aspira embolii din vasul tinta sunt in continuarea evaluate in studii randomizate.
4.5.1. Dispozitive de protectie distala
Sistemul de protectie distala constand dintr-un balon obstructiv plasat distal si un cateter de aspiratie (Guard-Wire) imbunatateste perfuzia miocardica in angioplastiile de vene safene. Acest lucru l-a demonstrat trialul SAFER. Endpointul primar (deces, infarct miocardic, bypass de urgenta si repetarea revascularizatiei) a fost semnificativ redus de la 16,5 la 9,7%. Aceasta reducere relativa a MACE cu 42% s-a datorat reducerii infarctului miocardic (14,7 vs 8,6%) si fenomenului "no-reflow" (9% vs 3%). Protectia distala cu catetere filtre ofera avantajul mentinerii fluxului anterograd. Trialul FIRE a comparat doua tipuri diferite de protectie in leziunile safene. Decesul, infarctul miocardic si necesarul repetarii revascularizatiei la 30 de zile a fost de 9,9% in cazul Filter Wire. Ex si 11,6 in cazul utilizarii Guard Wire. In studiul CAPTIVE, protectia cu Cardioshield nu s-a dovedit a fi mai putin inferioara decat cea cu GuardWire. La fel de eficienta este si TriActiv care combina si un mecanism de suctiune. Totusi, un numar considerabil de pacienti cu leziuni safene prezinta criteii anatomice de excludere pentru dispozitivele de protectie disponibile la momentul actual (Recomandare pentru protectia embolica in PCI pentru grafturile safene: IA).
Protectia distala nu s-a dovedit eficienta insa in PCI pe vase native in sdr.coroanriene acute cu supradenivelare ST. In trialul EMERALD marimea infarctului a fost redusa cu 17% in grupul cu protectie distala si 16% in grupul control PCI.
4.5.2. Protectia proximala (suctiune, trombectomie)
Limita protectiei distale se leaga de necesitatea pasarii leziunii cu balonul de ocluzie sau filtrul.
Dispozitivele alternative de suctiune sau baloanele de ocluzie proximala pot fi din acest punct de vedere mai utile. Cel mai simplu ar fi utilizarea cateterului ghid ca dispozitiv de suctiune. Dispozitivul Angiojet a fost testat intr-un studiu randomizat, comparat fiind cu infuzia de Urokinaza la pacientii cu tromb angiografic vizibil pe grafturi safene (VeGAS-2). Nu au existat diferente in MACE. AngioJet nu a redus marimea infarctului In PCI efectuate in STEMI. X SIZER este un alt dispozitiv de suctiune care poate fi util la pacientii cu infarct miocardic acut. Studiul randomizat X-TRACT a comparat PCI in grafturi venoase cu tromb vs PCI si trombectomie prealabila. Infarctul miocardic periprocedural la 30 de zile a survenit la 15,8% din pacientii cu X-SIZER fata de 16,6 in grupul control (nesemnificativ statistic). O analiza pe subgrupuri a aratat ca trombectomia cu X-SIZER poate reduce marimea dar nu si aparitia mionecrozei; supravietuirea fara evenimente adverse atat precoce, cat si tardive, nu a fost influentata prin trombectomie de rutina cu X SIZER.
Protectia distala cu filtru poate fi utila in leziunile cu potential embolic crescut. (Recomandare pentru protectie distala si proximala cu incarcatura trombotica ridicata: IIbC)
Pentru tratamentul de urgenta al perforatiilor coronariene, stenturile acoperite cu PTFE sunt recomandate ca si clasa IC pe baza consensului expertilor.
Rezumand, brahiterapia este singurul tratament nechirurgical bazat pe evidente in restenoza in stent. Pentru evitarea trombozei tardive, este necesara administrarea prelungita a Clopidogrelului - 1 an de la iradiere.
Rotablatia se recomanda pentru leziuni fibrotice sau sever calcificate care nu pot fi pasate cu balon sau dilatate adecvat inaintea stentarii. Este necesara cunoasterea tratamentului complicatiilor inerente rotablatiei.
PCI in grafturi safene sau in sindroame coronariene acut cu mare incarcatura trombotica prezinta risc crescut de embolizare. Doua dispozitive de protectie distala (Guard Wire si FilterWire Ex) si-au dovedit siguranta si eficienta in PCI in grafturi safene.
Sunt necesare mai multe trialuri randomizate cu endpointuri clinice pentru baloanele de ocluzie si sistemele de aspiratie in alte situatii clinice cum este PCI in infarctul miocardic acut. In prezent nu exista recomandari definitive pentru utilizarea sistemelor de protectie STEMI.
|
Procedura |
Recomandari pentru indicatie |
Clasa de recomandare |
Studii randomizate |
|
Brahiterapie |
Restenoza in stent in coronarele native |
I A |
SCRIPPS, GAMMA-1, WRIST, START, INHIBIT |
|
Brahiterapie |
Restenoza in stent in grafturi venoase |
I B |
SVG-WRIST |
|
Cutting balon |
Restenoza in stent - asociata cu brahiterapia |
II a C |
|
|
Rotablatia |
Leziuni fibrotice si intens calcifice |
I C |
|
|
DCA |
Leziuni de novo ostiale sau de bifurcatie |
II b C |
|
|
Protectie embolica distala |
Grafturi safene |
I A |
SAFER, FIRE |
|
Protectie proximala si distala |
Sindroame cornariene acute cu trombus in cantitate mare |
II b C |
|
|
Stenturi acoperite cu PTFE |
Perforatii coronariene |
I C |
|
4.6. Procedee diagnostice aditionale
4.6.1. Ultrasonografia intravasculara (IVUS)
In timp ce angiografia evidentiaza lumenul vascular in doua dimensiuni, IVUS permite evaluarea tomografica a ariei luminale, a marimii placii ATS, distributiei si compozitiei. IVUS este o metoda complementara valoroasa de diagnostic, furnizand detalii pentru diagnostic si terapie. Desi cardiologia interventionala a progresat prin IVUS, efectul nu s-a produs si in reducerea MACE. IVUS practicat de rutina in timpul stentarii nu a imbunatatit rezultatele clinice la 9 luni.
4.6.2. Rezerva fractionala de flux (FFR)
Desi testele functionale au sensibilitate de 76-88% si specificitate de 80-88% si trebuie sa fie standard de aur inainte de cateterism, multi pacienti ajung la coronarografie fara testare functionala prealabila.
Daca exista contraindicatie pentru teste functionale sau nu poate fi exclusa ischemia indusa de stres legata de o stenoza coronariana la limita, este utila masurarea rezervei fractionale de flux. Interventionistii de obicei nu trateaza stenoze care nu apar hemodinamic semnificative; totusi anatomopatologia si IVUS au dovedit ca leziunile difuze, placile rupte si complexe sunt dificil de evaluat prin angiografie planara, chiar interventionisti experimentati neputand evalua acurat stenozele "intermediare" pe baza vizuala sau QCA.
FFR <0,75 este foarte specifica si denota ischemie inductibila (Figura 4).
50-70% stenoza ischemie nedocumentata sau lipsa testelor functionale
Amana PCI <0,75 FFR
![]()
![]()
![]()
![]()
![]()
(a) PCI
FFR >0,8 exclude ischemia in 90% din cazuri.
FFR pare altfel sa fie metoda ideala de determinare a semnificatiei unei leziuni "intermediare" daca ischemia miocardica nu este documentata prin metode nonivazive. Analize retrospective au aratat ca tratarea pacientilor fara angioplastie la FFR >0,75 este sigura si cu prognostic favorabil. Trialul DEFER a impartit bolnavii in trei grupuri, primul cu FFR <0,75 care au fost dilatati (grup de referinta), al doilea cu FFR ≥0,75 la care s-a efectuat PCI si ultimul cu FFR ≥0,75 care au fost tratati medical. Supravietuirea fara evenimente a fost similara intre grupul de referinta si cel tratat medical la 12 si 24 luni, dovedindu-se utilitatea FFR in aprecierea semnificatiei leziunilor borderline, incluzand aici si pe cei cu restenoza in stent 40-70%. Conceptul de acoperire sau "inchidere" a placii cu stent pentru leziuni nesemnificative nu este recomandat datorita faptului ca MACE pe termen scurt depasesc orice beneficii ipotetice pe termen lung, cel putin in cazul stenturilor obisnuite. Primele rezultate la pacienti tratati cu stenturi sirolimus pentru leziuni de novo <50% au aratat ca la 400 de zile niciun pacient n-a necesitat repetarea revascularizatiei.
5. Stenturi eliberatoare
de substante active (DES)
Acestea au intrat in antentie de cand studiul RAVEL a fost prezentat prima data la Congresul ESC in 2001. Au fost studiate o mare varietate de stenturi cu diverse substante active, platforme si polimeri. Au fost evaluate numeroase substante antiproliferative si antiinflamatoare cum sunt sirolimus, paclitaxel si tacrolimus, everolimus, ABT-578, biolimus, dexametazona, 17-β-estradiol, actinomicina-D, metotrexat, vincristin, ciclosporina, statine, carvedilol, abciximab si trapidil. Multe din aceste droguri au fost abandonate in ciuda rezultatelor experimentale initiale incurajatoare, studiile clinice ulterioare (SCORE pentru QPZ, ACTION pentru adrinomicina D, STRIDE cu dexametazona) aratand ca ele pot fi nocive sau au actiune foarte redusa desi au fost administrate doze mari - cauzul dexametazonei. Rezultatele acestor trialuri demonstreaza ca nu toate drogurile antiproliferative au efect de clasa in preventia restenozei.
Endpointurile primare ale studiilor randomizate cu DES au fost fie angiografice (de ex. pierderea tardiva luminala LLL) sau clinice (necesitatea reinterventiei pe vasul tinta TVR). Pentru pacient, evolutia lui clinica este mult mai importanta decat parametri angiografici.
Tinand cont ca puterea statistica a unui trial se valideaza doar pe endpointul primar primar, ne vom referi in continuare doar la studiile cu endpoint primar clinic (Tabelul 16). Paclitaxelul nefixat pe un polimer nu s-a devedit eficient din punct de vedere clinic in ciuda unui rezultat bun angiografic in DELIVER I. In schimb, cand a fost eliberat dintr-un polimer s-au ameliorat semnificativ rezultatele clinice in TAXUS IV si TAXUS VI. Sirolimus a fost studiat doar pe un polimer, de exemplu in trialul SIRIUS. Desi visul "fara restenoza" nu s-a realizat, DES asigura un procent de restenoza clinica si angiografica la 9 luni dintr-o singura cifra. In viata reala (registrul RESEARCH), riscul clinic de repetare a revascularizatiei (TVR) la 1 an a fost de 3,7%. In registrul Elvetian, supravietuirea fara MACE la 6-9 luni a fost de 96,6%.
In leziunile descendentei anterioare rata revascularizatiei cu stenturi sirolimus e comparabila cu chirurgia de bypass la 1 an. Primele rezultate ale unei comparatii prospective, randomizate intre stenturile Cypher si Taxus cu confirmat ca rata ridicata de succes realizata cu ambele stenturi poate fi obtinuta si in practica clinica curenta. Studiul fiind pe un numar mic de pacienti (220), a fost incapabil de a demonstra superioritatea unuia sau celuilalt stent.
5.1. Diametrul vasului,
leziunile lungi,
diabetul zaharat
Tabelul 17 arata efectul stentului Cypher in trialul SIRIUS si ale stentului TAXUS in TAXUL IV, analizand subgrupurile in functie de diametrul vascular. In TAXUS VI, TLR a fost semnificativ mai mica pe vase mici (<2,5 mm) - 29,7% fata de 5,0% in grupul de DES. O analiza pe subgrupuri a registrului RESEARCH a 112 leziuni tratate cu stenturi Cypher de 2,25 mm a raportat o pierdere tardiva de lumen de 0,070,48 mm si o rata de restenoza de 10,7%.
Diabetul zaharat este un alt factor de risc cunoscut pentru restenoza. Rata de restenoza si TLR au fost semnificativ reduse in trialurile SIRIUS si TAXUS - IV la pacientii diabetici (Tabelul 18).
Tabelul 16. Studii perfectiv randomizate placebo pentru DES avand ca enpoint primar
un paramentru clinic urmarit la un interval de timp adecvat (9 luni)
|
|
DELIVER-I |
|
TAXUS-IV |
|
SIRIUS |
|
TAXUS VI |
|
|
Substanta activa |
Paclitaxel |
|
Paclitaxel |
|
Sirolimus |
|
Paclitaxel |
|
|
Polimer eliberator de substanta activa |
Nu |
|
Da |
|
Da |
|
Da |
|
|
Diametrul de referinta pentru includere in studiu |
|
|
|
|
|
|
|
|
|
Lungimea leziunii pentru includere |
<25 |
|
|
|
|
|
|
|
|
Grup randomizat |
Control |
DES |
Control |
DES |
Control |
DES |
Control |
DES |
|
Pacienti |
|
|
|
|
|
|
|
|
|
Diametru de referinta (mm) |
|
|
|
|
|
|
|
|
|
Lungimea leziunii (mm) |
|
|
|
|
|
|
|
|
|
RR (%) in segment |
|
|
|
|
|
|
|
|
|
LLL(mm) in stent |
|
|
|
|
|
|
|
|
|
TLR (%) |
|
|
|
|
|
|
|
|
|
TVR (%) |
|
|
|
|
|
|
|
|
|
TVF (%) |
|
|
|
|
|
|
|
|
|
Deces (%) |
|
|
|
|
|
|
|
|
|
Infarct miocardic (%) |
|
|
|
|
|
|
|
|
|
MACE la 9 luni (%) |
|
|
|
|
|
|
|
|
|
Atingerea endpointului primar |
Nu (TVF) |
|
Da(TVR) |
|
Da(TVF) |
|
DA(TVR) |
|
|
P <0,05 (comparat cu stenturi obisnuite) RR = rata de restenoza LLL = pierderea tardiva luminala TLR = necesitatea revacularizarii leziunii dilatate initial TVR = recent revascularizarii vasului dilatat initial TVF = esec asupra vasului tinta |
||||||||
Desi rezultatele trialului SIRIUS sunt promitatoare, exista o tendinta a repetarii interventiei la pacientii diabetici comparativ cu cei nediabetici si in special la cei insulino necesitanti, In TAXUS VI, TLR a fost semnificativ redusa la diabeticii cu leziuni lungi, de la 22,0% la 2,6%.
Tabelul 17. Efectul DES in functie de dimensiunea medie a vasului
|
|
SIRIUS |
|
|
TAXUS-IV |
|
|
|
|
Mic ~2,3 mm |
Mediu ~2,8mm |
Mare ~3,3mm |
Mic ~2,2 mm |
Mediu ~2,7mm |
Mare ~3,3mm |
|
Rata de restenoza (RR) |
||||||
|
Control (%) |
|
|
|
|
|
|
|
DES (%) |
|
|
|
|
|
|
|
Repetarea revascularizatiei la nivelul leziunii (TLR) |
||||||
|
Control (%) |
|
|
|
|
|
|
|
DES (%0 |
|
|
|
|
|
|
|
P <0,05 comparativ cu stent obisnuit (BMS) |
||||||
|
|
SIRIUS |
|
TAXUS-IV |
|
|
|
Control |
DES |
Control |
DES |
|
Pacientii diabetici |
|
|
|
|
|
Antidiabetice orale |
|
|
|
|
|
Insulinonecesitanti |
|
|
|
|
|
Rata de restenozare, RR (%) |
|
|
|
|
|
Toti diabeticii |
|
|
|
|
|
Non insulinonecesitanti |
|
|
|
|
|
Insulinonecesitanti |
|
|
|
|
|
Repetarea revascularizatiei la nivelul leziunii (TLR) |
|
|
|
|
|
Toti diabeticii |
|
|
|
|
|
Non insulinonecesitanti |
|
|
|
|
|
Insulinonecesitanti |
|
|
|
|
|
P <0,05 comparativ cu BMS |
||||
5.2. Tromboza de stent a DES
Tromboza de stent nu a fost gasita ca o probelma relevanta in trialurile randomizate in care Clopidogrelul a fost administrat alaturi de Aspirina pe diferite perioade - 2 luni in E-SIRIUS, 3 luni in SIRIUS si 6 luni in TAXUS. Rata trombozei de stent la 1 an a fost de 0,4% in ambele grupuri in trialul DELIVER I; in SIRIUS la 9 luni a fost de 0,4%; in grupul DES si 0,8 in grupul de control. In E-SIRIUS, au fost 2 cazuri de tromboza subacuta de stent (1,1%), soldate cu infarct miocardic in grupul Sirolimus si nici un caz in in grupul de control. In TAXUS-IV, tromboza de stent la 9 luni a fost de 0,6% in grupul DES si 0,8 in grupul de control. Pe trermen lung si in mai mult de 50% leziuni complexe, tromboza de stent la 300 zile a aparut la 1,3% in grupul de control si 0,5% in DES in trialul TAXUS-VI. Intre ziua 31 si 300 nu s-a inregistrat nici o tromboza in stent, atat in grupul DES cat si control.
Endotelizarea completa a DES necesita teoretic pana la 2 ani de zile. Registrele sunt importante pentru a vedea daca rezultatele din studiile controlate pot fi aplicate in practica curenta. Intreruperea prematura a tienopiridinelor se asociaza cu tromboza de stent (Recomandarea pentru administrarea Clopidogrelului 6-12 luni dupa DES: IC).
La pacientii la care se stie ca administrarea prelungita a Clopidorelului e improbabila (de exemplu interventiile chirurgicale majore planificate curand), DES-urile trebuie utilizate cu atentie.
La acesti pacienti, BMS reprezinta o alegere mai sigura.
5.3. Indicatii pentru DES
Teama de a utiliza sau nu DES privind repercusiuni medicolegale este nefondata. Nu trebuie insa implantate doar DES pentru a evita potentialele litigii.
Exista doua abordari alternative pentru a face recomandarea de DES: una se bazeaza pe calcule cost-eficienta, a doua pe criteriile de includere/excludere din trialurile randomizate pivot. Tinand cont de nivelul de evidenta, doar Cypher si Taxus pot fi recomandate ca si clasa I B, pe baza studiilor SIRIUS, TAXUS-IV si TAXUS-VI (Tabelul 19).
Institutul britanic NHS NICE recomanda DES dupa cum urmeaza: la pacientii cu CI simptomatica la care calibrul arterei este mai mic de 3 mm si leziunea mai lunga de 15 mm. Aceasta nu se aplica celor cu un infarct miocardic sub 24 sau daca exista tromb angiografic vizibil in artera implicata. Totusi DES au fost utilizate si in angorul instabil si infarctul miocardic.
Toate situatiile urmatoare, in special cele cu risc crescut de restenoza, necesita evaluare ulterioara bazata pe evidente (recomandari in prezent II a C):
Vase mici
Ocluzii cronice totale
Leziuni de by pass
Diabet insulinodependent
Boala multivasculara
Trunchi principal neprotejat
Restenoza in stent
Desi nu exista inca trialuri randomizate, stentarea perprimam (fara predilatatie) pare sigura si eficienta cu Cypher si Taxus.
O scadere considerabila a costurilor de ingrijire medicala se va obtine prin DES daca acestea reduc numarul pacientilor cu CABG, in special a celor cu DZ si multivasculari.
Tabelul 19. Recomandari pentru utilizarea DES pentru leziuni de novo ale coronarelor native
|
DES |
|
Clasa de recomandare si nivel de evidenta |
Studii randomizate |
|
Stent Cypher |
Leziuni de novo pe vase native in conformitate cu criteriile de includere |
(b) I B |
SIRIUS |
|
Stent Taxus |
Leziuni de novo pe vase native in conformitate cu criteriile de includere |
I B |
TAXUS-IV |
|
Stent Taxus |
Leziuni largi de novo pe vase native in conformitate cu criteriile de includere |
I B |
TAXUS-VI |
Rezumand, doar doua stenturi DES au dovedit efecte pozitive semnificative in studii randomizate care au evaluat endpointuri clinice primare la un interval de timp corespunzator: stentul Cypher (Sirolimus) si stentul Taxus (Paclitaxel). Recomandarile trebuie sa tina cont de criteriile de inrolare din trialurile SIRIUS, TAXUS-IV si TAXUS-VI. La acesti pacienti necesarul de repetare a revascularizatiei pe vasul tinta a fost sub 10%. Analiza rezultatelor pe vase mici si la diabetici a fost incurajatoare. Registrele care au evaluat restenoza in stent (bifurcatii, leziuni ostiale, de bypass, trunchi principal) au demonstrat rezultate promitatoare dar sunt necesare trialuri randomizate pentru obtinerea unor nivele de evidenta la aceste subseturi de pacienti. In prezent este obligatorie administrarea prelungita de Clopidogrel (cel putin 6 luni) pentru evitarea trombozei tardive de stent. Prin urmare, nu vor fi implantate DES la pacienti care urmeaza sa fie supusi unor interventii chirurgicale majore in viitorul apropiat. In aceste cazuri, BMS sunt o alegere mai sigura. Medicii si pacientii trebuie sa fie constienti de faptul ca Clopidogrelul nu trebuie intrerupt prematur chiar si pentru proceduri dentare.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3035
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved