| CATEGORII DOCUMENTE |
| Aeronautica | Comunicatii | Electronica electricitate | Merceologie | Tehnica mecanica |
1) Conceptul de dezvoltare durabila
Conceptul de dezvoltare durabila are la baza cateva realitati: limita resurselor, limitele suportabilitatii mediului si dinamica de crestere a populatiei. Astfel, dezvoltarea durabila are in vedere satisfacerea cerintelor generatiilor prezente fara a compromite posibilitatea generatiilor viitoare de a-si satisface propriile cerinte.
Exista trei componente fundamentale:
- componenta de mediu (totalitatea resurselor, care fac posibila activitatea socio-umana)
- populatia care este principalul actor
- tehnologie - care reprezinta in general, totalitatea mijloacelor prin care omul foloseste resursele in vederea satisfacerii nevoilor
Strategia de dezvoltare durabila se compune din: (componentele sunt considerate intr-o stransa interdependenta);
- constientizarea reprezinta acea componenta a strategiei care vizeaza constientizarea populatiei catre o noua filozofie legata de raportul intre prosperitate, satisfactie si bunastare materiala.
- eficienta (componenta a strategiei de dezvoltare durabila care are ca scop imbunatatirea raportului dintre productivitate si resurse);
- consistenta (acea componenta a strategiei care vizeaza realizarea de cicluri economice performante integrate in ciclurile naturale adica sa realizam sisteme tehnologice care produc emisii ce pot fi reprocesate in cicluri naturale).
Modul de implementare a strategiei de dezvoltare durabila se poate realiza atat la nivel global cat si la nivel regional. In vederea demararii strategiei dezvoltarii durabile a fost stabilit protocolul de la Kyoto. Acest protocol vizeaza reducerea cu 6% a volumului de gaze cu efect de sera pana in 2010.
Are trei elemente :
- dezvoltarea de tehnologii cu impact ecologic scazut si transferul acestor tehnologii catre tarile in curs de dezvoltare. Teoretic, datorita inteligentei inglobata intr-o tehnologie se utilizeaza mai bine resursele.
- implementarea in parteneriat adica cu agregat energetic cu o eficienta ridicata si un impact ecologic scazut atat din partea firmei din tara in curs de dezvoltare cat si din partea firmei din tara dezvoltata
- certificatele de emisie sau bonuri de emisie care se comercializeaza pe o piata organizata
In domeniul economic exista termeni fundamentali cu care lucram:
- costul
- valoarea produsului respectiv: - valoare de utilizare
- valoarea intrinseca a unui anumit produs (cost)
- pret
Rolul si clasificarea termodinamicii
Termodinamica este acea parte a fizicii care studiaza fenomenele, procesele si sistemele in care are loc transformarea energiei dintr-o forma in alta.
In sens fizic energia reprezinta capacitatea de miscare a unui anumit sistem, ingloband in aceasta toate formele de miscare, atat la nivel macroscopic cat si la nivel macroscopic cat si la nivel macroscopic al macro-particulelor ce alcatuiesc sistemul.
Termodinamica se clasifica in:
a) termodinamica clasica - ce cuprinde fundamentul axiomatic si principalele metode de analiza si optimizare termodinamica.
b) termodinamica aplicata - ce cuprinde particularizarea metodelor termodinamicii pentru diferite fenomene si procese specifice.
In cadrul termodinamicii aplicate putem vorbi despre:
- termodinamica fizica - ce cuprinde acea parte a termodinamicii legata de metode de analiza si optimizare a diverselor procese fizice (studiaza procesele magnetice, efectele termice aplicate in electrostatica, electrodinamica, etc.);
- termodinamica chimica - ce cuprinde analiza bilanturilor energetice a proceselor si reactiilor chimice.
Termodinamica tehnica reprezinta acea parte a termodinamicii care are ca scop studiul proceselor din sistemele termomecanice.
O alta clasificare a termodinamicii vizeaza o clasificare in functie de procese astfel:
- termostatica - acea parte a termodinamicii ce are ca obiect de studiu sistemul termodinamic la starea sau in apropierea starii de echilibru termodinamic;
- termocinetica - studiaza procesele de transfer de caldura;
- termodinamica - studiaza procesele ireversibile in afara starii de echilibru termodinamic.
3) Notiuni fundamentale in termodinamica
In studiul oricarei probleme de termodinamica un rol esential il are notiunea de sistem termodinamic care reprezinta totalitatea corpurilor, considerate ca un ansamblu, delimitate sau nu de o frontiera fizica.
Din punct de vedere al schimbului de energie si masa este foarte importanta notiunea de frontiera (limita, invelis) care este o suprafata fizica sau abstracta ce delimiteaza un sistem termodinamic de alte sisteme termodinamice sau de mediul inconjurator.
In functie de proprietatile frontierei sistemele termodinamice se clasifica in :
- sistem inchis, daca nu se schimba masa;
- sistem deschis, daca schimba masa cu mediul inconjurator.
In cazul sistemelor deschise, pentru a putea aplica legile termodinamicii se introduce notiunea de volum de control, care reprezinta un volum delimitat in mod abstract de o suprafata geometrica prin peretii caruia are loc schimb de substanta (masa).
Din punct de vedere al proprietatilor frontierei sistemele termodinamice pot fi:
- sisteme termodinamice izolate - nu permit schimbul de energie;
- sisteme termodinamice neizolate - permit schimbul de energie.
Un sistem izolat este un sistem a carei frontiera nu permite schimb de energie cu mediul inconjurator.
De asemenea, sistemele termodinamice pot fi partial izolate, astfel se numeste sistem izolat adiabatic sistemul care nu permite schimbul de caldura cu mediul inconjurator, dar care permite schimb de energie sub forma de lucru mecanic.
Avem notiunea de sistem corp rigid care este un sistem care permite schimb de energie sub forma de caldura dar nu permite schimb de energie sub forma de lucru mecanic.
Din punct de vedere al structurii sistemelor termodinamice acestea pot fi:
- sisteme omogene - sunt formate din corpuri cu aceleasi proprietati fizice si chimice;
- sisteme neomogene -formate din corpuri cu proprietati diferite din punct de vedere fizic si chimic.
In cazul sistemelor neomogene acestea pot fi sisteme reactive sau sisteme nereactive din punct de vedere al reactiilor chimice care au loc intre componentele sistemelor.
In cazul sistemelor nereactive o situatie aparte o constituie sistemele multifazice care sunt formate din corpuri cu aceleasi proprietati chimice dar proprietati diferite din punct de vedere fizic.
4) Postulatele termodinamicii
Termodinamica din punct de vedere istoric a fost structurata inca din antichitate pe baza unor axiome numite postulate si principii. Axiomele termodinamicii au ca fundament observatii asupra fenomenelor din natura, experimente si rezultate empirice pe baza carora se sintetizeaza judecati de valoare cu caracter de generalitate si care nu necesita a fi demonstrate.
Exista mai multe scoli care folosesc diverse axiomatici.
Primul postulat al termodinamicii se refera la evolutia sistemelor catre starea de echilibru termodinamic.
Orice sistem termodinamic se caracterizeaza printr-o serie de proprietati. Aceste proprietati pot fi proprietati cantitative sau proprietati calitative. Acele proprietati care pot fi exprimate prin valori ale anumitor marimi fizice se considera a fi proprietati cantitative. Proprietatile cantitative pot fi masurate direct, situatie in care se numesc parametri termodinamici sau parametrii de stare deoarece valorile acestor parametri pot caracteriza starea la un moment dat a unui sistem termodinamic.
Numim stare termodinamica un ansamblu de valori ale parametrilor de stare astfel incat sa poata exista o relatie biunivoca intre o anumita stare si ansamblul de valori asociate.
Se numeste stare de echilibru intern starea caracterizata prin constanta in timp a valorilor parametrilor de stare.
Se numeste stare de echilibru extern echivalenta dintre nivelul energetic al unui sistem termodinamic si nivelul energetic al mediului inconjurator.
Se numeste stare de echilibru acea stare a unui sistem termodinamic caracterizata prin echilibru intern si extern.
Primul postulat al termodinamicii
Orice sistem termodinamic lasat liber in absenta diferentelor de potential va evolua de la sine catre starea de echilibru termodinamic.
In afara parametrilor de stare la starea de echilibru termodinamic se pot defini o serie de marimi a caror valoare nu poate fi definita prin masuratori directe, fapt pentru care la starea de echilibru termodinamic se considera un ansamblu de marimi de stare ce includ atat marimile masurabile direct cat si marimile ce nu pot fi masurate direct.
Din punct de vedere matematic marimile de stare admit diferentiala totala exacta:
Fie ![]() astfel putem scrie
astfel putem scrie
![]()
![]()
![]()
![]()
Proprietatile echilibrului termodinamic
1. Reciprocitate. Doua sisteme termodinamice aflate initial la starea de echilibru termodinamic vor evolua dupa ce vor fi puse in contact catre o noua stare de echilibru sau isi vor pastra starea initiala.
2. Tranzitivitate. Doua sisteme termodinamice aflate in echilibru cu un al treilea sistem termodinamic sunt in echilibru intre ele. Termometria opereaza cu notiunea de corp termometric. Aceasta reprezinta un sistem termodinamic de referinta ale carui proprietati sunt cunoscute.
. Distributia unica a energiei. Considerand ca un sistem termodinamic este constituit dintr-un numar de corpuri (elemente) la starea de echilibru termodinamic fiecare element component al sistemului va acumula o parte din energia totala acumulata in intregul sistem. Pentru o anumita stare exista o anumita distributie a energiei intre diferitele elemente componente ale sistemului. Orice modificare a acestei distributii modifica starea de echilibru asociata a sistemului.
Al doilea postulat al termodinamicii
Starea de echilibru termodinamic poate fi
caracterizata pentru un sistem prin valorile unui numar de parametri
de stare externi si in mod obligatoriu prin valorile unui parametru intern
ce caracterizeaza starea de echilibru intern a sistemului. Acest parametru
se numeste temperatura, iar ecuatia ce descrie starea de
echilibru termodinamic poate fi de forma: ![]() unde
unde ![]() sunt parametri de stare externi.
sunt parametri de stare externi.
Proprietatile temperaturii:
- Temperatura poate fi definita pentru un anumit sistem termodinamic numai la starea de echilibru. Exista procese care evolueaza intr-un timp foarte scurt (procese de ardere, reactii chimice violente) pentru a caror caracterizare se introduc doua ipoteze conceptuale si care fundamenteaza structurarea termodinamicii. In sensul termodinamicii clasice se considera ca procesele sunt decuplate de timp, adica variatia presiunii sau temperaturii intr-un sistem se realizeaza printr-un numar suficient de mare de stari de echilibru intermediare. Aceste procese se numesc procese cvasistatice. Notiunea de echilibru local. Un sistem termodinamic poate fi considerat ca fiind compus dintr-un numar de subsisteme ce delimiteaza volume in care se poate defini un echilibru termodinamic local. De obicei volumul minim la care se poate defini echilibrul pentru sisteme continue este ca acestea sa contina 1023 particule.
- Temperatura poate fi definita numai pentru sisteme macroscopice. Nu se poate defini temperatura unei molecule sau a unui atom. Numarul acestor particule trebuie sa fie 1023.
5) Ecuatia termica de stare
Numarul minim de parametri de stare necesari pentru a descrie starea de echilibru pentru un sistem format din "i" corpuri este de "i+1".
Pentru un corp parametrii de stare sunt:
- presiunea;
- volumul;
- temperatura.
![]()
in termodinamica se foloseste volumul specific - volumul unui corp cu masa de 1 kg.
![]()
![]()
![]()
![]()
![]()
![]()
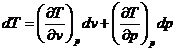
Consideram ca sistemul sufera o
transformare izocora astfel incat ![]() atunci:
atunci:
![]()
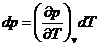
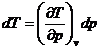
![]()
Consideram ![]()
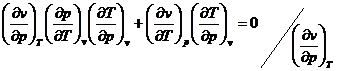
![]()
Vom numi
dilatatie termica termenul notat cu ![]() ,
, ![]() unde
unde ![]() este volumul specific al sistemului considerat la o stare de
referinta. De cele mai multe ori starea de referinta
corespunde asa numitelor conditii normale.
este volumul specific al sistemului considerat la o stare de
referinta. De cele mai multe ori starea de referinta
corespunde asa numitelor conditii normale.
Conditiile normale se caracterizeaza prin:
Temperatura - 0oC
Presiunea - 1 atm = 101325 Pa
Vom numi tensiune
termica termenul notat ![]()
Vom numi
compresibilitate termica ![]()
Inlocuind in ultima relatie rezulta:
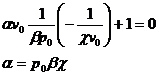
In modelarea oricarui sistem termodinamic prima componenta a modelului este ecuatia termica de stare. Aceasta ecuatie exprima relatia intre parametrii de stare la starea de echilibru termodinamic si permite transcrierea in forma matematica a proprietatilor unui sistem si a dependentei dintre proprietati.
Observam ca pe baza ecuatiei identice de stare se pot defini relatii intre diferite marimi ce pot fi masurate experimental astfel incat sa se obtina o modalitate de verificare a rezultatelor.
6) Forme ale energiei in sisteme termomecanice. Lucru mecanic
Energia, in sensul cel mai general, este o masura a capacitatii de miscare acumulata intr-un sistem termodinamic.
Miscarea poate fi definita atat la nivel macroscopic cat si la nivel microscopic.
La nivelul microscopic este cunoscut faptul ca particulele care constituie un sistem termodinamic efectueaza in mod permanent o miscare de vibratie suprapusa peste o miscare haotica datorata ciocnirilor cu celelalte particule.
Miscarea la nivel microscopic se mai numeste si agitatie moleculara si se poate realiza o corelatie intre starea de agitatie moleculara si temperatura corpului. Orice aport de energie realizandu-se la nivel microscopic prin cresterea agitatiei si transmiterea din aproape in aproape intre microparticule.
La nivelul macroscopic se poate considera ca miscarea este o miscare ordonata a elementelor componente ale unui sistem termodinamic. Masurarea energiei la nivel macroscopic in sistemele termodinamice se numeste lucru mecanic.
![]()
![]()
![]()
![]()
![]()
![]()
Lucrul mecanic de dislocare
![]()
![]() este o marime de stare si admite
diferentiala totala exacta acre poate fi scrisa sub
forma:
este o marime de stare si admite
diferentiala totala exacta acre poate fi scrisa sub
forma:
![]()
Lucrul mecanic tehnic
![]()
Acest lucru mecanic se compune din lucrul mecanic la intrare in sistem, lucrul mecanic propriu-zis si lucrul mecanic la iesire din sistem
In functie de complexitatea sistemelor termomecanice la nivel macroscopic pot interveni suplimentar componente legate de energia potentiala a sistemelor sau energia cinetica a sistemelor in raport cu diferite sisteme de referinta fata de care se studiaza sistemele in cauza. De multe ori sistemele termomecanice se cupleaza cu sisteme electrice, chimice sau de alta natura.
In cazul unor astfel de cuplaje in sisteme se pot considera si termeni legati de energia electrica sau alte forme de energie care intervin.
7) Forme ale energiei in sisteme termomecanice. Caldura
Caldura reprezinta o masura a energiei transferate la nivel macroscopic. Prin definitie caldura este acea forma a energiei care se transmite in prezenta unei diferente de temperatura existand doar atata timp cat exista aceasta diferenta de temperatura.
Transferul de energie sub forma de caldura catre un sistem are ca efect modificarea proprietatilor sistemului. Acea parte a termodinamicii care studiaza aceste procese se numeste calorimetrie.
Calorimetria opereaza cu o marime
fundamentala numita caldura specifica ![]() si reprezinta capacitatea unui corp de a prelua
energie sub forma de caldura ducand la cresterea
temperaturii cu o valoare dT astfel:
si reprezinta capacitatea unui corp de a prelua
energie sub forma de caldura ducand la cresterea
temperaturii cu o valoare dT astfel:
![]() , unde
, unde ![]()
![]()
Formula fundamentala din calorimetrie
![]()
![]()
In general caldura specifica este o
functie de temperatura. Dependenta dintre "c" si "T" este
nelimitata. Pentru anumite tipuri de materiale simple se poate considera ![]() unde a si b sunt
constante ce depinde de natura substantei.
unde a si b sunt
constante ce depinde de natura substantei.

![]() = media variatiei caldurii specifice de la 0 la T2
= media variatiei caldurii specifice de la 0 la T2
Capacitatea calorica
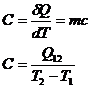
Caldura molara (CM)
![]()
M = masa molara
![]()
Caldura specifica volumica ![]()

Caldura specifica raportata la ![]()
![]()
Atunci cand operam cu modelul de gaz perfect:
![]() (constanta gazului)
(constanta gazului)
![]() (constanta universala a gazului perfect)
(constanta universala a gazului perfect)
![]() (exponentul adiabatic al gazului)
(exponentul adiabatic al gazului)
Pentru un corp oarecare:
![]()
8) Principiul I al termodinamicii (echivalenta dintre L si Q, enunt, energie interna, entalpie)
![]()
![]() = echivalent mecanic al caloriei
= echivalent mecanic al caloriei
![]() = 4,1855 J
= 4,1855 J
O kcal reprezinta caldura necesara pentru a ridica temperatura apei pentru fiecare kg de la temperatura de 14,5oC la 15,5oC.
![]()
Energie interna. Prin definitie energia interna reprezinta suma energiilor cinetice si potentiale ale corpurilor si particulelor ce alcatuiesc un sistem termodinamic inchis.
Principiul I al termodinamicii
Intr-un sistem termodinamic energia se transforma dintr-o forma in alta dar suma tuturor formelor de miscare exprimate in echivalentul lor energetic este constanta.
In forma diferentiala acest
lucru se poate exprima prin relatia:![]()
in marimi specifice: ![]()
![]()
![]()
in forma integrala:
![]()
![]()
unde:
![]() = variatia energiei cinetice a sistemului
= variatia energiei cinetice a sistemului
![]() = variatia energiei potentiale a sistemului
= variatia energiei potentiale a sistemului
O alta forma a Principiului I al termodinamicii (valabila pentru motoare termice)
Intr-un sistem termodinamic nu se poate obtine sau produce lucru mecanic fara a se consuma energie sub forma de caldura sau fara modificarea energiei cinetice sau potentiale a sistemului. Este imposibil sa se obtina un perpetum mobile de speta I.
Entalpia este suma dintre energia interna
a sistemului raportat la un volum de control si lucrul mecanic de
dislocare: ![]()
9) Consecinte ale Principiului I al termodinamicii. Metoda bilantului termic
Variatia energiei continute in sistem este egala cu diferenta dintre caldura neta transformata in sistem si lucrul mecanic net efectuat de sistem.
![]()
![]() , unde:
, unde:
E este energia totala din sistem ca suma a energiei cinetice, potentiale si interne a sistemului.
Tinand seama si de variatia in timp a energiei schimbate de sistem sub diferite forme se poate scrie:
![]()
![]()
![]()
![]()
unde: ![]() - energia interna
specifica la intrare intr-un sistem
- energia interna
specifica la intrare intr-un sistem
![]() - presiunea si volumul in punctele 1 si 2
- presiunea si volumul in punctele 1 si 2
![]() - vitezele medii ale agentului termodinamic in
sectiunile 1,2
- vitezele medii ale agentului termodinamic in
sectiunile 1,2
![]() - coordonatele verticale ale punctelor 1 si 2
fata de un nivel de referinta
- coordonatele verticale ale punctelor 1 si 2
fata de un nivel de referinta
![]() - acceleratia gravitationala
- acceleratia gravitationala
![]() - lucru mecanic si caldura la intrarea in sistem
- lucru mecanic si caldura la intrarea in sistem
![]() - lucru mecanic si caldura la iesire din sistem
- lucru mecanic si caldura la iesire din sistem
10) Consecinte ale Principiului I al termodinamicii. Analiza ciclurilor
In cazul sistemelor care evolueaza in mod ciclic se aplica metoda ciclurilor. Astfel considerand ca evolutia unui sistem termodinamic porneste dintr-o stare initiala, parcurge mai multe transformari si revine in starea initiala.
Datorita faptului ca starea 2 se confunda cu starea 1 energia totala pe ciclu este egala cu 0.
![]()
in general sistemele termomecanice se clasifica in:
- masini (sisteme) termomecanice al caror scop este sa produca lucru mecanic - masini termice
pentru a analiza eficienta sistemului
termomecanic (motorului termic) se introduce notiunea de randament termic
ca fiind raportul: ![]()
- generatoarele termice, al caror scop este de a transfera caldura de la o sursa rece la o sursa calda
Atunci cand scopul sistemului este de a maximiza caldura preluata de la sursa rece sistemul se numeste instalatie frigorifica.
Atunci cand scopul sistemului este de a maximiza caldura transferata sursei calde (q1) sistemul se numeste pompa de caldura
![]()
![]() , unde
, unde ![]() - eficienta frigorifica
- eficienta frigorifica
![]() , unde
, unde ![]() - eficienta pompei
- eficienta pompei
11) Modelul de gaz perfect. Ipoteze, ecuatia termica de stare
Ipoteze:
- particulele ce compun gazul sunt molecule sferice, perfect elastice, stabile din punct de vedere chimic si care au un volum neglijabil;
- datorita distantei foarte mari dintre particule, se considera ca lipsesc fortele de coeziune, iar interactiunile mecanice dintre particule se reduc la ciocniri perfect elastice;
absenta fortelor de coeziune conduce la lipsa vascozitatii;
faptul ca volumul particulelor este neglijabil duce la faptul ca modelul nu se poate aplica in procesele de lichefiere deoarece atunci cand temperatura tinde catre 00K, volumul tinde catre 0.
- caldurile specifice la presiune si volum constant sunt constante exista situatii in care se poate considera ca aceste gaze depind de temperatura - aceste gaze se numesc semiperfecte.
Ecuatia termica de stare:
![]() , unde:
, unde:
R = constanta gazului
V = volum specific
![]()
In forma diferentiala:
![]()
12) Modelul de gaz perfect. Legea transformarii politropice.
Transformarea politropica este transformarea in care sistemul termodinamic schimba cu mediul inconjurator atat caldura cat si lucru mecanic.
![]() - ecuatia
termica de stare pentru gazul ideal
- ecuatia
termica de stare pentru gazul ideal
![]()
![]() ;
; ![]()
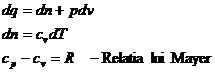
![]()
![]()
![]()
![]()
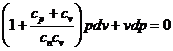
![]() - Legea transformarii politropice
- Legea transformarii politropice
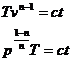
![]()
![]()
![]()
![]()
13) Modelul de gaz perfect. Calculul L,Q, U,H in transformarea politropica
Prin definitie:
![]()
![]()
![]()
![]()
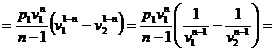
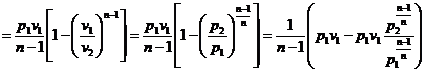
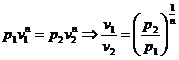
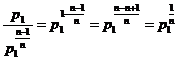
![]()
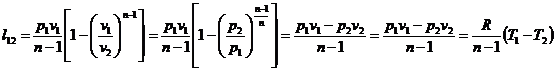
![]()
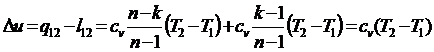
![]()
![]()
14) Amestecuri de gaze perfecte
In cazul amestecurilor de gaze perfecte se considera ca sistemul este format tot din particule punctiforme stabile din punct de vedere chimic, doar ca masa moleculara a particulelor difera. In cazul amestecurilor se considera ca particulele de acelasi fel (de aceeasi masa moleculara) formeaza impreuna componenta "i" a amestecului. Presiunea partiala a particulelor gazului sau componentei "i" din amestec se determina considerand ca si cand aceste particule ar ocupa singure volumul ocupat de intregul amestec. In consecinta, presiunea particulelor care formeaza componenta "i" se numeste presiunea partiala a componentei "i" (pi).
Pamestec = Σpi - Legea lui Dalton
Pentru a putea caracteriza amestecurile de gaze perfecte se introduce notiunea de paerticipatie.
Def. Participatia masica a
componentei "i"  unde:
unde:
![]() - numarul de moli ai componentei "i"
- numarul de moli ai componentei "i"
![]() - participatie molara
- participatie molara
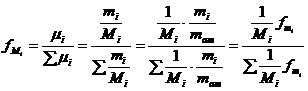
Participatie volumica: ![]()
![]() volum molar = ct
volum molar = ct
Masa moleculara aparenta: 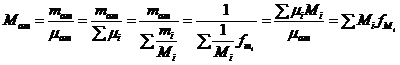
Constanta unui amestec
Ecuatiile de stare pentru fiecare componenta a amestecului:
![]()
![]() insumam dupa
i:
insumam dupa
i:
![]()
Consideram ca pentru amestec se poate scrie o expresie a ecuatiei de stare de forma:
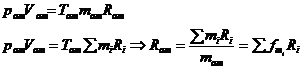
15) Cauzele ireversibilitatii proceselor termodinamice
Orice proces termodinamic presupune trecerea sistemului de la o stare initiala 1 la una finala 2, cele doua stari fiind stari de echilibru termodinamic.
Pe parcursul transformarii apar o serie de fenomene care contribuie la ireversibilitatea procesului de transformare.
Se numeste proces reversibil, procesul care derulandu-se de la o stare initiala 1 la una finala 2 prin parcurgerea unor stari intermediare, permite revenirea sistemului la starea initiala, parcurgand in sens invers aceleasi stari intermediare.
Cauzele
- O prima cauza a ireversibilitatii proceselor termodinamice o constituie frecarea. In natura frecarea are doua forme:
- frecare columbiana (de suprafata);
- frecare interna (intre particulele care constituie sistemul);
Cauza histerezisului o constituie neliniaritatea proprietatilor materialelor in general.
- A doua cauza a ireversibilitatii proceselor termodinamice o reprezinta neliniaritatea proprietatilor materialelor.
Presupunem ca avem un gaz aflat intr-un cilindru si inchis cu un piston. Adaugand o greutate m deasupra pistonului se realizeaza o reducere a volumului Δv. In procesul de comprimare gazul se incalzeste de la o temperatura initiala T0 la o temperatura finala T1>T0. Temperatura T0 se transfera catre mediu caldura Q12. Dupa un timp daca luam masa m de pe piston ne asteptam ca pistonul sa revina la pozitia initiala. In tendinta de ridicare a pistonului are loc o destindere dv care determina o racire a gazului astfel incat se asteapta un transfer de caldura de la mediu catre gaz Q21.
Datorita faptului ca in procesele de transfer diferentele de temperatura sunt finite Q21 nu este egal cu Q12, deci pistonul nu va reveni la pozitia initiala.
16) Ciclul Carnot
Ciclul Carnot consta intr-un numar de 4 transformari simple (2 transformari izoterme si 2 transformari adiabate) si principala ipoteza simplificatoare consta in faptul ca diferenta de temperatura dintre agent si sursele de caldura este o diferenta infinitezimala.
a)
1-2 destindere izoterma ; se realizeaza lucrul mecanic L![]() , consumandu-se caldura Q
, consumandu-se caldura Q![]()
![]()
SC = sursa calda
SR = sursa rece
![]() = cantitate infinitezimala suficienta pentru a
permite transferul de caldura, dar destul de mica astfel incat
sa poata fi considerata neglijabila
= cantitate infinitezimala suficienta pentru a
permite transferul de caldura, dar destul de mica astfel incat
sa poata fi considerata neglijabila
2-3 destindere adiabatica ; se produce L![]()
Conditia pentru obtinerea unei transformari adiabatice este ca incita in care se afla gazul sa fie izolata adiabatic (sa nu permita transfer de caldura) ceea ce este o ipoteza teoretica.
3-4 transformare izoterma; consum de lucru mecanic L![]() si un transfer
de caldura Q
si un transfer
de caldura Q![]() catre o sursa rece
catre o sursa rece
![]()
4-3 comprimare adiabatica; consumul de L![]()
Se observa ca o masina termica pentru a putea produce lucru mecanic util trebuie sa parcurga un numar de transformari in sens orar. Din acest motiv, ciclurile motoare pot fi recunoscute dupa sensul orar de parcurgere a ciclului.
![]() =
=![]() L
L![]() = lucru mecanic
util
= lucru mecanic
util ![]() = randament
= randament
Q![]() = caldura consumata
= caldura consumata
Datorita ipotezei ca diferenta de temperatura este infinitezimala, masina care functioneaza dupa ciclul Carnot este o masina reversibila
b) Transformarile 4-3 si 2-1 sunt transformari izoterme
Transformarile 1-4 si 3-2 sunt transformari adiabatice
4-3 transformare care se
realizeaza la temperatura T![]() = ct (destindere izoterma)
= ct (destindere izoterma)![]()
Pe parcursul acestei destinderi se efectueaza lucru mecanic L![]() si se preia caldura Q
si se preia caldura Q![]() de la sursa calda
de la sursa calda
2-1 comprimarea izoterma
la temperatura TI = ct ![]()
Pe parcursul comprimarii izoterme se consuma lucru mecanic L![]() si se evacueaza caldura Q
si se evacueaza caldura Q![]() .
.
In acest fel, ciclul Carnot invers permite preluarea caldurii de la o sursa rece si transferarea acesteia la o sursa calda. Din acest motiv, ciclul acesta se numeste si ciclul generator sau ciclul pentru masini termice generatoare.
Ex. instalati frigorifice la care scopul il constituie prelucrarea caldurii de la o sursa rece si transferarea catre o sursa calda.
Instalarile frigorifice se caracterizeaza din punct de vedere termodinamic cu ajutorul eficientei frigorifice
e![]() =
=![]() Q
Q![]() =caldura evacuata de la sursa rece
=caldura evacuata de la sursa rece
L![]() =lucru mecanic consumat pe ciclu
=lucru mecanic consumat pe ciclu
Se observa ca un ciclu generator este parcurs in sens antiorar sau trigonometric care este o modalitate de a distinge ciclurile generatoare
17) Masina termica endoreversibila
Masina termica endoreversibila este modelul de masina termica la care ireversibilitatile sunt determinate de conexiunile cu mediul exterior .
Mai exista 2 surse t1,t2 care sunt conexate prin legaturile inreversibile astfel incat masina initiala formata din cele 2 surse t3,t4 este o masina reversibila , iar ireversibilitatile au fost transferate catre conexiunile cu exteriorul.
Un astfel de model este curzon -Ahlborn-Novikov.
![]() (*
(* ![]() pentru masina initiala
pentru masina initiala
![]() este transferata de la sursa T1 la sursa T3 ; acest transfer depinde de def initia de temparatura
este transferata de la sursa T1 la sursa T3 ; acest transfer depinde de def initia de temparatura
![]()
![]() indice de proportionalitate .
indice de proportionalitate .
![]() acesta
formula e data de legea transferului de
caldura :
acesta
formula e data de legea transferului de
caldura :![]()
![]()
![]() (**)
(**)
Din (*) si
(**) ![]()
![]()
Similar :![]()
Notam :
![]()
![]()
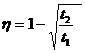
18) Teorema lui Carnot - Principiul al II-lea al termodinamicii
19) Entropia
Notiunea de entropie este definita pe baza notiunii de probabilitate a starilor astfel incat sistemul termodinamic evolueaza in procesele reale (ireversibile) de la stari mai putin probabile catre stari mai probabile.
![]()
Fie doua sisteme termodinamice cu ![]()
Presupunem ca: ![]() (aditivitate)
(aditivitate)
![]()
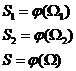
![]() derivam:
derivam:
- in functie de ![]() :
: ![]()
- in functie de ![]()
![]()
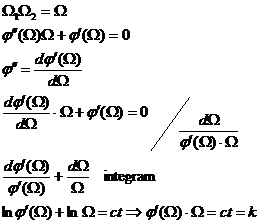
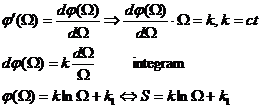
![]()
![]() - Formula lui Boltzman
- Formula lui Boltzman
k - constanta lui Boltzman, k = 1,38 10-23 J/K
Ω - probabilitatea de existenta a unei anumite stari pentru un sistem considerat.
20) Functii si potentiale termodinamice - energia interna
Se numeste functie termodinamica o functie definita la starea de echilibru termodinamic sau asociata unor transformari reversibile din care se pot obtine prin derularea ecuatii termice sau ecuatii calorice de stare.
Prin ecuatia termica de stare se intelege o relatie definita la starea de echilibru termodinamic intre parametrii de stare si datorita postulatului II al termodinamicii intre parametrii de stare se include in mod obligatoriu si temperatura.
O ecuatie calorica de stare este o relatie de dependenta intre marimile calorice care intervin in procese reversibile sau caracterizeaza din punct de vedere energetic un sistem termodinamic la starea de echilibru. In randul marimilor calorice : energia interna, entalpia,.. .
Principalele functii termodinamice folosite in modelarea si analiza sistemului termodinamic sunt:
energia interna
entalpia
entropia
energia libera
entalpia libera
exergia
Atunci cand valoarea functiei termodinamice tinde catre un minim la starea de echilibru termodinamic, ea se numeste potential termodinamic (energia libera si entalpia libera).
Energia interna
functie termodinamica introdusa cu ajutorul principiului I al termodinamicii
reprezinta suma energiilor cinetice si potentiale a particulelor ce alcatuiesc un sistem termodinamic.
In sens general, energia interna poate sa includa fluxuri termodinamice si potentiale chimice in cazul in care sistemul include subsisteme si componente reactive sau care parcurg transformari de faza. In cazul in care sistemul include subsisteme si componente reactive sau care parcurg transformari de faza in cazul in care sistemul termodinamic e alcatuit dintr-un singur corp omogen, energia specifica ce poate fi scrisa in functie de temperatura si volum.
u = u(T,v) u = variatia energiei interne
u - admite diferentiala totala exacta
![]()
Putem defini notiunea de
caldura specifica la volum constant ca fluid ![]()
Din principiul I si II :
![]()
q = caldura schimbata de sistemul termodinamic
s = entropia specifica
![]()
![]()
![]()
![]()
![]()
![]()
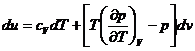
Integrand in lungul unei izoterme dT=o
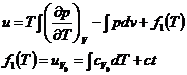 valoarea energiei
interne pentru V
valoarea energiei
interne pentru V![]() O ca functie de T
O ca functie de T
![]()
limitele de integrala sunt starea initiala si starea finala
v0 - folosit ca termen initial in vederea integrarii
Caldura
specifica ![]() depinde de valoarea izotermei in lungul careia se face
integrarea. In vederea determinarii variatiei energiei interne este
necesar sa se cunoasca ecuatia termica de stare si
caldura specifica
depinde de valoarea izotermei in lungul careia se face
integrarea. In vederea determinarii variatiei energiei interne este
necesar sa se cunoasca ecuatia termica de stare si
caldura specifica ![]() .
.
Energia interna e folosita pentru a caracteriza sistemele termodinamice inchise (care nu schimba substanta cu mediul inconjurator). Ex. un volum de gaz inchis intr-un recipient, un aliaj topit intr-o lingotiera.
21) Functii si potentiale termodinamice - entalpia
In vederea caracterizarii sistemelor termodinamice deschise se foloseste functia termodinamica numita entalpie.
![]()
Consideram un sistem tot deschis monofizic si omogen. In acest sistem pentru definirea entalpiei functiei de presiune si T astfel incat putem scrie:
h=h(p,t)
![]()
Prin definitie , termenul ![]() caldura specifica la presiune constanta
caldura specifica la presiune constanta
![]()
(Variatia entalpiei se poate determina numai pe baza masurarilor asupra acestor parametrii care sunt masurabili)
Integrand de-a lungul unei izoterme incepand de la p=0
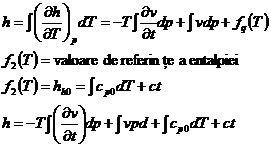
![]() cpo- = depinde de natura substantei si
de temperatura izotermei in lungul careia se face integrarea
cpo- = depinde de natura substantei si
de temperatura izotermei in lungul careia se face integrarea
ct- depinde de valoarea de referinta a entalpiei h0
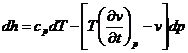 - expresia de referinta pentru
calculul variatiei entalpiei in cazul sistemelor termodinamice deschise
- expresia de referinta pentru
calculul variatiei entalpiei in cazul sistemelor termodinamice deschise
22) Functii si potentiale termodinamice - entropia
a fost introdusa cu ajutorul principiului II al termodinamicii
e o masura a ireversibilitatii unui proces termodinamic
Din punct de vedere fizic, entropia se defineste ce fiind o functie ce depinde de posibilitatea unei anumite stari pentru un sistem termodinamic si in sensul de functie parcurgem etapele:
Din principiul I si II :
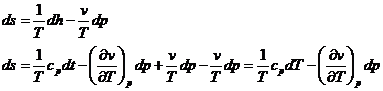
Integrand de-a lungul unei izoterme obtinem :
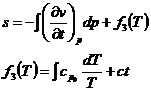
In evolutia sistemului termodinamic, pentru a analiza schimbul de energie al sistemului cu mediul inconjurator, variatia entropiei nu are o relevanta directa. Calculul variatiei entropiei intereseaza atunci cand dorim sa determinam gradul de ireversibilitate al unui proces si atunci cand in sistemul termodinamic apar o serie de modificari de faza cum ar fi solidificarea unui aliaj sau vaporizarea unui lichid.
23) Functii si potentiale termodinamice - energia libera
(Helholtz)
Valoarea ei tinde la minim atunci cand se atinge starea de echilibru termodinamic. De aceea, ea se mai numeste si potential Helmholtz.
Prin definitie, energia libera reprezinta acea parte a energiei interne a unui sistem termodinamic care se poate transfera integral in lucru mecanic. Energia libera se defineste pentru sisteme termodinamice inchise si in cazul unor sisteme complexe poate sa includa si o serie de alti termeni cum ar fi energiile cinetice si potentiale macroscopice ale subsistemelor componente, fluxurile termodinamice in cazul unor sisteme aflate in evolutie sau energiile de reactie in cazul unor sisteme reactive.
Energia libera este foarte des utilizata in modelarea proceselor de solidificare a aliajelor topite (aliaje turnate in lingotiere), poate fi folosita in modelarea proceselor de sudare (procese in care are loc turnarea si apoi solidificarea astfel incat punandu-se conditia de minim in vederea atingerii starii de echilibru se pot determina conditiile de presiune, temperatura care trebuie asigurate sistemului.
![]()
In cazul unui sistem termodinamic izolat monofazic si omogen, energia se defineste ca o functie de volum si temperatura
![]()
Din principiile I si II ale termodinamicii:
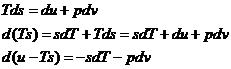
 derivam
derivam 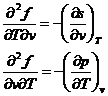 rezulta
rezulta ![]()
Cu ajutorul energiei libere putem determina, prin derivare, valoarea energiei interne si a entalpiei.
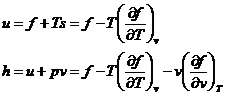
Variatia energiei libere
![]()
![]() este energie legata (nu poate fi folosita)
este energie legata (nu poate fi folosita)
![]() (conditia de
minim)
(conditia de
minim) ![]() (conditia de
echilibru)
(conditia de
echilibru)
24) Functii si potentiale termodinamice - entalpia libera
(Gibbs)
Pentru sisteme termodinamice deschise se introduce notiunea de entalpie libera. Se numeste potential Gibbs. Aceleasi proprietati ca si energia libera cu exceptia ca avem de-a face cu sisteme termodinamice deschise.
![]()
Pentru un sistem monofazic omogen deschis, luand in considerare un volum de control.
![]()
![]()
![]()
![]()
![]()
Pentru un sistem deschis (un fluid care curge), daca se cunoaste expresia entalpiei libere se poate determina entalpia h cu relatia:
![]()
Energia interna aferenta partii din sistem care se afla in volumul de control:
![]()
cand ![]() sau
sau ![]()
25) Exergia
Unul din principiile termodinamicii consta in: lucrul mecanic pe care il poate produce o masina termica se poate obtine numai prin procese reversibile. Acest fapt vine in completarea principiului I.
![]()
pdv = termen pentru L
Ireversibilitatea micsoreaza lucrul mecanic tehnic prin cota parte pierduta pentru compensarea cresterii de entropie.
Evident, intrebarea care a framantat orice inginer: care este lucrul mecanic maxim posibil a fi obtinut prin destinderea unui agent termodinamic?
Raspuns: L max posibil se poate obtine atunci cand procesul reversibil aduce agentul de lucru in echilibru termodinamic cu mediul ambiant.
Fie un sistem deschis ![]()
In pct. 1 avem urmatorii parametri:
z![]() = pozitia fata de un nivel de
referinta
= pozitia fata de un nivel de
referinta
w![]() = viteza
= viteza
h![]() = entalpia specifica
= entalpia specifica
s![]() = entropia specifica
= entropia specifica
p![]() = presiunea
= presiunea
Pentru a fi adus in echilibru cu mediul
ambiant, se parcurge o transformare
adiabata (izentropica) pana la T![]() .
.
z![]() =coord. ag. Termodinamic la iesire din agregat
=coord. ag. Termodinamic la iesire din agregat
s![]() =entropia ag. In
echilibru termodinamic cu mediul ambient
=entropia ag. In
echilibru termodinamic cu mediul ambient
h![]() =entalpia ag la echilibru cu mediul ambient
=entalpia ag la echilibru cu mediul ambient
![]()
![]()
Transformarea 2-a va fi tranformare izoterma

![]() = caldura
cedata mediului pe intreaga transformare compusa 1-2-a.
= caldura
cedata mediului pe intreaga transformare compusa 1-2-a.
Daca consideram ca la
iesire din agregat agentul termodinamic ajunge la o viteza w![]() = 0
= 0
![]()
Observatii:
Prin destinderea agentului termodinamic printr-un proces reversibil pana la echilibru cu mediul inconjurator, energia cinetica si potentiala se transforma integral in lucru mecanic. Dar entalpia trebuie sa acopere caldura izotermica care este cedata mediului ambiant.
Fiind o transformare
deschisa, variatia entropiei S![]() - S
- S![]() > 0, deci atingerea echilibrului termodinamic se poate
face prin evacuarea sau introducerea de caldura in sistem.
> 0, deci atingerea echilibrului termodinamic se poate
face prin evacuarea sau introducerea de caldura in sistem.
l![]()
![]() nu este o marime de stare, dar daca se
fixeaza starea mediului ambiant prin anumite valori ale marimilor de
stare poate deveni o cvasi marime de stare.
nu este o marime de stare, dar daca se
fixeaza starea mediului ambiant prin anumite valori ale marimilor de
stare poate deveni o cvasi marime de stare.
La propunerea lui Fr. Bosnjakovik si L. Rant :
![]() = exergie
= exergie
La propunerea lui Rant:
![]() = anergie
= anergie
![]() = entalpie libera
= entalpie libera
Observatii:
1) Exergia coincide cu entalpia libera daca starea sistemului considerat ajunge la sfarsitul procesului in echilibru termodinamic cu mediul inconjurator.
2) Anergia reprezinta energia legata minima care se cedeaza mediului ambiant dupa ce un agent termodinamic ajunge in echilibru cu acesta.
3)Exergia este echivalenta cu l![]() numai pentru sistemul care lucreaza fara
variatie de energie cinetica si potentiala.
numai pentru sistemul care lucreaza fara
variatie de energie cinetica si potentiala.
Concluzia
Exergia nu se conserva deoarece fiecare proces ireversibil distruge exergia prin lucru mecanic disipativ, corespunzator cresterii respective de entropie.
Notiunea de exergie se introduce in urmatoarele conditii:
- proces - reversibil
- deschis sau stationar
(Exista si posibilitatea de a defini exergia si pentru sisteme inchise)
- schimbul termic trebuie sa se
produca numai la temperatura T![]() a mediului ambiant
a mediului ambiant
- starea finala a sistemului trebuie sa ajunga in echilibru termodinamic cu starea mediului ambiant.
Pe baza principiului al II-lea al
termodinamicii se poate introduce si notiunea de randament exergetic
care reprezinta raportul dintre exergia tuturor produsilor utili
raportata la exergia tuturor agentilor si produsilor care
intra in agregat. ![]()
26 Analiza energetica. Termoeconomia
Analiza subproceselor
Arderea combustibilului : ![]() II=0,783
II=0,783
Transferul de caldura : ![]() II= 0,457 (de la gasele arse la ag)
II= 0,457 (de la gasele arse la ag)

Pe baza analizei exergetice, se poate realiza si o analiza economica, la care exergia diversilor agenti termodinamici si a diferitelor materiale se poate exprima in costuri. Astfel, pentru fiecare material din care se realizeaza agregatele, se stabilesc, in functie de procesele tehnologice sau industriale in baza carora sunt obtinute, valoarea exergiei.
De asemenea, se stabilesc costuri echivalente, de obicei in $, pentru diferite materiale si agregate, ceea ce permite ca sa se transpuna intregul bilant exergetic pe agregat in echivalentul sau valori.
De obicei, costurile se impart in:
- costuri de investitii (de capital) = costurile de fabricatie si montare ale tuturor
27) Principiul al III-lea al termodinamicii
A aparut din necesitatea calcularii valorii absolute a afinitatii chimice (capacitatea substantelor de a reactiona chimic intre ele)
![]()
![]()
![]()
Studiind comportarea
substantelor la temperaturi joase pe baza unui bogat material experimental, Nernst
a stability ca diferenta![]() este o marime care descreste mai repede decat
liniar cu temperatura pentru ca
este o marime care descreste mai repede decat
liniar cu temperatura pentru ca
![]() sau
sau
![]()
![]()
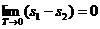
Deci cand T![]() 0, entropia sistemului nu mai poate fi modificata prin
nici o actiune.
0, entropia sistemului nu mai poate fi modificata prin
nici o actiune.
Planck
Cand T![]() 0, atunci S
0, atunci S![]() 0 izoterma de zero absolut coincide cu adiabata de
zero
0 izoterma de zero absolut coincide cu adiabata de
zero
La ![]() K, un sistem se afla in echilibru intr-o stare bine
determinata cu energie minima
K, un sistem se afla in echilibru intr-o stare bine
determinata cu energie minima
![]()
![]() = probabilitatea starii
= probabilitatea starii
Consecinta 1
![]()
Pe baza principiului al III-lea al termodinamicii se poate calcula valoarea
entropiei la o anumita temperatura luand in considerare faptul
ca la ![]()
Consecinta 2 :
![]() cand T
cand T![]()
![]() coeficientul de dilatare termica
coeficientul de dilatare termica
![]() coeficientul de tensiune
coeficientul de tensiune
![]() cand
cand
![]()
Consecinta 3
Sa presupunem ca folosim o instalatie frigorifica. Incercam sa
micsoram temperatura unui agent termodinamic in vederea atingerii
unei temperaturi![]()
Pentru a micsora temperatura agentului termodinamic de la la ![]() , masina frigorifica transfera catre
mediul inconjurator caldura
, masina frigorifica transfera catre
mediul inconjurator caldura ![]() si
micsoreaza entropia agentului de la s1 la s2.
si
micsoreaza entropia agentului de la s1 la s2.
Presupunem ca avem ca tinta sa atingem de la o temperatura oarecare Tn-1 la Tn.
![]()
In sensul
principiului al III-lea al ternodinamicii, atunci cand ![]() . Dar din punct de vedere practic, atata timp cat
. Dar din punct de vedere practic, atata timp cat ![]() au valori finite este imposibil sa se atinga starea ce corespunde lui T=0
au valori finite este imposibil sa se atinga starea ce corespunde lui T=0
Forma echivalenta a principiului 3 al termodinamicii
Este imposibil ca
printr-un numar de transformari finite sa se ajunga la
temperatura de ![]() K.
K.
28) Agentul termodinamic
29) Modelarea motoarelor cu ardere interna folosind cicluri termodinamice. Motorul in 4 timpi.
Motorul in 2 timpi
Se numeste masina termica un sistem termomecanic in care se realizeaza conversia energiei termice in energia mecanica sau invers. In procesul de conversie a energiei se realizeaza transformarea unui agent termodinamic ce parcurge un numar de transformari termodinamice astfel incat in urma acestor transformari sa rezulte lucru mecanic sau energie termica (caldura).
Din punct de vedere principial exista un numar foarte mare de sisteme termodinamice, dar din punct termodinamic exista:
masini termice motoare - sisteme termomecanice al caror scop este sa produca lucru mecanic;
masini termice generatoare - sisteme termomecanice al caror scop e sa preia o anumita cantitate de caldura de la sursa rece (instalatii frigorifice) sau sa transfere caldura la o sursa calda (pompe de caldura).
Modelarea proceselor termodinamice in masini termice se realizeaza in functie de scopul in care se face modelarea, astfel incat din punct de vedere al preciziei si al volumului de informatie obtinuta se pot defini mai multe nivele ierarhice de modelare:
1) Modelarea folosind ciclurile termodinamice - agentul termodinamic care evolueaza in masina termodinamica se considera ca e un gaz ideal, ca aportul de caldura se realizeaza din exterior fara a se preciza modul prin care se realizeaza aceste aporturi, nu exista pierderi prin neetanseitati si facandu-se abstractie de fenomenul de viscozitate, frecare si dependenta de timp a curgerii fluidelor. Rezultatele obtinute cu acest tip de model se refera in special la estimarea randamentului total al agregatului, al lucrului mecanic ce poate obtinut, a caldurii necesare pentru obtinerea acestui lucru mecanic, a caldurii ce trebuie sa fie evacuata, precum si estimarea valorilor maxime ale unor parametri cum ar fi presiunea si temperatura. Erorile care rezulta folosind acest model sunt erori mari care depasesc uneori chiar 40%, fapt pentru care valorile obtinute trebuiesc comparate si interpretate cu rezultatul experimental.
2) Modelul teoretico experimental - se realizeaza estimarile asupra proprietatilor agentului termodinamic, realizandu-se determinarea experimentala. De asemenea, se determina pierderile prin neetanseitati. Determinarea modulului in care se realizeaza transferul de caldura se estimeaza tot pe cale experimentala, fenomenul de frecare si curgerile nestationare sunt evaluate pe standuri speciale astfel incat modelul teoretico experimental rezultat sa fie cat mai apropiat de conditiile reale. Rezultatele obtinute cu ajutorul acestor modele permit estimarea tuturor parametrilor necesari pentru proiectarea si fabricarea sistemelor termomecanice. Erorile obtinute sunt sub 20%, uneori pot ajunge pana la 5%, dar depind de acuratetea estimarilor experimentale. Volumul imens de date experimentale se pastreaza in baze de date la care accesul este foarte restrans.
3) Se obtine pornind de la sisteme de ecuatie diferentiale care modeleaza procesele de curgere, reactiile chimice, procesele de transfer de caldura, fenomenele mecanice, interactiunile care apar intre agentii termodinamici si sistemele mecanice. Aceste sisteme de ecuatii diferentiale sunt sisteme complexe la care ecuatiile diferentiate au grad > 2 si contin derivate partiale. Conditiile la limita care completeaza setul de ecuatii sunt complexe, tin seama de particule geometrice complexe si fenomene interfata. In consecinta se obtine un modul matematic care nu are de obicei solutie analitica, fapt pentru care se utilizeaza metodele numerice pentru rezolvarea sistemului de ecuatii. Volumul de calcul necesar impune utilizarea de calculatoare cu performante de calcul deosebite (supracalculatoare). De exemplu, estimarile pentru modelarea numerica a proceselor dintr-un motor cu ardere interna constau in necesitatea utilizarii de calculatoare cu puteri de pana la 1012 operatii/sec, care sa lucreze aproximativ 5 pana la 8 saptamani. Rezultatele obtinute cu ajutorul acestor modele depind de precizia algoritmului de calcul, putandu-se ajunge la erori < 2 % .
Modelarea folosind cicluri termodinamice a motoarelor cu ardere interna
Se numeste motor cu ardere interna masina termica motoare la care energia termica se obtine prin arderea combustibililor in interiorul sistemului termomecanic.
In acest scop agentul termodinamic evolueaza ciclic in interiorul unor cilindri sau a unor spatii cu volume variabila (motoare cu ardere interna la care evolueaza intr-un cilindru motoare cilindrice). Masinile termodinamice la care energia termica este obtinuta in afara sistemului termodinamic se numesc masini termice cu ardere externa si necesita existenta unui agregat separat numit arzator, gazele arse sau aburul obtinut in urma arderii fiind introdus in sistemul termomecanic in vederea obtinerii de lucru mecanic.
Ex. turbinele cu gaze sau abur
- sistemul cu cilindru: motorul cu pistoane mobile (motorul Stirling)
1. cilindru inchis de chiuloasa
2. piston
3. biela
4. manivela (maneton)
SA supapa de transmisie
6. bujie
7. tubulatura(colector de admisie)
8. canal prin care sunt introduse gazele
SE supapa de evacuare
10. poarta de evacuare (sunt evacuate gaze arse)
11. galeria de evacuare
12. colector de evaluare
13. corpul motorului
14. sistem de rezemare a arborelui cotit
15. capac la partea inferioara cu ulei de ungere
PMI - punct mort interior
PME - punct mort exterior
Vs - volum generat de capacul pistonului cand se deplaseaza de la PMI la PME
Vo - volum care ramane intre PMI si suprafata chiuloasei
Va - volum maxim pe care in ocupa gazele in cilindru cand se afla la PME.
Timpul 1 al motorului are loc cand PMI la PME, SA este deschisa iar pe diagrama fluidul evolueaza de la punctul a la b.
Timpul 2. comprimarea se obtine cand pistonul se deplaseaza de la PME la PMI, SA si SE sunt inchise, iar fluidul evolueaza de la b la c.
Inainte de a se atinge c se realizeaza aprinderea gazelor in punctul A.
Exista 2 modalitati principale de obtinere a aprinderii:
- aprinderea cu scanteie, amestecul de aer si combustibil din cilindru se aprinde cu ajutorul scanteii produse de dispozitivul fixat pe pozitia 6 numit bujie.
Se numesc motoare MAS (cu aprindere prin scantei)
- injectarea combustibililor in cilindru catre finele comprimarii astfel incat amestecul se autoaprinde datorita conditiilor de presiune si temperaturi favorabile motoare cu aprindere prin comprimare (MAC).
Dupa initierea arderii: punctul A, are loc o crestere violenta a temperaturii si presiunii pana in punctul Z.
Timpul 3 (destindere): deplasarea pistonului de la PMI la PME ce corespunde pe diagrama de la c la d.
Destinderea este singurul timp in care se realizeaza lucrul mecanic pe ciclu.
Timpul 4 (evacuare): deplasarea pistonului de la PME la PMI concomitent cu deschiderea SE.
30) Ciclul MAS
31) Ciclul Diesel
Ipoteze:
Transformari in ciclul Diesel:
1-2: transformare adiabatica unde fluidul din cilindru e comprimat de la volumul V1 (Va pe diagrama) la volumul V2 (V0 pe diagrama).
raportul de comprimare: ![]()
Se realizeaza cu consum de lucru mecanic (L12)
Nu avem transfer de caldura
2-3: transformare izobara care corespunde procesului de ardere din motor; arderea este un transfer de caldura Q2-3 (Q de la o sursa exterioara numita sursa calda)
Este o transformare care corespunde din punct
de vedere fizic cu procesul de injectie a combustibilului in motor
(particularitate). Amestecul de combustibil si aer se realizeaza prin
injectie, astfel in procesul de admisie in cilindru se introduce aer care
este comprimat ulterior (procesul 1-2) ajungand la valori ale presiunii si
temperaturii care permit autoaprinderea combustibilului. Astfel, in procesul
2-3 se injecteaza combustibil sub forma de picaturi
realizandu-se in acest fel concomitent
amestecarea si arderea combustibilului. Din acest motiv, raportul ![]() se numeste
si raport de injectie si se noteaza cu
se numeste
si raport de injectie si se noteaza cu ![]()
![]()
3-4: transformarea adiabatica care corespunde procesului fizic de destindere a gazelor in cilindru
Dupa cum se observa lucrul mecanic care se produce pe ciclu se obtine pe transformarile 2-3 si 3-4
4-1 corespunde procesului de racire izocora; transformare la volum constant pe parcursul careia se transfera caldura Q41 (Q0) catre sursa rece.
Randamentul termic: ![]()
![]() - caldura primita de la sursa calda
- caldura primita de la sursa calda
![]() - caldura cedata sursei reci
- caldura cedata sursei reci
![]()
![]() - racire
- racire
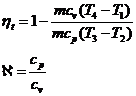
![]()
Din transformarea 1-2 adiabatica:
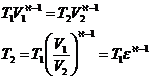
Din transformarea 2-3 izobara: ![]()
Din transformarea 3-4 adiabata:![]()
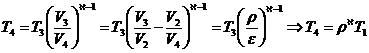
Prin inlocuire rezulta:
![]()
Lucrul mecanic pe ciclu
Din principiul I al termodinamicii:
![]()
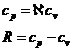
![]()
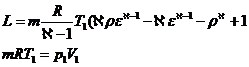
32) Ciclul mixt
Ipoteze:
Agentul termodinamic se considera a fi un gaz ideal
Se face abstractie de pierderile prin neetanseitate
Aportul de caldura in timpul ciclului se considera ca fiind un transfer de caldura de la o sursa exterioara
Caldura care este evacuata se considera ca se transfera unei surse reci, exterioare sistemului
Se face abstractie de frecari
Se considera ca amestecul e omogen si isi pastreaza proprietatile pe tot parcursul ciclului
Parametrii:
![]()
Raport de crestere a presiunilor ![]() (proces de ardere
la volum constant)
(proces de ardere
la volum constant)
![]() raport de
injectie (ardere la presiune constanta)
raport de
injectie (ardere la presiune constanta)
1-2 comprimare adiabatica
2-3 ardere la volum constant
3-4 ardere la presiune constanta
4-5 destindere adiabatica
5-1 racire izocora
Randamentul ciclului: ![]()
![]()
![]()
![]()
![]()
![]()
![]()
Din transformarea 1-2 adiabatica:
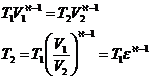
Din transformarea 2-3 izocora:
![]()
Din transformarea 3-4 izobara: ![]()
Din transformarea 4-5 adiabata:![]()

Prin inlocuire rezulta:
![]()
daca ![]()
daca ![]()
33) Notiuni fundamentale legate de propagarea caldurii prin conductie
Camp de temperatura - reprezinta orice puncte omogene dintr-un mediu omogen aflat in echilibru termodinamic la un moment dat, va avea o valoare mica, bine definita. Temperatura este o functie dependenta de pozitie si timp.
![]()
Atunci cand campul de temperatura nu
depinde de timp respectiv ![]() indiferent de valoarea lui
indiferent de valoarea lui ![]() campul de temperatura
se numeste camp stationar. In caz contrar campul se numeste camp
nestationar.
campul de temperatura
se numeste camp stationar. In caz contrar campul se numeste camp
nestationar.
Suprafata izoterma - locul geometric al punctelor in care temperatura are aceeasi valoare. Intr-un camp de temperatura suprafetele izoterme pot fi numai suprafete geometrice (independente de variabila de timp τ. Suprafetele izoterme pot depinde si de timp situatie in care suprafetele izoterme sunt in campuri cu 4 dimensiuni.
Exista si puncte singulare care din punct de vedere matematic sunt suprafete izoterme sferice cu raza → 0
Gradient de temperatura - camp de
temperatura ![]() si doua suprafete izoterme avand temperaturile
T si T+ΔT
si doua suprafete izoterme avand temperaturile
T si T+ΔT
In cazul cel mai general:
dT - diferentiala temperaturii ![]()
Introducem operatorul Hamilton: ![]()
![]() , unde
, unde ![]()
vectorul ![]()
Densitatea de flux termic - cantitatea de caldura care strabate in unitatea de timp unitatea de suprafata izoterma
![]()
Prin metode experimentale se determina Legea lui Fourier: Caldura care strabate un element de suprafata oarecare ds intr-un timp dτ este proportionala cu gradientul de temperatura si are sens contrar acestuia.
![]() , pe directia normala:
, pe directia normala: ![]()
λ - coeficient de proportionalitate
Coeficientul de conductie termica este cantitatea de caldura care traverseaza normal unitatea de suprafata izoterma in unitatea de timp la un gradient de temperatura de 1-----
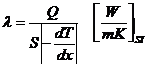
Conductivitatea termica depinde de natura materialului si poate avea valori foarte mici, uneori apropiate de 0, situatie in care materialele sunt izolatoare termice.
In cazul metalelor λ are valoare mai mare de 30 W/mK, putand sa creasca in cazul metalelor foarte bune conductoare termice.
34) Ecuatia diferentiala a conductiei termice
35) Conditii univoce de determinare a problemelor de transfer de caldura
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1425
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved