| CATEGORII DOCUMENTE |
| Aeronautica | Comunicatii | Electronica electricitate | Merceologie | Tehnica mecanica |
LUCRARE DE ABSOLVIRE
METODE ELECTROCHIMICE DE ANALIZA
Argument
Capitolul I
1.Electroliza
1.1Legile electolizei
1.2Electroliza apei
1.3Tensiunea de descompunere
1.4Electroliza topiturilor
Capitolul II
1.Conductibilitatea electrolitilor
2.1Conductibilitatea electrica specifica a electronilor
2.2Conductibilitatea echivalenta a electronilor
2.3electroliti tari si electroliti slabi
2.4Coeficientii de conductibilitate
Capitolul III
1Procese de electrod
3.1Pile electrochimice
3.2Pile de concentratie
Capitolul IV
1Metode electrochimice de analiza..............pag
4.1Electrogarvimetria
4.2Conductometria
4.3Titrarea potentiometrica
4.4pH-metria
4.5Analiza polarografica
Capitolul V
1Aplicatii practice ale electrochimiei
Capitolul VI
Legi
Capitolul VII
1Notiuni de protectia muncii
2Primul ajutor
BIBLIOGRAFIA
ARGUMENT
Electrochimia este o ramura a chimiei fizice care se ocupa cu studiul proceselor de transformare a energiei chimice in energie electrica, precum si cu studiul reactiilor chimice sub influenta curentului electric.
Electrochimia a aparut ca un domeniu deosebit al chimiei inca din secolul al XIX-lea, prin efectuarea unui numar mare de experimentari, observatii si generalizari teoretice.
Interdependenta
dintre reactiile chimice si curentul electric a fost observata in anul 1800 de
catre fizicianul italian Alessandru
Prin elaborarea teoriei disociatiei electrolitice de catre S. Arrhenius s-a putut explica mecanismul conductibilitatii solutiilor, iar legile trecerii curentului electric prin solutii de electroliti, elaborate de catre Michael Faraday (1791 - 1867) in perioada 1832 - 1833 au fost intelese la alt nivel.
Studiind migrarea ionilor in timpul electrolizei, fizicianul german Johann Wilhelm Hittorf (1824 - 1914) a introdus notiunea de numar de transport (1835), stabilind o relatie intre aceasta notiune si mobilitatea ionilor. In anul 1897 W. Nernst a studiat viteza de migrare a ionilor, iar Friedrich Wilhelm Georg Kohlrausch (1840 - 1910) a studiat conductibilitatea electrolitica a solutiilor.
In functie de capacitatea de a conduce sau nu curentul electric substantele chimice sunt de doua tipuri: rau conducatoare de electricitate sau izolatoare si bune conducatoare de electricitate, acestea din urma impartindu-se dupa modul prin care se efectueaza transferul de sarcina in conductori metalici sau electronici si electroliti.
Transportul electricitatii in cazul conductorilor metalici se datoreste deplasarii electronilor metalului respectiv iar in cazul electrolitilor curentul este transportat de catre ioni. Conductibilitatea metalelor scade cu cresterea temperaturii, in timp ce la electroliti se mareste cu ridicarea temperaturii.
Legea lui Ohm arata ca intensitatea curentului electric, I care trece printr-un conductor metalic depinde de tensiunea electrica (diferenta de potential), E aplicata la capetele sale si de o proprietate specifica fiecarui conductor in parte numita rezistenta electrica, R.
I
= ![]()
Unitatea de masura pentru rezistenta electrica este ohmul ( ) care se defineste ca reprezentand rezistenta unui conductor (o coloana de mercur de 106,3 cm lungime si sectiunea de 1 mm2 la 0 C) prin care la diferenta de potential de 1 V circula un curent avand intensitatea de 1 A.
Voltul este o unitate de masura care reprezinta forta electromotoare ce trebuie aplicata la capetele unui conductor cu rezistenta de un ohm (1 ) pentru a trece un curent de un amper (A), iar amperul se defineste ca reprezentand intensitatea unui curent care transporta 1 coulomb (1 C) pe secunda sau cantitatea de electricitate care in timp de o secunda depune dintr-o solutie de azotat de argint 1,1180 mg argint.
Coulombul (C) este egal cu 3 10-9 unitati electrostatice, o unitate electrostatica de sarcina electrica exercita asupra unei sarcini egale (considerate punctiforme) aflate la distanta de 1 cm o forta de o dyna.
Electrolitii sunt o clasa de substante ce cuprind acizi, baze si saruri prin care transportul curentului electric se realizeaza prin ioni; pentru ca acesti ioni sa se poata misca liber, adica substanta respectiva sa se comporte ca un electrolit, este necesar ca aceasta sa se afle in solutie sau sub forma de topitura, deci in stare solida, cristalizata electrolitii sunt rau conducatori de electricitate.
Pentru a facilita transportul curentului electric prin electroliti este necesar ca in acestia sa se introduca doua piese de metal sau carbune legate prin conductori metalici de polii unei surse de curent, piese numite electrozi; electrodul legat la polul pozitiv al sursei se numeste anod, iar cel legat la polul negativ, catod.
Intr-o solutie sau topitura numarul sarcinilor pozitive este egal cu cel al sarcinilor negative, indiferent de numarul lor pe un ion. In cursul unei electrolize ionii pozitivi sunt atrasi de electrodul negativ, in timp ce ionii negativi se indreapta catre electrodul pozitiv.
Cationii primesc electroni din partea catodului, trecand in stare atomica, in timp ce anionii cedeaza electroni anodului neutralizandu-se electric.
Prin aceste procese la electrozii pilei se vor forma diferite substante functie de natura substantei electrolitice.
Capitolul I
1. Electroliza
Clausius (1857) emite ipoteza ca electrolitii se supun legii lui Ohm, energia electrica fiind folosita integral pentru transportul ionilor in solutie.
Experientele lui Kohlrausch au aratat insa ca electrolitii diluati conduc mai bine curentul electric decat cei concentrati ceea ce a dus la formularea unei noi teorii - teoria disociatiei electrolitice a lui Svante Arrhenius (1884) prin care acesta arata ca substantele ionice disociaza in ionii componenti doar cand sunt sub forma de solutii, astfel:
RX + H2O → R+ + X- + H2O
Reactia de disociere electrolitica este reversibila.
Desi acceptata in unanimitate in primul moment teoria lui Arrhenius s-a dovedit a fi complet valabila doar in cazul electrolitilor slabi, putin disociati, in timp ce prin dizolvarea electrolitilor tari are loc doar un fenomen de separare practic totala a ionilor, acestia fiind preexistenti in electrolitii tari care se gasesc sub forma de ioni in toate starile de agregare.
Procesul descompunerii unei substante chimice cu ajutorul curentului electric poarta numele de electroliza. Se supun electrolizei compusii chimici dizolvati, existenti intr-o solutie sau in stare topita. Aparatul in care se efectueaza electroliza se numeste electrolizor sau celula electrolitica.
Un electrolizor este format din doi electrozi metalici (sau din grafit) cufundati intr-o solutie de electrolit si conectati la o sursa de curent continuu (fig. 1). Electrodul legat la polul pozitiv al sursei de curent se numeste anod, iar cel legat la polul negativ se numeste catod.
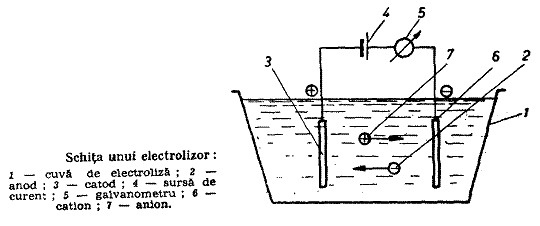
In solutii de electroliti ionii au miscari dezordonate, dar sub influenta unui camp electric miscarea lor devine dirijata, ionii migrand in solutie in conformitate cu legea lui Charles Augustin Coulomb (1736 - 1806). Ionii incarcati pozitiv migreaza spre catod (sunt cationi) iar cei incarcati negativ migreaza spre anod (sunt anioni).
Trecerea curentului electric prin solutia de electrolit este insotita de un transfer de masa, care va determina aparitia de substante la cei doi electrozi. Circuitul electric intr-un electrolizor se stabileste printr-un conductor electronic (metalic) care uneste cei doi electrozi cu sursa de curent, iar in electrolit prin migrarea ionilor. Absenta ionilor in solutie intrerupe circuitul electric.
In procesul de electroliza se disting doua etape: in prima etapa la contactul dintre suprafata electrozilor si ionii migratori se produce "neutralizarea" ionilor, cand acestia pierd sarcinile lor. Astfel la catod, ionii pozitivi primesc electroni si se descarca (se reduc) devenind atomi neutri. La anod, ionii negativi cedeaza electronii (se oxideaza), ei trecand in atomi neutri sau radicali liberi. Reactiile de oxido-reducere care se petrec la electrozi se numesc reactii primare ale electrolizei. Sursa de curent functioneaza ca o pompa aspiro-respingatoare: primeste electroni de la anod si ii trimite la catod.
In etapa a doua a procesului de electroliza, atomii si respectiv radicalii liberi se combina intre ei formand molecule, sau se combina cu dizolvantul si in putine cazuri (daca este un electrod din grafit) pot reactiona chiar cu electrodul; aceste transformari se numesc reactii secundare ale electrolizei. Substantele care rezulta prin electroliza apar numai la electrozi si nu in spatiul dintre ei.
1.1. Legile electrolizei
Cercetand procesul de electroliza M. Faraday a elaborat legile electrolizei care reflecta legatura intre cantitatea de substanta separata sau dizolvata la electrozi si cantitatea de electricitate ce trece prin solutia de electrolit.
I. Cantitatea de substanta separata sau dizolvata la electrozi este proportionala cu cantitatea de electricitate ce trece prin electrolit:
M = Q K = K I t
unde m - cantitatea de substanta transformata, g;
I - intensitatea curentului, A;
t - durata electrolizei, s;
K - o constanta numita echivalent electrochimic;
Q - cantitatea de electricitate, dependenta de I si t;
K = m / Q reprezinta cantitatea de substanta depusa sau dizolvata la electrod de o cantitate de electricitate egala cu un coulomb (C). Echivalentul electrochimic se exprima in g / C sau mg / C; pentru Ag+, K = 1,1180; pentru Cu2+, K = 0,32935 in mg / C.
II. Daca prin electroliti diferiti trece aceeasi cantitate de electricitate, cantitatile de substante separate sau dizolvate la electrozi sunt proportionale cu echivalentii chimici ai substantelor respective.
Pentru descarcarea unui ion monovalent intervine in reactie un electron a carui sarcina determinata prin difractia razelor X este de 1,602 10-19C. Stiind ca un echivalent gram contine 6,023 1023 particule rezulta ca pentru descarcarea unui echivalent-gram dintr-o substanta este necesara o cantitate data de produsul 1,602 1023 = 96494 C. Aceasta cantitate de electricitate poarta numele de un faraday si se simbolizeaza prin F. Deci pentru a separa prin electroliza un atom gram de cupru sunt necesari 2F, pentru a separa un atom gram de aluminiu sunt necesari 3F.
Aplicand prima lege a electrolizei pentru un echivalent (E) de substanta rezulta
E = K F,
cantitatea de electricitate Q fiind in acest caz
F = I t si deci K = E / F,
adica echivalentul electrochimic K este proportional cu echivalentul chimic. Un faraday este dat de raportul dintre echivalentul chimic si electrochimic F = E / K.
Stiind ca echivalentul chimic reprezinta raportul dintre masa atomica A si valenta n, rezulta
K = ![]()
si substituind in relatia ce exprima prima lege a electrolizei, rezulta
m = ![]()
legea generala a electrolizei conform careia cantitatea de substanta separata la electroliza este proportionala cu cantitatea de electricitate care trece prin solutia de electrolit si echivalentul chimic.
Din cele de mai sus rezulta ca procesul de electroliza comporta doua aspecte distincte: transportul curentului electric cu ajutorul ionilor si transformarile chimice suferite de ioni la electrozi.
1.2. Electroliza apei
Deoarece apa pura nu conduce curentul electric electroliza ei se face in prezenta unui electrolit ca NaOH sau H2SO4.
Considerand electroliza apei in prezenta de NaOH, in solutie apoasa apar mai multi ioni prin disocierea electrolitica a NaOH si autoprotoliza apei:
NaOH ↔ Na+ + HO-
2 H2O ↔ H3O+ + HO-
Au loc urmatoarele reactii primare:
La catod (-) : H3O+ + e- → H + H2O
La anod (+) : 2 HO- - 2e- → 2 HO
Trebuie subliniat faptul ca protonii respectiv cationii H3O+ se descarca mult mai usor decat cationul Na+; sodiul metalic se oxideaza foarte repede, electronul de pe orbitalul 3s fiind foarte usor cedat. Pentru ca procesul sa aiba loc in sens invers este necesar un potential mult mai mare. Se observa ca in seria activitatii, sodiul se gaseste mult inaintea hidrogenului si este deci explicabila reducerea mai dificila a cationilor de sodiu, in comparatie cu protonii. Reactiile secundare sunt:
La catod: 2 H → H2
La anod: 2 HO → H2O + O2
Se observa ca la electrozi se descarca numai ionii apei; hidrogenul se degaja la catod, iar oxigenul la anod, in proportie de 2 la 1.
1.3. Tensiunea de descompunere
Prelucrarile electrochimice ale suprafetelor metalice, ca de exemplu polizarea, degresarea, decaparea, precum si metodele de protectie a metalelor prin depuneri galvanice, se bazeaza pe procesul de electroliza.
Tensiunea minima care trebuie aplicata la electrozi pentru ca electroliza sa se desfasoare continuu si cu randament bun se numeste tensiune de descompunere si se noteaza cu Ed.
In timpul procesului de electroliza datorita producerii unor reactii secundare se formeaza in celula de electroliza o pila galvanica a carei tensiune electromotoare, denumita tensiune electromotoare de polarizare se opune tensiunii exterioare. Din aceasta cauza pentru ca un proces de electroliza sa aiba loc este necesar sa se aplice la electrozii celulei o tensiune mai mare decat tensiunea electromotoare de polarizare.
Vom considera cazul electrolizei apei slab acidulate sau slab alcalinizate, folosind electrozi inerti adica electrozi care nu reactioneaza cu produsii rezultati in urma electrolizei.
Apa este un electrolit slab care disociaza potrivit ecuatiei chimice:
H2O ↔ H+ + HO-
Reactiile care au loc la electroliza apei acidulate sau alcalinizate au fost prezentate mai sus.
In cazul unor valori mici ale tensiunii exterioare, hidrogenul si oxigenul, care se formeaza in stare gazoasa, nu se desprind de pe electrozi si datorita acestui fapt la catodul celulei de electroliza se formeaza un electrod de hidrogen, iar la anod, un electrod de oxigen si astfel apare o pila galvanica. Tensiunea electromotoare a acestei pile este egala si de semn opus tensiunii aplicate din exterior si rezultanta lor ar trebui sa fie nula. In urma difuziei lente a H2 si O2, intensitatea curentului din celula de electroliza nu se anuleaza, mentinandu-se la o valoare minima ce se numeste curent rezidual. Pe masura cresterii tensiunii exterioare, in momentul cand aceasta depaseste valoarea tensiunii electromotoare de polarizare, electroliza se produce continuu si intensitatea curentului din celula creste liniar (E = R I).
Tensiunea de descompunere se determina din curba care arata variatia intensitatii curentului de electroliza in functie de tensiunea E aplicata din exterior
1.4. Electroliza topiturilor
Prin topirea sarurilor anorganice ionice cristaline apar lichide in care ionii prezinta anumita mobilitate; sub influenta unui camp electric ei vor migra la electrozi. In stare topita, compusii ionici sunt conductori electronici. Prin electroliza unor topituri se pot obtine metale; astfel metalele alcaline si alcalino-pamantoase se obtin prin electroliza sarurilor lor topite.
La electroliza clorurii de sodiu topite apar urmatoarele reactii:
La anod: Cl- - e- → Cl
2 Cl → Cl2
La catod: Na+ + e- → Na (lichid)
Deoarece topitura de NaCl are temperatura de 801 C, iar sodiul se topeste la 97,5 C, prin electroliza sodiul apare in stare lichida.
Facand electroliza clorurii de sodiu in solutie apoasa se separa hidrogenul, iar in solutie se formeaza NaOH.
Capitolul II
1. Conductibilitatea electrolitilor
Proprietatea unor corpuri de a permite trecerea electricitatii prin ele sub actiunea unui camp electric exterior se numeste conductibilitate electrica. In cazul conductorilor de ordinul I (metale) transportul electricitatii se face prin deplasarea electronilor iar in cazul conductorilor de ordinul II (electroliti) acest transport se face prin ioni. Este de subliniat ca in acest caz transportul sarcinilor electrice se realizeaza concomitent cu un transport de substanta, iar la acest transport iau parte ambii ioni.
Cantitatea de electricitate care trece intr-un anumit interval de timp printr-un conductor depinde de caracteristicile campului electric exterior si de rezistenta conductorului respectiv. Atat conductorii de ordin I cat si cei de ordin II respecta legea lui Georg Simon Ohm (1787 - 1854).
2.1. Conductibilitatea electrica specifica a electrolitilor
Rezistenta unui conductor electric reprezinta forta pe care acesta o opune la trecerea curentului electric si este direct proportionala cu lungimea sa si invers proportionala cu sectiunea. Rezistenta electrica este data de relatia:
R = ![]()
unde l este lungimea si S este sectiunea conductorului, iar este rezistivitatea sau rezistenta specifica.
Rezistenta specifica se defineste ca rezistenta in ohmi a unui cub cu latura de 1 cm dintr-o substanta solida sau solutie, cand se aplica o tensiune de un volt pe doua fete opuse ale sale. Se exprima in ohmi cm ( cm). Inversul rezistentei specifice, l se numeste conductibilitatea electrica specifica sau conductivitate; aceasta se exprima in cm-1.
Conductibilitatea electrica specifica reprezinta cantitatea de electricitate care traverseaza intr-o secunda un volum de electrolit, a carui sectiune este de 1 cm2 si lungimea de 1 cm, cand diferenta de potential este de 1 volt.
Conductibilitatea specifica a electrolitilor creste cu ridicarea temperaturii; creste si cu concentratia solutiilor, dar pana la un anumit maxim dupa care scade.
Apa foarte pura conduce extrem de putin curentul electric; urmele unor impuritati ca CO2 din atmosfera sau substante dizolvate din sticla maresc conductibilitatea ei. Pentru a fi folosit ca solvent pentru determinari de conductibilitate trebuie purificata in mod deosebit si pastrata in vase de argint.
Substantele lichide neionice, perfect pure ca HCl, SO2, NH3 conduc extrem de putin curentul electric. Daca in aceste lichide se dizolva electroliti acestia conduc curentul electric dar in mai mica masura decat in solutii apoase. In laborator conductibilitatea electrolitilor se determina cu puntea Kohlrausch, obisnuit la temperatura de 18 C.
2.2. Conductibilitatea echivalenta a electrolitilor
Deoarece conductibilitatea specifica a solutiilor de electroliti variaza functie de concentratie pentru a le putea compara este necesara exprimarea conductibilitatilor printr-o marime independenta de concentratie.
In anul 1876 Kohlrausch a introdus notiunea de conductibilitate echivalenta, marime ce se noteaza cu Lc
Conductibilitatea echivalenta se defineste prin produsul dintre conductibilitatea specifica l a unei solutii si volumul ei V in cm3, volum care contine un echivalent-gram de electrolit:
Lc l V = ![]()
unde c reprezinta concentratia solutiei exprimata in echivalenti continuti in 1 cm3; se observa ca se poate defini simplu conductibilitatea echivalenta ca raportul dintre conductibilitatea specifica si concentratia solutiei, exprimata in echivalenti pe cm. Conductibilitatea echivalenta reprezinta conductibilitatea unei solutii care contine un echivalent de solut in V cm3 apa; ea se exprima in cm2.
Conductibilitatea echivalenta este o masura a conducerii curentului electric de catre toti ionii produsi de un echivalent-gram de electrolit, la o concentratie data.
Determinand conductibilitatea echivalenta se pot face comparatii privind comportarea diferitor electroliti stabilind variatia lui Lc functie de temperatura sau concentratia solventilor.
La temperatura constanta conductibilitatea echivalenta creste cu dilutia solutiei si tinde catre o valoare maxima la dilutie infinita.
Conductibilitatea echivalenta la dilutie infinita, L , reprezinta valoarea limita pe care o poate atinge conductibilitatea echivalenta. Aceasta este o proprietate constanta a fiecarui electrolit si nu poate fi determinata direct ci se stabileste cu ajutorul conductibilitatilor echivalente pentru solutii de concentratii din ce in ce mai mici extrapolandu-se pentru concentratia zero, cand dilutia este infinita.
Conductibilitatea echivalenta creste cu cresterea temperaturii, fenomen ce se explica prin scaderea vascozitatii solutiilor permitand o miscare mai rapida a ionilor. De asemenea in cazul electrolitilor slabi temperatura favorizeaza disocierea electrolitica deci apare un numar mai mare de ioni care contribuie la conducerea curentului electric.
Cresterea conductibilitatii electrice cu temperatura prezinta o importanta practica deosebita; electrolizele industriale se conduc la temperaturi ridicate spre a scadea consumul de curent electric, procesul devenind mai economic.
2.3. Electroliti tari si electroliti slabi
Functie de conductibilitatea echivalenta electrolitii se impart in doua clase: electroliti tari si electroliti slabi.
Conductibilitatea echivalenta a electrolitilor tari este mare chiar in solutii concentrate si variaza in mica masura cu variatia concentratiei solutiilor; creste putin prin diluare.
Conductibilitatea echivalenta a electrolitilor slabi este mica chiar in solutii concentrate dar creste mult prin dilutia solutiilor. Niciodata insa conductibilitatea electrolitilor slabi nu va atinge valori apropiate de cele ale electrolitilor tari.
Electrolitii tari (acizi tari, baze tari, toate sarurile) se gasesc in solutie sub forma de ioni. Teoretic, toti ionii din solutie trebuie sa participe la transportul curentului electric. In realitate insa intre ioni apar interactiuni datorita fortelor de atractie electrostatica ceea ce are ca efect micsorarea mobilitatii lor si deci scaderea numarului de ioni care participa la transportul curentului. Aceste interactiuni sunt cu atat mai puternice cu cat concentratia solutiei este mai mare. In consecinta conductivitatea electrolitilor tari scade cand creste concentratia solutiilor.
Electrolitii slabi sunt solutii de acizi si baze slabe de natura organica sau anorganica. Prin dizolvare in apa o parte din moleculele acestor substante disociaza in solutie stabilindu-se un echilibru de disociere:
HA + H2O ↔ A- + H3O+ (in cazul acizilor slabi)
B + H2O ↔ BH+ + HO- (in cazul bazelor slabe)
Echilibrul este deplasat spre dreapta, deci spre formare de ioni, cand concentratia scade. Ca urmare, conductivitatea creste datorita faptului ca exista mai multi ioni liberi care pot participa la transportul curentului.
Pentru electrolitii slabi, tinand seama de echilibrul de disociere care exista in solutie se defineste un grad de ionizare (de disociere)
![]()
unde nd este numarul de molecule disociate si nt numarul total de molecule. Gradul de disociere poate fi exprimat in functie de conductivitatea echivalenta astfel:
![]()
Aplicand legea actiunii maselor echilibrului de disociere a electrolitilor slabi se deduce constanta de echilibru Ki denumita si constanta de ionizare
Ki
= ![]() (legea
dilutiei Ostwald)
(legea
dilutiei Ostwald)
Inlocuind gradul de ionizare in functie de conductivitatea echivalenta L se obtine pentru Ki expresia:
Ki
= ![]()
Comportarea electrolitilor tari in solutie este diferita de cea a
electrolitilor slabi. In ambele cazuri insa raportul de conductivitate ![]() scade cand
concentratia creste. Cauzele acestui fenomen sunt diferite si anume in cazul
electrolitilor tari odata cu cresterea concentratiei scade mobilitatea ionilor
datorita cresterii interactiunii electrostatice dintre ionii de semn contrar;
in cazul electrolitilor slabi, la cresterea concentratiei echilibrul se
deplaseaza spre formarea de molecule nedisociate deci scade numarul de ioni
liberi in solutie.
scade cand
concentratia creste. Cauzele acestui fenomen sunt diferite si anume in cazul
electrolitilor tari odata cu cresterea concentratiei scade mobilitatea ionilor
datorita cresterii interactiunii electrostatice dintre ionii de semn contrar;
in cazul electrolitilor slabi, la cresterea concentratiei echilibrul se
deplaseaza spre formarea de molecule nedisociate deci scade numarul de ioni
liberi in solutie.
2.4. Coeficient de conductibilitate
In solutiile de electroliti tari intre ioni apar interactiuni de tip electrostatic incat nu toti ionii din solutie participa efectiv la trecerea curentului electric ci doar o anumita fractiune. Fractiunea din numarul total de ioni ce se gasesc intr-o solutie de o anumita concentratie care participa efectiv la transportul curentului electric prin solutie se numeste coeficient de conductibilitate, fl. El este dat de raportul dintre conductibilitatea echivalenta Lc la o concentratie data a solutiei si conductibilitatea echivalenta la dilutie infinita L
fl ![]()
si se exprima in procente. Se intelege ca prin diluarea solutiei interactiunea dintre ioni scade si deci coeficientul de conductibilitate va creste atat pentru electrolitii tari cat si pentru cei slabi. De exemplu: pentru o solutie molara de KCl, coeficientul de conductibilitate este de 75,5%, iar pentru o solutie de 0,0001 M este foarte aproape de 100%. In cazul unei solutii molare de acid acetic fl = 0,38% iar pentru o solutie de 0,0001 M fl = 30,6%. Se intelege ca atat in cazul electrolitilor tari cat si a celor slabi coeficientii de conductibilitate scad cand creste concentratia solutiilor. In primul caz datorita interactiunilor electrostatice mobilitatea ionilor scade, iar in al doilea caz echilibrul ionic este deplasat spre formare de molecule neutre; aceste fenomene explica scaderea coeficientilor de conductibilitate electrica.
Capitolul III
1. Procese de electrod
Un electrod reprezinta un sistem format dintr-un conductor electronic, obisnuit o placuta metalica sau grafit ce se gaseste in contact cu un electrolit. In practica electrolitul contine cationii metalului din care este alcatuit conductorul electronic. La suprafata de separatie metal-solutie (interfata) apar procese de oxido-reducere care se numesc procese de electrod, iar diferenta de potential ce se stabileste la echilibru intre metal si solutia de electrolit se numeste potential de electrod si se noteaza cu e
Mecanismul aparitiei potentialului de electrod se explica prin tendinta metalelor de a trimite ioni in solutie si a ionilor din solutie de a se depune pe metal. Metalele care trimit ioni in solutie se incarca negativ, iar cele pe care se depun ioni pozitivi din solutie se incarca pozitiv. La limita metal-solutie apar doua straturi de sarcina egala si de semn contrar, unul pe metal si altul in solutie, formand stratul dublu electric. Diferenta de potential corespunzatoare stratului dublu electric este denumita potential de electrod.
Potentialul standard de electrod reprezinta potentialul de echilibru al metalului scufundat in solutia sarii proprii cu activitatea egala cu unitatea ( a = 1) la temperatura de 25 C si la presiunea de o atmosfera.
3.1. Pile electrice
O pila electrica sau un element voltaic (element galvanic) este un dispozitiv cu ajutorul caruia energia chimica este transformata in energie electrica. O pila electrica este deci o sursa de curent electric generat de o reactie chimica.
Constructia unei pile electrice se realizeaza prin asamblarea a doi electrozi care se gasesc in contact, in exterior printr-un conductor electronic (metalic) iar in interior prin electrolitii lor. Curentul electric care apare in pila circula prin conductorul metalic de la electrodul negativ la cel pozitiv, iar in interiorul pilei circuitul se inchide prin migrarea anionilor din jurul electrodului pozitiv, spre electrolitul electrodului negativ. In timpul functionarii pilei, la cei doi electrozi se produc reactii de oxido-reducere. La electrodul negativ se produc reactii de oxidare a atomilor metalici, iar la cel pozitiv se produc reactii de reducere a cationilor metalici. Energia electrica a pilei este furnizata de energia chimica a reactiilor care au loc la electrozi. Reactia chimica globala care are loc in astfel de pile, numite pile chimice, rezulta prin insumarea reactiilor ce se petrec la electrozi.
Forta electromotoare a unei pile chimice (f.e.m.) reprezinta diferenta de potential care ia nastere intre cei doi electrozi si se exprima in volti. Conventional, f.e.m. se considera diferenta dintre potentialul electrodului pozitiv si al celui negativ
E = E+ - E-
F.e.m. depinde de temperatura, presiune, natura electrozilor si concentratia electrolitului.
 Daca la electrozii unei pile chimice se aplica o diferenta de potential din
exterior care compenseaza forta electromotoare a pilei incat nu trece curent
electric prin circuitul exterior, nu are loc nici o reactie chimica la
electrozi si deci nici o schimbare a concentratiilor electrolitilor pila se
numeste reversibila. Daca diferenta de potential aplicata din exterior este mai
mare decat f.e.m. a pilei curentul in pila va circula in sens opus iar
reactiile chimice de la electrozi vor fi inversate. Pila reversibila este
formata din electrozi reversibili. Pilele reversibile prezinta o importanta practica
deosebita.
Daca la electrozii unei pile chimice se aplica o diferenta de potential din
exterior care compenseaza forta electromotoare a pilei incat nu trece curent
electric prin circuitul exterior, nu are loc nici o reactie chimica la
electrozi si deci nici o schimbare a concentratiilor electrolitilor pila se
numeste reversibila. Daca diferenta de potential aplicata din exterior este mai
mare decat f.e.m. a pilei curentul in pila va circula in sens opus iar
reactiile chimice de la electrozi vor fi inversate. Pila reversibila este
formata din electrozi reversibili. Pilele reversibile prezinta o importanta practica
deosebita.
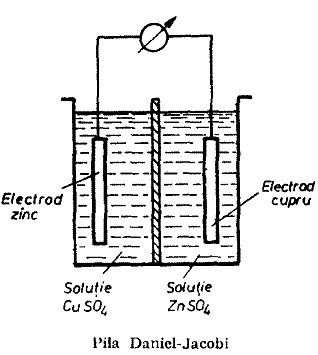
Un exemplu de pila electrica reversibila este pila Daniel-Jacobi. Aceasta se compune din doi electrozi ce se gasesc intr-un vas despartit in doua compartimente printr-un perete din material poros (obisnuit ceramic) numit diafragma. Intr-un compartiment se gaseste o placa de cupru cufundata intr-o solutie concentrata de sulfat de cupru, iar in al doilea se gaseste o placa de zinc intr-o solutie de sulfat de zinc. Diafragma joaca rol de membrana semipermeabila, permitand numai trecerea anionilor SO42- in timpul functionarii pilei.
Daca cele doua placi metalice nu sunt unite in exterior printr-un conductor electronic, in pila nu se produce nici o reactie chimica. Daca insa se stabileste aceasta legatura la ambii electrozi se produc concomitent reactii chimice. De pe suprafata placii de zinc, atomii ce sunt in contact cu solutia se desprind de pe placa sub forma de cationi de Zn2+, iar electronii raman pe placa de zinc care se incarca negativ. Acesti electroni liberi, datorita existentei benzilor de conductie se deplaseaza usor spre placa de cupru formand circuitul exterior al pilei. In acelasi timp cationii de Cu2+ din solutia de CuSO4 se descarca primind electroni si se depun sub forma de cupru metalic, pe placa de cupru. Prin diafragma trec ionii SO42- de la electrodul pozitiv (cupru) spre cel negativ (zinc) unde gasesc cationii de Zn2+, proaspat desprinsi de pe placa de zinc si astfel se inchide circuitul. Curentul electric circula in exterior de la zinc la cupru iar in interiorul pilei de la cupru la zinc.
Se deduce cu usurinta ca la electrodul negativ are loc urmatoarea reactie de oxidare:
Zn → Zn2+ + 2e-
iar la electrodul pozitiv reactia de reducere:
Cu2+ + 2e- → Cu
Reactia totala care are loc in pila este data de suma celor doua reactii ce se petrec la electrozi:
Zn + Cu2+ ↔ Zn2+ + Cu
Pentru ca aceasta reactie sa decurga in sens invers trebuie introdus in circuitul exterior al pilei o diferenta de potential mai mare si opusa celei generate de pila. In acest caz de pe placuta metalica vor trece cationi de Cu2+ in solutie iar pe placuta de zinc se vor depune cationi de zinc reducandu-se la zinc metalic.
In timpul functionarii pilei Daniel-Jacobi, cantitatile de cupru depuse pe placuta de cupru si cantitatile de zinc trimise in solutie de pe placuta de zinc sunt echivalente. Daca aceste placi metalice se cantaresc inainte si dupa o durata de functionare a pilei se constata ca pentru trecerea unei cantitati de electricitate de 96 494 coulombi se depune un echivalent de cupru si se dizolva un echivalent de zinc. Pila Daniel dezvolta o f.e.m. de maximum 1,1 volti care rezulta din diferenta algebrica a potentialelor celor doi electrozi componenti:
E = + 0,76 - ( - 0,34 ) = 1,1 V
Aceasta este valoarea teoretica practic pilele electrice furnizeaza numai 80-90% din energia rezultata prin calcul.
O pila chimica se simbolizeaza scriindu-se polul negativ la stanga urmat de cel pozitiv; in cazul pilei Daniel apare urmatoarea reprezentare:
( - ) Zn | Zn2+SO42- || Cu2+SO42- | Cu ( + )
Liniile verticale reprezinta suprafata ce desparte conductorul metalic si electrolitul sau iar linia verticala dubla reprezinta suprafata intre electroliti despartita de diafragma.
3.2. Pile de concentratie
Aparent in pilele de concentratie nu se petrec reactii chimice la electrozi. Energia electrica care apare este produsa de transferul de electrolit de la o concentratie la alta.
O pila de concentratie este alcatuita din doi electrozi din acelasi metal si acelasi electrolit care se diferentiaza prin concentratii diferite ale electrolitului. De exemplu doua placute de argint unite in exterior printr-un conductor metalic in contact cu o solutie de azotat de argint solutiile insa de concentratii diferite si despartite printr-o diafragma, constituie o pila de concentratie. Prin diafragma pot trece numai anionii sub influenta campului electric.
La electrodul cu azotat de argint mai diluat are loc un proces de oxidare a argintului (este electrodul negativ) formandu-se cationi de Ag+ iar la celalalt electrod cationii de argint se depun, reducandu-se (este electrodul pozitiv). Concomitent are loc trecerea anionilor NO3- spre electrodul negativ. Pila functioneaza pana cand cele doua concentratii in AgNO3 devin egale. Prin aplicarea din exterior a unei f.e.m. mai mare decat a pilei diferentele de concentratii ale electrolitului se accentueaza.
Aceasta pila de concentratie se simbolizeaza:
Ag | Ag+NO3- (a1) || Ag+NO3- (a2) | Ag
unde a1 si a2 sunt activitatile ionilor. Prin activitatea ionilor, a, se intelege acea frractiune f din concentratia c a ionilor care contribuie la transportul electricitatii prin electroliti sau la celelalte proprietati ale solutiei. Practic
a = f c
iar pentru o solutie ideala f = 1 si deci a = c.
Forta electromotoare a pilei de concentratie este:
E = E1
- E2 = (E ![]() ln a1) - (E
ln a1) - (E ![]() ln a2) =
ln a2) = ![]() ln
ln ![]()
Capitolul IV
Metodele electrochimice se caracterizeaza prin folosirea in analiza calitativa si mai ales cantitativa a unor marimi electrice ca: diferenta de potential si intensitatea curentului electric, cantitatea de energie electrica consumata la electroliza etc. In geneneral, metodele electroanalitice se bazeaza pe studiul fenomenelor ce au loc la trecerea curentului electric prin solutii de electroliti - ca de exemplu oxidare-reducere, descompunere electrolitica etc.
Metodele electrochimice de analiza se denumesc tinand cont de marimea masurata. Astfel, daca se determina prin cantarire masa substantei depuse prin electroliza, metoda se numeste electrogravimetrie; daca se masoara conductivitatea solutiei metoda se numeste conductometrie; daca se masoara diferenta de potential dintre doi electrozi imersati in solutia de analizat se numeste potentiometrie; daca se determina curentul de difuzie rezultat prin polarizarea unui electrod special metoda se numeste polarografie.
Pentru masurarea marimilor electrice se folosesc diverse aparate de masura si control ca: ampermetre, voltmetre, galvanometre, etc.
In afara aparatelor cu citire directa de felul celor amintite mai sus, in analiza electrochimica se mai utilizeaza aparate comparatoare ca: punti, compensatori, etc.
Aparatele de masurat electrice pot fi prevazute cu scale gradate (afisaj numeric) sau cu diverse sisteme de inregistrare pe hartie, pe film, etc.
4.1. Electrogravimetria
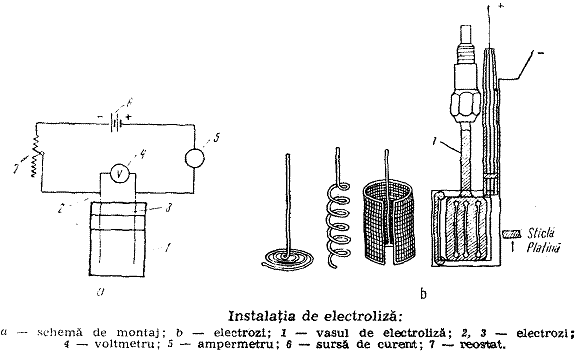
Analiza electrogravimetrica consta in depunerea cantitativa cu ajutorul curentului continuu a unor ioni aflati in solutia de analizat. Masa depozitului format pe electrod se determina prin cantarirea electrodului inainte si dupa electroliza.
Electroliza consta in descompunerea unor substante numite electroliti - aflate in solutie sau topitura - cu ajutorul curentului electric. Trecerea curentului electric este asigurata de prezenta in interiorul sistemului a unor electrozi (catod si anod) la suprafata carora au loc procese de oxidare-reducere, respectiv cedare sau primire de electroni.
De exemplu, la electroliza clorurii de zinc ZnCl2 vor avea loc urmatoarele procese:
Zn2+ + 2e- ↔ Zn0 (reducere)
2Cl- - 2e- ↔ Cl2 (oxidare)
Electrodul pe care se depune zincul se numeste catod iar cel pe care se degaja clorul se numeste anod. Asadar, la catod are loc reducerea cationilor iar la anod oxidarea anionilor. In unele cazuri se pot depune metale si pe anod dar tot sub forma oxidata, de exemplu:
Pb + O2 ↔ PbO2
Electrozii folositi in electrogravimetrie sunt formati de regula din metale inatacabile (Pt, Cu, Hg etc.). Depunerea metalelor din solutie duce la acoperirea suprafetei electrodului. Concomitent apare uneori fenomenul de "polarizare" care duce la incetinirea si chiar oprirea electrolizei - datorita unei forte contrare (contraelectrometrice). Procesul de electroliza poate sa reinceapa fie prin folosirea unui f.e.m. mai mare, fie prin depolarizarea electrozilor cu ajutorul unor agenti depolarizanti (oxidanti ca HNO3, K2Cr2O7 etc.).
Depunerea metalului pe catod este conditionata de compozitia solutiei si de densitatea de curent. Aceasta se exprima in amperi pe cm2 (sau dm2) suprafata activa a catodului.
Metoda electrogravimetrica se aplica frecvent la dozarea unor metale: Cu, Cd, Zn.
Factorii care influenteaza procesul de electroliza in afara celor mentionati sunt:
- compozitia solutiei de electroliza; in general se lucreaza in medii acide, dar rezultate bune se obtin in unele cazuri in medii alcaline, cu cianuri etc.;
- temperatura de lucru - de preferinta 60 - 80 C; la temperatura mai ridicata depunerea este mai rapida dar depozitul nu are suficienta aderenta pe electrod
- forma si dimensiunile electrozilor;
- agitarea solutiei etc.
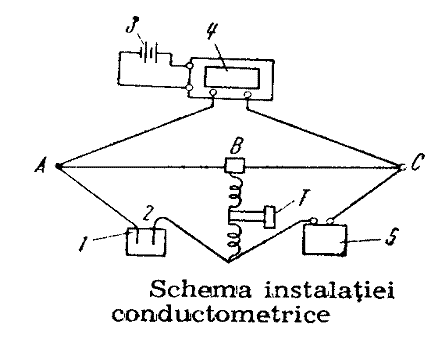
4.2. Conductometria
Analiza conductometrica se bazeaza pe masurarea variatiei conductivitatii solutiei de analizat ca urmare a reactiilor ce au loc prin modificarea concentratiei ionilor aflati in solutie. Astfel prin masurarea conductivitatii electrice se stabileste cu precizie punctul de echivalenta. Metoda se poate aplica atat la solutiile obisnuite (incolore sau slab colorate) cat mai ales la cele intens colorate si chiar la cale tulburi (cu suspensii) la care nu mai este posibila observarea virajului indicatorilor bicolori.
Electrozii utilizati in conductometrie sunt formati de regula din doua placute de platina.
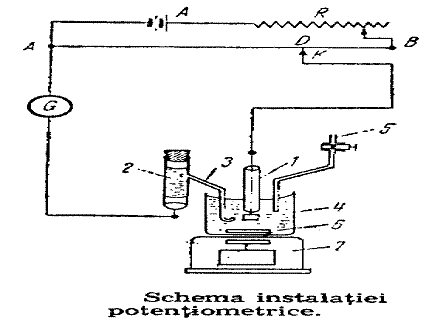
Schema de principiu a unei instalatii conductometrice este data in fig. .
4.3. Titrarea potentiometrica
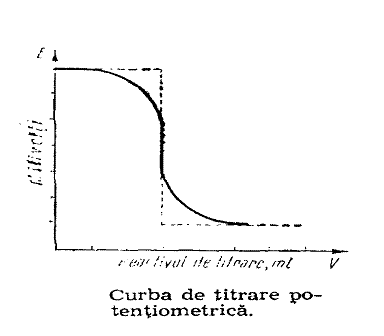 Potentiometria cuprinde metode electrochimice bazate pe masurarea tensiunii
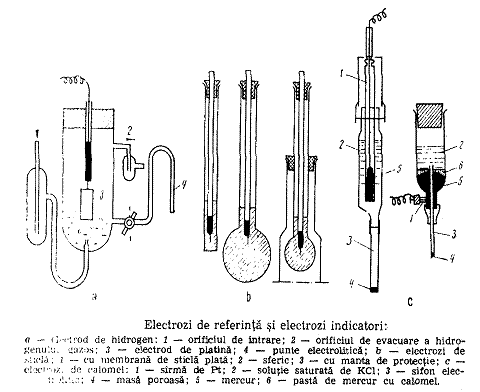
electromotoare a unei pile galvanice formata schematic dintr-un electrod
indicator cufundat in solutia de analizat si un electrod de referinta introdus
in aceeasi solutie.
Potentiometria cuprinde metode electrochimice bazate pe masurarea tensiunii
electromotoare a unei pile galvanice formata schematic dintr-un electrod
indicator cufundat in solutia de analizat si un electrod de referinta introdus
in aceeasi solutie.
4.4. pH-metria
Exponentul concentratiei de hidrogen sau pH reprezinta logaritmul cu semn schimbat al concentratiei sau activitatii ionilor de hidrogen dintr-o solutie:
pH
= -lg ![]()
pH
= -lg ![]()
Pentru apa pura si pentru solutiile neutre pH = 7, pentru solutiile acide pH < 7 si pentru cele bazice pH > 7.
Concentratia ionilor HO- dintr-o solutie se exprima printr-o marime notata pOH
pOH
= -lg ![]()
pOH
= -lg ![]()
In solutiile neutre pOH = 7, in cele acide pOH > 7 iar in cele bazice pOH < 7.
Intr-o solutie data intre marimile pH si pOH exista relatia:
pH + pOH = 14
Exponentul concentratiei de hidrogen (pH) are un rol important in multe reactii chimice intalnite in procesele de prelucrare electrochimica a suprafetelor metalice (degresare, decapare, polisare electrochimica), in procesele de coroziune si de protectie impotriva coroziunii, in centralele electrice unde pH-ul apelor de racire deteermina indicele de stabilitate etc.
Determinarea pH-ului se efectueaza prin metode colorimetrice folosind indicatori si prin metode potentiometrice (adica masuratori ale tensiunii electromotoare).
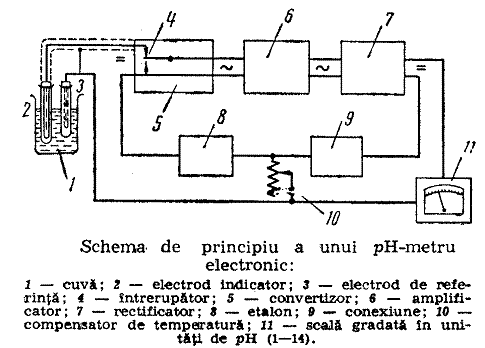
4.5. Analiza polarografica
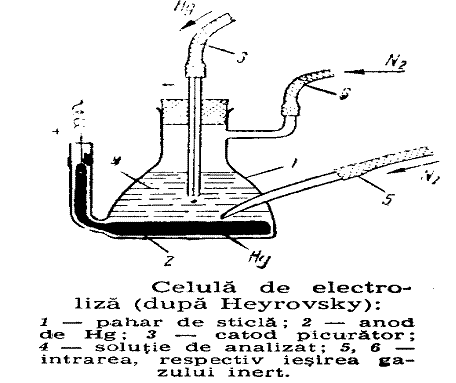
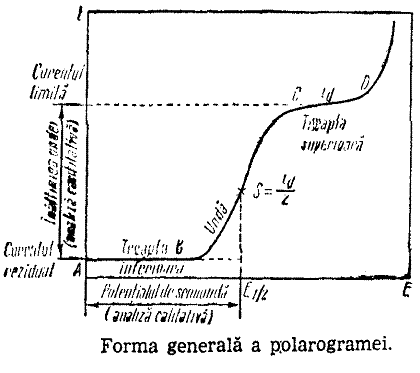
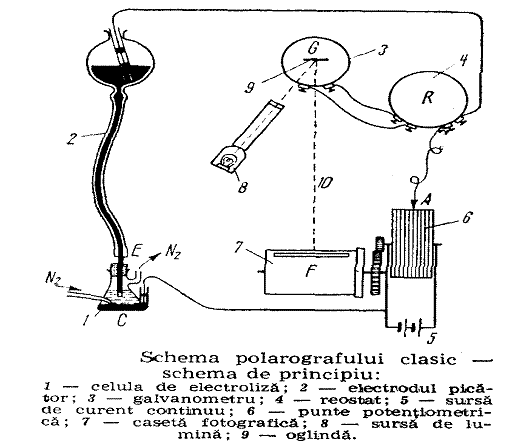
Capitolul V
1. Aplicatiile practice ale electrochimiei
Aplicatiile practice ale reactiilor electrochimice s-au dovedit de importanta majora si ele au favorizat dezvoltarea unor tehnologii chimice de varf, care au la baza procese electrochimice. Dintre aceastea fac parte obtinerea si purificarea metalelor prin electroliza, sinteze electrochimice - organice si anorganice, surse chimice de curent, purificarea electrochimica a apelor poluate, metode electrochimice de analiza, combaterea coroziunii metalelor.
Electrochimia se aplica in prezent in cele mai variate domenii de activitate. Astfel, in viata de toate zilele se folosesc bateriile electrice pentru pornirea motoarelor sau functionarea diferitelor aparate electrice, pentru lanterne electrice etc. Transmiterea fotografiilor de catre navele spatiale se face cu ajutorul curentului electric produs de pilele de combustie.
Aluminiul, magneziul si metalele alcaline sunt obtinute din materiile prime respective prin electrodepunere cu ajutorul curentului continuu. Multe metale sunt purificate (rafinate) tot pe cale electrochimica.
Prin electroliza se obtine hidroxid de sodiu electrolitic, hidrogen, hipocloriti, clorati, permanganat de potasiu, sodiu etc. Electroliza se foloseste la rafinarea unor metale: cupru, argint, zinc, plumb cat si la acoperirea unor metale cu alte metale de protectie (galvanostegie).
Obtinerea clorului prin electroliza solutiei de clorura de sodiu este unicul procedeu economic aplicat astazi in lume.
Numeroase piese si aparate confectionate din metale mai ieftine sunt acoperite pe cale galvanica pentru a le conferi un aspect placut si a le mari rezistenta la coroziune.
Suprafetele metalice pot fi protejate prin depunerea unui strat metalic care sa constituie o bariera intre metalul de protejat si mediul coroziv. Acoperirile metalice trebuie sa fie continui, aderente la metalul suport, uniforme ca grosime, lipsite de pori si sa prezinte o mare stabilitate chimica si o buna rezistenta la uzura.
Straturile metalice se pot realiza electrochimic si acest procedeu se numeste galvanizare. Cele mai importante depuneri galvanice pentru protectie anticoroziva sunt zincarea, cadmierea, nichelarea, cromarea, cuprarea si stanarea.
Exista acoperiri galvanice catodice si anodice. In depunerile anodice cum
sunt cuprarea, nichelarea, metalul folosit pentru acoperire are potentialul
standard de electrod mai pozitiv decat al metalului suport (![]() = +0,334 V;
= +0,334 V; ![]() = -0,230 V;
= -0,230 V; ![]() = -0,44 V). In cazul acoperirilor catodice ca de exemplu
zincarea, potentialul standard al metalului care se depune este mai negativ
decat al metalului suport (
= -0,44 V). In cazul acoperirilor catodice ca de exemplu
zincarea, potentialul standard al metalului care se depune este mai negativ
decat al metalului suport (![]() = -0,76 V;
= -0,76 V; ![]() = -0,44 V).
= -0,44 V).
Acoperirile catodice si anodice se obtin prin electroliza solutiilor care contin ionii metalului folosit pentru depunere si pot fi realizate in straturi unice sau straturi succesive.
De exemplu in cazul cuprarii se va depune un strat de cupru pe o placa de alama. Electrodepunerea cuprului are loc intr-o celula de electroliza utilizand drept electrolit o solutie acida de CuSO4. Anodul celulei este o bara de cupru, iar la catod se plaseaza piesa ce urmeaza sa fie protejata.
Sulfatul de cupru disociaza in solutie potrivit ecuatiei:
CuSO4 → Cu2+ + SO42-
La electrozi au loc urmatoarele reactii electrochimice:
Catod (alama): Cu2+ + 2e- → Cu
Anod (cupru): 2HO- → H2O + O + 2e-
SO42- → SO3 + O + 2e-
SO3 + H2O → H2SO4
Potrivit reactiilor chimice de mai sus la catod (polul negativ), deci pe piesa de alama, se depune cupru iar anodul de cupru se consuma. In celula de electroliza concentratia CuSO4 nu se modifica deoarece H2SO4 rezultat interactioneaza cu anodul de cupru formand CuSO4:
Cu(anod) + H2SO4 + O → CuSO4 + H2O
Unele metale si aliaje se protejeaza impotriva coroziunii prin acoperire cu straturi (pelicule) anorganice, realizate pe cale chimica si electrochimica. In industrie se aplica frecvent pelicule de oxizi, de fosfati si de cromati.
Straturile de natura anorganica sunt folosite pentru protectia metalelor supuse coroziunii atmosferice. Adeseori, oxidarea si fosfatarea se practica pentru obtinerea straturilor intermediare, inaintea aplicarii lacurilor si vopselelor. Peliculele de oxizi si de cromati se folosesc la finisarea decorativa a pieselor, a carcaselor aparatelor de masura si control. Prin acoperire cu straturi de oxizi si de fosfati se imbunatatesc unele calitati ale suprafetelor metalice cum ar fi duritatea, rezistenta la uzura, proprietatile electroizolante etc.
Peliculele de oxizi si de fosfati adera bine la metalul suport dar sunt fragile si poroase.
Suprafata aluminiului se acopera in aer cu un strat de oxid de aluminiu care, datorita grosimii reduse, a porozitatii mari si a rezistentei mecanice scazute, nu apara metalul impotriva coroziunii.
Oxidarea electrochimica a aluminiului si a aliajelor sale se practica pe scara larga in industrie. Procedeul de obtinere a peliculelor de oxid prin oxidare anodica se numeste eloxare. Peliculele astfel formate sunt poroase, au grosimi intre 20-50 , sunt termorezistente, stabile la actiunea vaporilor de apa si a altor agenti de coroziune. Cele mai mari dezavantaje sunt elasticitatea limitata si higroscopicitatea mare.
Calitatile peliculelor de oxid de aluminiu se imbunatatesc prin compactizare, adica prin introducerea piesei eloxate in apa la 90 C. Se formeaza cristale de tip Al2O3 nH2O, care avand greutate specifica mica si volum mare, astupa porii peliculei. Eloxarea urmata de compactizare se numeste eloxare dura.
Peliculele pot fi impregnate cu diferite substante, ca de exemplu parafina, lacuri de izolare, anumiti polimeri. Impregnarea micsoreaza higroscopicitatea peliculei si creste rezistenta la coroziune. Datorita capacitatii mari de absorbtie, peliculele de oxid de aluminiu se coloreaza, obtinandu-se astfel efecte decorative.
Protectia otelurilor impotriva coroziunii atmosferice se poate realiza prin formarea unor pelicule de fosfati. Fosfatarea se utilizeaza si pentru obtinerea straturilor intermediare pentru lacuri si vopsele, precum si pentru realizarea unor straturi electroizolante care pastreaza proprietatile magnetice ale suportului metalic.
Fosfatarea se poate realiza atat chimic cat si electrochimic si consta in obtinerea pe suprafata otelului a unei pelicule de fosfat tertiar de fier, zinc sau mangan. Procedeele chimice sunt cele mai utilizate in practica.
In cazul fosfatarii chimice la rece in solutii acide de fosfat de zinc, acidul fosforic liber din aceste solutii reactioneaza cu proba supusa fosfatarii astfel:
Fe + 2H3PO4 = Fe(H2PO4)2 + H2
In solutie, in prezenta acidului fosforic, fosfatul de zinc se transforma in fosfat tertiar conform reactiilor:
3Zn(H2PO4)2 ↔ Zn3(PO4)2 + 4H3PO4
5Zn(H2PO4)2 ↔ Zn3(PO4)2 + 2ZnHPO4 + 6H3PO4
Consumarea acidului fosforic conform primei reactii determina deplasarea spre dreapta a echilibrului ultimelor doua reactii ducand astfel la depunerea pe suprafata metalului a fosfatului tertiar insolubil. Procesul de obtinere a peliculelor fosfatice poate fi intensificat adaugand in solutia de fosfatare substante acceleratoare cum ar fi azotat de sodiu.
Inhibitorii de coroziune care actioneaza dupa mecanisme electrochimice se aplica din ce in ce mai mult in practica pentru combaterea proceselor de coroziune. Aceste substante sunt de natura organica sau anorganica si se adauga in cantitati mici direct in mediul coroziv sau se aplica pe suprafata metalului in amestec cu grunduri, lacuri si vopsele.
Protectia metalelor impotriva coroziunii folosind inhibitori de coroziune se practica in cazul sistemelor de alimentare cu apa, a instalatiilor de racire, a rezervoarelor de gaze, a conductelor de benzina si petrol etc.
Inhibitorii organici de coroziune sunt compusi cu molecule care au o grupare polara cu azot, oxigen, sulf. Acesti inhibitori se adsorb chimic, intre metal si molecula organica stabilindu-se legaturi prin electroni proveniti fie de la inhibitor, fie de la metal. Moleculele chemosorbite formeaza pe suprafata metalului o pelicula protectoare.
Eficienta inhibitorilor organici depinde de masa lor moleculara si de structura moleculei. Ei se folosesc in special in medii acide deoarece nu modifica pH-ul mediului.
Inhibitorii anorganici se clasifica dupa modul cum functioneaza in inhibitori catodici si anodici.
Inhibitorii anodici franeaza reactia anodica a procesului de coroziune ( M → Mz+ + ze- ). Aceste substante formeaza pe suprafata metalului pelicule superficiale de oxizi sau filme protectoare de produsi de coroziune. Drept inhibitori se folosesc bicromati, fosfati, carbonati etc.
Inhiitorii catodici micsoreaza viteza reactiei catodice a procesului de coroziune, adica a reactiei de reducere a depolarizantului din mediul coroziv ( 2H+ + 2e- → H2 sau 2H2O + O2 + 4e- → 4 HO- ).
Unii inhibitori actioneaza in sensul consumarii ionilor H+ si a oxigenului dizolvat in mediul coroziv; altii spre exemplu cromatii, formeaza compusi greu solubili si blocheaza zonele de pe suprafata metalului in care au loc reactiile catodice. Inhibitorii catodici eficienti sunt sulfitul de sodiu, Na2SO3, hidrazina, N2H4, carbonatul de calciu, Ca(HCO3)2 etc.
2Na2SO3 + O2 → 2Na2SO4
N2H4 + O2 → N2 + 2H2O
Transmiterea comenzilor de la creier la muschi precum si alte procese biologice implica mecanisme electrochimice.
Principalele aplicatii mentionate mai sus permit ca electrochimia sa fie privita ca o stiinta cu si mai multe si importante aplicatii in viitorul apropiat.
Capitolul VI
Legi
Art. 1.
Obiectul prezentei legi il constituie reglementarea protectiei mediului,
obiectiv de interes public major, pe baza principiilor si elementelor
strategice care conduc la dezvoltarea durabila a societatii.
Art. 2.
Formularea definitiilor din aceasta lege este cuprinsa in anexa nr. I la
prezenta lege.
Art. 3.
Principiile si elementele strategice ce stau la baza prezentei legi, in scopul
asigurarii unei dezvoltari durabile, sunt:
a) principiul precautiei in luarea deciziei;
b) principiul prevenirii riscurilor ecologice si a producerii daunelor;
c) principiul conservarii biodiversitatii si a ecosistemelor specifice cadrului
biogeografic natural;
d) principul 'poluatorul plateste';
e) inlaturarea cu prioritate a poluantilor care pericliteaza nemijlocit si grav
sanatatea oamenilor;
f) crearea sistemului national de monitorizare integrata a mediului;
g) utilizarea durabila;
h) mentinerea, ameliorarea calitatii mediului si reconstructia zonelor
deteriorate;
i) crearea unui cadru de participare a organizatiilor neguvernamentale si a
populatiei la elaborarea si aplicarea deciziilor;
j) dezvoltarea colaborarii internationale pentru asigurarea calitatii mediului.
Art. 4.
Modalitatile de implementare a principiilor si a elementelor strategice sunt:
a) adoptarea politicilor de mediu, armonizate cu programele de dezvoltare;
b) obligativitatea procedurii de evaluare a impactului asupra mediului in faza
initiala a proiectelor, programelor sau a activitatilor;
c) corelarea planificarii de mediu cu cea de amenajare a teritoriului si de
urbanism;
d) introducerea parghiilor economice stimulative sau coercitive;
e) rezolvarea, pe niveluri de competenta, a problemelor de mediu, in functie de
amploarea acestora;
f) elaborarea de norme si standarde, armonizarea acestora cu reglementarile
internationale si introducerea programelor pentru conformare;
g) promovarea cercetarii fundamentale si aplicative in domeniul protectiei
mediului;
h) instruirea si educarea populatiei, precum si participarea organizatiilor
neguvernamentale la elaborarea si aplicarea deciziilor.
Art. 5.
Statul recunoaste tuturor persoanelor dreptul la un mediu sanatos, garantand in
acest scop:
a) accesul la informatiile privind calitatea mediului;
b) dreptul de a se asocia in organizatii de aparare a calitatii mediului;
c) dreptul de consultare in vederea luarii deciziilor privind dezvoltarea
politicilor, legislatiei si a normelor de mediu, eliberarea acordurilor si a
autorizatiilor de mediu, inclusiv pentru planurile de amenajare a teritoriului
si de urbanism;
d) dreptul de a se adresa, direct sau prin intermediul unor asociatii,
autoritatilor administrative sau judecatoresti in vederea prevenirii sau in
cazul producerii unui prejudiciu direct sau indirect;
e) dreptul la despagubire pentru prejudiciul suferit.
Art. 6.
Protectia mediului constituie o obligatie a autoritatilor administratiei
publice centrale si locale, precum si a tuturor persoanelor fizice si juridice.
Art. 7.
Responsabilitatea privind protectia mediului revine autoritatii centrale pentru
protectia mediului si agentiilor sale teritoriale.
Capitolul VII
1. Notiuni de protectia muncii
In laboratoarele de electrochimie, ca de altfel in toate laboratoarele de chimie se manuiesc o serie de substante care pot provoca accidente serioase daca nu se respecta anumite reguli. Dintre acestea se mentioneaza acizii si alcaliile concentrate, unii electroliti toxici si unele substante usor inflamabile.
Acizii si alcaliile concentrate cazand pe piele provoaca rani care se vindeca greu. Afara de aceasta, solutiile de acizi, baze si altele cazute pe imbracaminte o deterioreaza.
Solutiile de cianuri sunt foarte periculoase pentru organism mai ales in cazul cand ele cad pe portiuni de piele cu rani deschise. Cel mai toxic este acidul cianhidric care se formeaza prin descompunerea cianurilor de sodiu si potasiu. Destul de vatamatori sunt si oxizii de azot rezultati in operatiile de decapare a probelor metalice.
In laboratoare se pot produce urmatoarele accidente:
Intoxicatii:
a) acute, prin patrunderea in organism a unei cantitati de substanta toxica peste limita admisa
b) cronice, prin acumularea in organism timp indelungat a unor cantitati mici de substanta. Substantele toxice pot patrunde in organism prin: piele, tub digestiv si aparat respirator
Arsuri:
a) termice, cu corpuri fierbinti
b) chimice, cu acizi si baze tari, concentrate, cu brom etc.
Traumatisme produse prin loviri, taieri, explozii etc.
Electrocutari ce apar din cauza montarilor defectuoase a aparaturii.
Pentru prevenirea tuturor accidentelor trebuie cunoscute si respectate o serie de norme de protectie a muncii in laboratoarele de chimie. De asemenea trebuie cunoscute masurile de prim ajutor ce trebuie acordat in cazul producerii accidentelor.
Dintre masurile de protectie a muncii mentionam:
Purtarea obligatorie a halatului, de preferinta alb, incheiat in fata si curat. Alte accesorii pentru protectia individuala sunt: sort si manusi de cauciuc, ochelari de protectie, paravane de protectie, masti contra gazelor si contra prafului.
Nu se fumeaza si nu se ia masa in laborator spre a evita intoxicarile.
Toate experientele se executa cu cantitati mici de substanta si cu multa precautie.
Vasele de lucru trebuie sa fie foarte curate, spalate cu perii, reactivi de degresare, clatite cu multa apa iar la sfarsit de cateva ori cu apa distilata. Vasele de sticla nu se spala cu nisip pentru a nu se produce zgarieturi care duc la plesnirea vasului.
Pe masa de lucru se pastreaza o curatenie si ordine desavarsita.
Inainte de utilizarea reactivilor se citeste eticheta, se toarna solutia tinand eticheta in palma, pentru protejarea ei.
Nu se schimba dopurile flacoanelor.
Substantele chimice nu se gusta, mirosirea substantelor volatile, toxice nu se face direct cu prin miscarea mainii si aducerea unei cantitati mici spre nari.
Vasele de laborator nu se folosesc pentru mancat si baut.
Manipularea, transvazarea, evaporarea, pulverizarea substantelor toxice, acizilor tari, substantelor corozive, oxidante se face sub nise prevazute cu ventilatie eficienta.
Substantele toxice caustice se pipeteaza cu ajutorul perelor de cauciuc.
La turnarea unei solutii dintr-un vas in altul se foloseste palnia pentru a evita raspandirea ei pe masa sau pardoseala.
Solutiile scapate pe scaune sau pardoseala se indeparteaza repede cu o carpa uscata si apoi cu o carpa bine muiata in apa.
Resturile de substante toxice, caustice etc. nu se arunca la canal ci se aduna in borcane si se arunca intr-un loc special amenajat.
Diluarea substantelor caustice se faca asa incat sa se evite stropirea. De exemplu, la diluarea acidului sulfuric se toarna acid in apa si nu invers.
La prepararea solutiilor de acizi sau a amestecurilor de acizi este necesar sa se poarte ochelari; este strict interzisa amestecarea unui acid sau alcalie fierbinte cu apa fierbinte deoarece se produce o puternica improscare a lichidului din vas.
La caderea solutiilor de cianuri pe maini, portiunile respective se spala bine cu apa si apoi cu o solutie de 10% sulfat de fier; picaturile de electrolit de cromare cazute pe piele se indeparteaza repede cu apa, iar daca s-au format pete brune, acestea trebuie spalate cu o solutie constand dintr-o parte alcool, o parte acid clorhidric si doua parti apa.
Cantitatile mari de acizi sau baze concentrate se pastreaza in sticle protejate de cosuri.
Aparatura de sticla nu se incalzeste direct pe flacara.
Becurile de gaz se aprind numai cand e nevoie, se supravegheaza, iar la plecarea din laborator se sting.
In laborator substantele volatile si inflamabile se pastreaza numai in vase cu capacitate mai mica de 1 litru si departe de surse de caldura.
La orice inceput de incendiu se iau masuri imediate de localizare a focului.
Aparatele si instalatiile electrice nu se manipuleaza cu mana umeda (pericol de electrocutare).
Nu se conecteaza mai multe aparate la o singura priza (priza, obligatoriu, se leaga la pamant).
2.Primul ajutor in caz de accidente :
In cazul producerii accidentelor e necesara o interventie rapida, pana la venirea medicului, daca e cazul.
In cazul intoxicatiilor:
cu brom, hidrogen sulfurat, clor, accidentatul se scoate la aer curat;
la intoxicatiile cu brom sau clor se inhaleaza amoniac sau vapori de apa;
la intoxicatiile cu H2S se da accidentatului sa miroase apa de clor diluata sau un tampon cu solutie de clorura de calciu;
la otravire interna cu alcalii se da acid acetic 3%;
la inghitire de acizi se da apa de var;
la otravire cu saruri se da lapte sau albus de ou;
pentru iod se folosesc ca antidot faina, amidon, ceai tare.
In cazul tuturor intoxicatiilor se inlatura hainele imbibate, se face respiratie artificiala, la nevoie, se inveleste accidentatul in paturi si i se incalzesc mainile si picioarele cu sticle cu apa calda.
In cazul arsurilor
termice, se unge suprafata cu solutie de tanin, daca arsura e la suprafata;
chimice, se spala pielea cu multa apa iar apoi
la arsuri cu acizi se spala pielea cu solutie de bicarbonat de sodiu 2%;
la arsuri cu alcalii se spala suprafata arsa cu solutie de acid boric 2% sau acid acetic 1-2%. Dupa neutralizare se unge suprafata arsa cu vaselina sau jecolan si se aplica un pansament;
la arsurile cu fosfor se spala locul cu solutie de CuSO4 sau saruri de mangan;
la arsurile cu brom se spala cu alcool, petrol lampant sau cu solutie de tiosulfat de sodiu 2%;
in cazul arsurilor la ochi se spala ochiul cu ajutorul unui paharel special, cu multa apa, si e necesar neaparat control medical.
In cazul electrocutarii se deconecteaza instalatia si se cheama medicul.
Trusa medicala din laboratorul de chimie trebuie sa contina:
Tifon;
Vata hidrofila;
Tinctura de iod;
Solutie de tanin;
Jecolan;
Solutie NaHCO3 2%;
Solutie acid boric 2%;
Solutie acid acetic 2%;
Solutie Na2S2O3 2%;
Alcool;
Apa oxigenata;
Leucoplast;
Paharel special pentru spalat ochii;
Amidon;
Lapte praf;
Sapun;
Foarfece.
I. Banateanu, M. Popa, F. Barca, Chimie pentru muncitori si tehnicieni din industria chimica, Ed. Tehnica, Buc. 1977
Gh. Vlantoiu, C. Petrescu, V. Marian, Chimie analitica si analize tehnice, Ed. Did. Si Ped., Buc. 1979
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 9313
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved