| CATEGORII DOCUMENTE |
| Aeronautica | Comunicatii | Electronica electricitate | Merceologie | Tehnica mecanica |
1. Termodinamica clasica
1.1 Notiuni de baza
. Sistem termodinamic (o portiune din univers inchisa de o suprafata numita granita a sistemului care delimiteaza interiorul de exterior);
. Stare termodinamica (ansamblul proprietatilor sistemului termodinamic la un moment oarecare);
. Parametri termodinamici (marimile fizice masurate experimental si care caracterizeaza starea sistemului termodinamic);
. Stare de echilibru termodinamic (stare stationara, pentru care nu exista fluxuri stationare in interiorul sistemului);
Proces termodinamic;
Marime de stare si marime de proces
1.2 Principiul general al termodinamicii (o formulare)
Daca un sistem termodinamic este supus unei perturbatii externe la un moment dat atunci, dupa incetarea acestei perturbatii, sistemul evolueaza spontan din starea de neechilibru termodinamic catre o stare de echilibru termodinamic, care va fi atinsa dupa un interval de timp t, denumit durata de relaxare; in aceasta stare de echilibru termodinamic sistemul va ramane un interval de timp nedefinit.
1.3 Principiul zero al termodinamicii (trei formulari)
(1) Daca doua sisteme termodinamice A si B, situate intr-o incinta adiabatica, sunt puse in contact termic atunci, dupa o perioada de timp, se remarca faptul ca o marime fizica ce este caracteristica unei proprietati fizice comune va atinge o valoare stationara; sistemul se va gasi in starea de echilibru termic, iar marimea fizica specifica se numeste temperatura empirica si este notata cu q
(2) Daca doua sisteme termodinamice A si B se afla fiecare in contact termic cu un al treilea sistem termodinamic C, atunci A si B se vor gasi in starea de echilibru termic, iar toate cele trei sisteme termodinamice vor fi caracterizate de aceeasi valoare a temperaturii empirice q. Aceasta formulare este denumita principiul tranzitivitatii echilibrului termic.
(3) Pentru fiecare sistem termodinamic considerat in starea de echilibru termic exista o marime de stare denumita temperatura empirica. Se poate introduce ecuatia termica de stare care, pentru un fluid caracterizat de parametrii de stare p, V si T , are forma:
![]() (1)
(1)
1.4 Principiul intai al termodinamicii (patru formulari)
(1) Daca un sistem termodinamic este inchis intr-un invelis adiabatic atunci lucrul mecanic total efectuat intre doua stari (1) si (2), in urma unui proces termodinamic cvasistatic reversibil oarecare, nu depinde decat de cele doua stari, fiind independent de tipul procesului, adica:
![]() (2)
(2)
unde U reprezinta energia interna.
(2) Energia interna este o marime de stare care defineste ecuatia calorica de stare; in cazul unui fluid oarecare aceasta are forma:
![]() (3)
(3)
(3) Daca un sistem termodinamic efectueaza un proces termodinamic intre doua stari (1) si (2), atunci suma intre lucrul mecanic L si caldura Q schimbate de sistem cu mediul ambiant nu depinde de starile intermediare, ci numai de starea initiala si de cea finala a sistemului:
![]() (4)
(4)
(4) Pentru un proces termodinamic local este satisfacuta ecuatia:
![]() (5)
(5)
unde dL si dQ reprezinta lucrul mecanic elementar si caldura elementara schimbate de sistem cu mediul ambiant, iar dU reprezinta variatia elementara a energiei interne in cursul procesului
![]() (6)
(6)
Ultima
relatie s-a obtinut din (5) tinand cont ca pentru un fluid oarecare inchis
intr-un recipient avem ![]() .
.
1.5 Principiul doi al termodinamicii (sase formulari)
(1) Formularea lui R. Clausius
Caldura nu poate trece in mod spontan de la un corp cu temperatura mai mica la un corp cu temperatura mai mare.
(2) Formularea lui W.Thomson (Kelvin)
Un sistem termodinamic care efectueaza un proces ciclic monoterm nu poate functiona ca masina termica (nu poate efectua lucru mecanic).
(3) Formularea lui Planck
O masina termica nu poate functiona fara compensatie.
(4) Formularea lui Caratheodory
In vecinatatea unei stari de echilibru a unui sistem termodinamic exista stari de echilibru care nu pot fi atinse prin procese adiabatice reversibile.
(5) Teoremele lui Carnot
(a) Egalitatea lui Clausius
Daca un sistem termodinamic efectueaza un proces ciclic reversibil biterm (Carnot), atunci suma caldurilor reduse schimbate cu cele doua termostate este nula.
![]() (7)
(7)
(b) Teorema I-a a lui Carnot
Randamentul unei masini termice care functioneaza conform unui ciclu Carnot reversibil reprezinta valoarea maxima posibila a randamentului unei masini termice, este independent de natura sistemului termodinamic si depinde numai de temperaturile T1 si T2 ale celor doua surse de caldura.
![]() (8)
(8)
(c) Inegalitatea lui Clausius
Daca un sistem termodinamic efectueaza un proces ciclic ireversibil biterm (Carnot), atunci suma caldurilor reduse schimbate de sistem cu cele doua termostate este negativa
![]() (9)
(9)
(d) Teorema a II-a a lui Carnot
Randamentul unei masini termice care functioneaza dupa un ciclu Carnot ireversibil este intotdeauna mai mic decat randamentul masinii termice care ar functiona dupa un ciclu Carnot reversibil.
![]() (10)
(10)
(6) Entropia
(a) Entropia reprezinta o functie (marime) de stare a unui sistem termodinamic a carei variatie elementara pentru un proces reversibil local este egala cu variatia caldurii reduse elementare.
![]() (11)
(11)
Proprietatile entropiei:
. Entropia este definita pana la o constanta aditiva arbitrara.
. Intr-un proces ciclic reversibil variatia entropiei este nula.
. Intr-un proces reversibil adiabatic entropia este constanta.
. In cursul unui proces reversibil deschis variatia de entropie a sistemului termodinamic este egala in marime si de semn schimbat fata de variatia de entropie a mediului ambiant.
. Entropia este o marime aditiva.
(b) In cazul unui proces ciclic ireversibil este satisfacuta inegalitatea:
![]() (12)
(12)
(c) Intr-un sistem izolat sunt posibile numai procesele care pastreaza constanta entropia (procese reversibile) sau care determina o crestere a acesteia (procese ireversibile):
![]() (13)
(13)
1.6 Relatia fundamentala a termodinamicii
. pentru procesele reversibile
![]() (14)
(14)
. pentru procesels ireversibile
![]() (15)
(15)
Dintre aplicatiile relatiei fundamentale a termodinamicii pentru procese reversibile se mentioneaza:
. corelatia intre ecuatia termica de stare ![]() si ecuatia calorica de stare
si ecuatia calorica de stare ![]()
![]() (16)
(16)
. stabilirea expresiei entropiei si a variatiei de entropie pentru u moli sau kilomoli de gaz ideal
![]()
![]() (17)
(17)
![]() (17
(17
![]()
![]() (18)
(18)
![]() (18')
(18')
![]()
![]() (.19)
(.19)
![]() (19')
(19')
![]() reprezinta constante entropice
empirice.
reprezinta constante entropice
empirice.
1.7 Metoda functiilor caracteristice
Metoda functiilor caracteristice (a potentialelor termodinamice) a fost creata de Gibbs si se bazeaza pe relatia fundamentala a termodinamicii.
Functia caracteristica este o functie de stare care permite obtinerea tuturor informatiilor asupra proprietatilor termodinamice ale unui sistem fizic; aceste informatii sunt continute in ecuatiile caracteristice ale sistemului (ecuatiile termice de stare si ecuatia calorica de stare).
Potentialul termodinamic este o functie caracteristica a carei valoare descreste in cursul unui proces ireversibil, atingand un minim in starea finala de echilibru termodinamic a sistemului.
Nu orice functie caracteristica este potential termodinamic, dar orice potential termodinamic este si functie caracteristica.
Pentru un fluid, principalele functii caracteristice care sunt si potentiale termodinamice sunt:
![]() , energia interna (20)
, energia interna (20)
![]() , entalpia (21)
, entalpia (21)
![]() , energia libera (22)
, energia libera (22)
![]() , entalpia libera (23)
, entalpia libera (23)
Relatiile Gibbs-Helmholtz pentru F si G sunt:
![]() (24)
(24)
![]() (25)
(25)
Relatiile Maxwell au forma:
![]() ;
; ![]() (26)
(26)
1.8 Tranzitii de faza
1.8.1 Tranzitiile de faza de
speta I implica coexistenta celor doua faze (g1=g2; entalpiile
libere specifice sunt egale) si discontinuitatea derivatelor de ordinul I ale
entalpiilor libere specifice (care determina discontinuitatea volumelor
specifice, adica ![]() si a entropiilor specifice ale celor doua
faze, adica
si a entropiilor specifice ale celor doua
faze, adica ![]() )
)
Curba de saturatie ![]() separa doua faze 1 si 2; pe curba de saturatie
avem
separa doua faze 1 si 2; pe curba de saturatie
avem
![]()
Punctul triplu implica coexistenta
simultana a trei faze, adica ![]()
Caldura latenta de tranzitie este nenula si satisface relatia lui Clapeyron.
![]() ¹
¹
1.8.2 Tranzitiile de faza de
speta a II-a implica coexistenta celor doua faze (![]() ),
continuitatea volumelor specifce (
),
continuitatea volumelor specifce (![]() )
si a entropiilor specifice (
)
si a entropiilor specifice (![]() ),
precum si discontinuitatea derivatelor de ordinul doi ale entalpiilor libere
specifice. Ultima conditie determina
),
precum si discontinuitatea derivatelor de ordinul doi ale entalpiilor libere
specifice. Ultima conditie determina ![]() ,
,
![]() si
si ![]() ,
unde
,
unde
![]() reprezinta caldura specifica la p=ct.,
reprezinta caldura specifica la p=ct., ![]() este coeficientul de compresibilitate
este coeficientul de compresibilitate 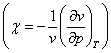 ,
iar a este coeficientul de dilatare termica a volumului
,
iar a este coeficientul de dilatare termica a volumului 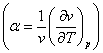 .
.
Tranzitiile de faza de speta a II-a satisfac relatiile lui Ehrenfest.
![]() si
si ![]() (28)
(28)
care pot fi inglobate in
![]() (29)
(29)
1.9 Principiul al III-lea al termodinamicii (trei formulari)
(1) Formularea lui Nernst
![]() (30)
(30)
In vecinatatea lui 0K (zero Kelvin) entropia unui sistem termodinamic este constanta, fiind independenta de variatia oricaror parametri de stare.
(2) Formularea lui Planck
![]() (31)
(31)
Entropia unui sistem termodinamic tinde catre zero atunci cand temperatura termodinamica tinde catre 0K.
(3) Inaccesibilitatea atingerii temperaturii de 0K
Nici un sistem termodinamic nu poate fi racit pina la temperatura de 0K (in sens strict).
2. Termodinamica structurilor disipative
2.1 Concepte fundamentale
Parametrii de stare ai unui sistem termodinamic se pot departaja in trei categorii:
. parametri specifici, caracterizeaza acele proprietati sistemului care se conserva in timp;
. parametri de comportare, caracterizeaza acele proprietati ale sistemului care variaza in timp;
. parametri de control, care caracterizeaza acele proprietati ale sistemului care permit unui observator sa controleze comportarea sistemului, prin modificarea parametrilor de comportare.
Sistemul disipativ ramane intr-o stare de echilibru in care se produce entropie interna compensata de entropia negativa preluata de la mediu, pe care sistemul disipativ il dezorganizeaza cu o anumita viteza, necesara pentru a-si mentine echilibrul sau, altul decat cel termodinamic.
Sistemele termodinamice disipative isi gasesc un model fizic in tranzitiile de faza; aceste sisteme sunt denumite si sisteme sinergetice.
Daca anumiti parametri caracteristici ai sistemului sinergetic variaza, sistemul poate avea la un moment dat mai multe stari de echilibru.
Avem o bifurcatie atunci cand o valoare a parametrului specific separa un domeniu in care parametrul este mai mic decat acea valoare (cand sistemul are o singura stare de echilibru) si un alt domeniu in care acest parametru este mai mare decat valoarea respectiva (cand sistemul are doua stari de echilibru). Aceasta valoare a parametrului specific se numeste valoare de bifurcare.
Conceptul de ordine prin fluctuatii implica trecerea sistemului de la o stare mai putin ordonata la o stare ordonata datorita fluctuatiilor.
2.2 Teorema catastrofelor elementare (teorema lui Ren Thom)
Pentru sistemele caracterizate de maximum patru parametri de control, manifestarea singularitatilor in comportare este posibila printr-una din cele sapte catastrofe elementare; acestea sunt reprezentate prin polinoame de diferite grade, in una sau doua variabile denumite parametri de comportare. Exista sapte tipuri de catastrofe elementare cu maximum patru parametri de control; patru sunt cuspide (pliu, prastie, coada de randunica si fluture) si trei sunt ombilicuri (eliptic, parabolic si hiperbolic).
Se considera sisteme de tip conservativ pentru care sunt satisfacute relatiile:
![]() ;sau
;sau ![]()
![]() (32)
(32)
Schema de aplicare a teoremei catastrofelor elementare la o problema practica este urmatoarea:
se precizeaza parametrii de comportare ai sistemului si cei de control;
este necesar ca numarul parametrilor de comportare sa nu depaseasca 2 (se noteza cu x, y), iar al parametrilor de control sa nu depaseasca 4 (se noteaza cu a,b,c,d);
se alege catastrofa elementara corespunzatoare (se stabileste V(x) sau V(x,y))
se stabilesc conform relatiilor (VII.59) ecuatiile:
![]() sau
sau
![]() (33)
(33)
Solutiile unui astfel de sistem definesc suprafata de comportare a sistemului. Pe suprafata de comportare exista zone interzise (zone care nu corespund unui minim al functiilor V(x) sau V(x,y)). Daca in spatiul de control apare o zona de bifurcatie sistemul trece din zonele interzise in zonele permise, proces care corespunde unei catastrofe.
2.3 Principiul de dominare (principiul lui Hermann Haken)
In vecinatatea punctului de instabilitate parametrii instabili ii domina pe cei stabili; parametrii instabili sunt denumiti parametri de ordine, deoarece ei dicteaza noile proprietati de ordine ce caracterizeaza sistemul. Prin pastrarea parametrilor de ordine suntem asigurati ca nu pierdem informatia asupra parametrilor stabili si ne bucuram totodata de avantajul eliminarii unui numar foarte mare de parametri.
Principiul de dominare permite selectarea unui numar mic de parametri de comportare care sa descrie corect si complet starea sistemului denumiti parametri de ordine (parametri instabili).
Parametrii de control ai sistemului pot defini intr-un anumit moment pe suprafata de comportare, un anumit punct de instabilitate in care sistemul isi pierde proprietatea de stabilitate structurala.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1807
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved