| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Raport de Cercetare
ANALIZA DETERMINISNULUI SEXULUI LA PLANTE DIOCE DIN FLORA ROMANIEI PRIN METODE DE GENETICA MOLECULARA
INTRODUCERE
Dioicia este larg raspandita la plantele cu flori, in ciuda recentei lor origini evolutioniste: 6% din 240.000 specii de angiosperme sunt dioice si 7% din 13.000 genuri de angiosperme includ specii dioice, sugerand ca aceasta a aparut de mai multe ori in timpul evolutiei plantelor cu flori. Dioicia este corelata cu cresterea plantelor perene, polenizarea cu ajutorul vantului sau apei si are preponderenta in flora tropicala.
In Romania exista un numar 109 taxoni dioici de traheofite spontane sau subspontane, reprezentand 2,78 din Flora Romaniei.
Sistemele de determinarea a sexului bazate pe prezenta cromozomilor de sex heteromorfici X si Y sunt interesant de studiat din perspectiva dezvoltarii si cea evolutionista. Exista multe paralele intre sistemele de determinare a sexului, ca si in organizarea cromozomilor de sex, la diferite specii, chiar intre animale si plante. Evolutia sistemelor de cromozomi de sex heteromorfi la specii foarte diferite sugereaza ca forte similare au actionat in fiecare caz [21].
Problematica evolutiei determinarii sexului la plantele dioice este actuala si abordata de numeroase grupuri de cercetatori [4]. Speciile model cu o determinare cromozomala a sexului sunt Silene latifolia (sistem XY), Humulus lupulus (sistemX :A) si Rumex ssp.(care au atat sistem XY cat si X :A).
La Silene latifolia, plantele femele sunt homogametice (2n=24, XX) si plantele mascule sunt heterogametice (2n=24, XY), perechea de cromozomi de sex X, Y, reprezentand ~16% din dimensiunea totala a genomului diploid mascul. Cromozomul Y este de 1,4 ori mai mare decat cromozomul X, de 1,6 ori mai mare decat perechea de autozomi cea mai mare si de 1,9 ori mai mare decat dimensiunea medie a autozomilor. Diferentele intrinseci intre autozomi si cromozomii X si Y, au dus la conculzia ca heterozomii de la Silene latifolia au evoluat relativ recent in contrast cu originea veche a cromozomlor de sex prezenti la insecte si mamaliene, aceasta planta devenind astfel un model ideal pentru studiul evolutiei genomului [9].
Rumex acetosa are un sistem multiplu de cromozomi de sex cu 2n = 12 + XX la plantele femele si 2n = 12 + XY1Y2 la plantele mascule. Determinarea primara a sexului este independenta de prezenta sau absenta cromozomului Y. Dezvoltarea partilor florii mascule este de asemenea independenta de prezenta cromozomului Y [23]. Cromozomul X contine gene ce sunt esentiale pentru determinarea sexului. Un asemenea sistem X :A de determinare a sexului trebuie sa implice si gene localizate pe autozomi. Desi nu sunt necesari pentru determinarea sexului, cei doi cromozomi Y sunt necesari pentru fertilitatea masculuina. Determinarea sexului la Rumex acetosa este influentata si de numarul si tipul autozomilor [1,16].
La Humulus lupulus L. (2n = 20) constitutia complementului la plantele femele este 2n = 18 + XX, iar la plantele mascule 2n = 18 + XY. Expresia sexului este determinata de sistemul balanta X : autozomi, unde raportul 0,5 corespunde unui fenotip mascul, raportul 1 corespunde unui fenotip femel. Rapoartele intermediare fiind asociate cu intersexualitatea. O planta care nu are in complement cromozomul Y, este sterila, secvente localizate pe cromozomul Y fiind necesare pentru inducerea stadiilor tarzii ale diferentierii celulei mama polinice. Toate aceste fenotipuri sunt supuse variatiei, probabil datorita influentei efectelor fondului genotipic [22, 23].
Astfel expresia sexului la Humulus lupulus, la fel ca la Rumex acetosa, poate fi determinata de gene localizate atat pe cromozomul X cat si pe autozomi [22].
Mecanismele corespunzatoare aparitiei dioiciei la plante, nu au fost elucidate la nivel molecular pana acum, dar este clar ca dimorfismul sexual este o decizie tarzie de dezvoltare in timpul ciclului de viata al plantelor, in principal restranse la organogeneza florii sau diferentierea organelor reproductive [8].
Recent au fost izolate la Silene latifolia, gene sex-linkate si alte secvente ADN folosind: i) ADNc sau metode de obtinere a bibliotecilor genomice [2, 7, 11, 16, 19, 20]; ii) cromozomi de sex microdisecati si amplificati prin DOP-PCR cu primeri oligonucleotidici degenerati, folositi ca sonde pentru screeningul bibliotecilor ADNc [5] sau pentru FISH [3], iii) metode bazate pe PCR cum este RAPD [14]. Aceste studii au avut ca rezultat izolarea de secvente repetitive [3, 7, 20] si descoperirea unui grup de 4 gene numite gene MROS (male reproductive organ-specific), exprimate specific numai in organele reproducatoare mascule [11, 12].
Grupul de gene Mros prezent atat in genomul plantelor mascule cat si in genomul plantelor femele, cuprinde: MROS1 gena implicata in formarea graunciorului de polen, MROS2 gena cu rol in stadiile tarzii ale maturarii anterei, MROS4 gena cu rol in stadiul initial al dezvoltarii mugurelui floral [20], si gena MROS3, izolata independent de trei grupuri de cercetatori [9, 11, 17] cu rol in maturarea tapetumului anterei. Cu exceptia genei MROS3 care este localizata in cel putin doua copii aranjate in tandem pe cromozomul X, aditional in doua copii pe autozomi [13] precum si o pseudogena omoloaga pe cromozomul Y [8], toate celelalte gene MROS au localizare exclusiv autozomala [8]. Gena MROS1 (1375 pb) si gena MROS4 (600 pb) prezinta introni in timp ce gena MROS2 (785 pb) si gena MROS3 (433 pb) nu prezinta introni [10].
Prin aplicarea reactiei PCR utilizand primeri specifici si matrita ADN genomic, gena MROS3 a fost identificata si la alte specii de Silene. Astfel la specia dioica Silene diclinis si specia ginodioica Silene vulgaris, s-a obtinut banda specifica genei MROS3 de aceeasi marime cu cea identificata la Silene latifolia [10]. De asemenea, la Arabidopsis thaliana [24], specie neinrudita cu genul Silene, s-au identificat 5 gene omoloage cu gena MROS3, care au fost numite AtMROS3a, AtMROS3b, AtMROS3c, AtMROS3d, AtMROS3e, sugerand originea veche a acestei gene. S-a aratat ca cel putin doua copii ale genei MROS3 sunt aranjate in tandem pe cromozomul X la Silene latifolia. Surpinzator, aceste date au relavat ca in genomul speciei A. thaliana, genele omoloage de pe autozomi, sunt de asemenea aranjate in tandem. Totusi pe baza acestor rezultate nu se poate spune daca evenimentele acestei duplicatii au avut loc in genomul ancestral sau independent in Silene latifolia si Arabidopsis thaliana [10].
Mai putine studii sunt asupra genei MROS2 care este o gena fara introni si se exprima atat in staminele florilor mascule normale de Silene latifolia, cat si in staminele induse in florile femele datorita infectiei cu Ustilago violacea.
In studiul de fata am pornit de la faptul ca desi neinrudite filogenetic, la cele trei specii : Silene latifolia, Rumex acetosa si Humulus lupulus, exista pe langa un determinism sexual datorat prezentei genelor cu localizare pe cromozomii de sex, si gene cu localizare autozomala, care intervin in expresia sexului.
Cercetarile noastre au vizat obtinerea ADN genomic total din cele palnte mascule si femele apartinand celor trei specii si identificarea prezentei genei MROS2 prin reactia de PCR si localizarea ei prin hibridizare in situ. .
MATERIALE SI METODE
MATERIAL
Silene latifolia ssp. alba (Poiret), familia Caryophylaceae, plantele femele, mascule si plante femele infectate cu Ustilago violacea au fost recoltate din Gradina Botanica Bucuresti si parcul Universitatii Politehnica
Rumex acetosa ssp. acetosa (L.), familia Polygonaceae, plantele mascule si femele provin din Gradina Botanica Bucuresti si localitatea Sinaia, judetul Prahova
Humulus lupulus (L.), familia Canabinaceae, plantele mascule si femele au fost recoltate din Gradina Botanica Bucuresti.
METODE
Izolarea ADN-ului genomic total prin tehnica CTAB (S. O. Rogers and A. J. Bendich, 1994) [21, 25, 27], adaptata materialului vegetal (tesut foliar) provenit de la plante mascule, plante femele, si femele infectate cu Ustilago violacea de Silene latifolia ssp. alba, plante mascule si femele de Rumex aceotosa ssp. acetosa si plante mascule si femele de la Humulus lupulus.
Analiza spectofotometrica a puritatii si concentratiei a ADN-ului cromozomal izolat
Verificarea spectofotometrica s-a realizat cu aparatul Specord 40-Analitikjena, citirea absorbantei a ADN-ului genomic total s-a realizat in spectru de absorbtie 200-300 nm, folosind ca blanc, tampon de rehidratare a ADN , utilizand programul WinAspect 1.6.3.0
Reactia PCR (Polymerase Chain Reaction) [21], pentru amplificarea genei MROS2. Reactia s-a realizat in volum final de 50μl: 5μl tampon 10X, 2μl amestec dNTP 10mM, 1μl primer MROS2-F1, 1μl primer MROS2-R1 (Sigma), 2 μl ADN polimeraza Taq (5U), 2μl ADN matrita, 3μl BSA 3mg/ml, apa distilata sterila pana la volumul final. Etapa initiala de denaturare a ADN-ului s-a realizat la 94 oC, 5 min, s-au efectuat 30 cicluri de amplificare: 1 min. 94 oC, 1 min. 55 oC,1 min. 72 oC,elongarea finala la 72oC, 7 min. Reactia s-a realizat cu aparat Gene Amp PCR System 2400 - Perkin Elmer.
Tabel 1 Primerii si secventele lor, folositi pentru amplificarea genei MROS2 (dupa E. Kejnovsky si co., 2001)
|
Primer |
Secventa primer |
|
MROS2-F1 |
5'-ACT AGA AAT AAT GGG GTC AC-3' |
|
MROS2-R1 |
5'-GCA TGC ATT AAT CTC CCT AG-3' |
Electroforeza in gel de agaroza (1%-1,5%), pentru verificarea integritatii ADN-ului genomic izolat si a rezultatelor reactiei de amplificare genica. Colorarea s-a facut cu bromura de etidium, vizualizarea s-a realizat la transiluminator (λ =302 nm), urmata de fotografierea cu aparat Polaroid Gel Cam. Markeri moleculari de greutate utilizati: pGEM , 100bp si DNA/BstEII (Promega).
5. Obtinerea de cromozomi mitotici prin realizarea de preparate squash din varfurile meristematice ale radicelelor (obtinute prin germinarea semintelor), prefixate in colchicina 0,05%, 2 ore la temperatura camerei, fixate in etanol : acid acetic 3 :1, minim 24 ore, hidrolizate cu HCL 1N, 15 minute la 60 C. Preparatele microscopice squash au fost realizate in apa acetica 45% si vizualizate la microscop in contrast de faza.
Obtinerea sondei marcate cu fluorocrom prin reactia PCR.
Reactia s-a desfasurat dupa protocolul descris la amplificarea genei MROS2. Modificarile au fost urmatoarele: 1μl dATP(10mM), 1μl dCTP(10mM), 1μl dGTP(10mM), 0,65μl dTTP(10mM), 3,5μl Fluorescein-12-2'-deoxy-uridine-5'-triphosphate(1mM); 3 μl produs de amplificare obtinut din Silene latifolia ssp.alba s-a folosit ca matrita
7. Hibridizarea in situ folosind sonda marcata fluorescent (FISH)
Pretatamentul lamelor : peste lamele continad metafazele selectate la microscopul in contrast de faza, se toarna solutie 2xSSC ce contine 90 g/ml RN-aza si se incubeaza 1h la 37 C. Dupa 2 spalari de 5 minute in 2xSSC la 37 C, se adauga solutie de paraformaldehida 4% la temperatura camerei si se incubeaza 10 minute. Se fac 3 spalari de 3 minute in 2xSSC la 37 C. Apoi se introduc in baie de formamida 70% la 70 C pentru 2 minute, urmata de bai reci cu etanol 70%, 90%, 100% cate 5 minute. Dupa deshidratarea in baile de alcool, lamele se usuca la aer.
Amestecul de hibridizare l apa distilata sterila, 15 l formamida, 1,5 l 20xSSC, 6 l dextran sulfat 50%, 1,5 l SDS 20%, 2 l ADN carrier (10mg/ml), 2 l sonda (amplicon marcat fluorescent).Inainte de pipetarea pe lama, amestecul se denatureaza 10 minute la 70 C, si se plaseaza 5 minute pe gheata.
Hibridizarea propriu-zisa : se adauga pe lama 30 l amestec de hibridizare, se acopera cu o lamela si se incubeaza la intuneric, 14 ore la 37 C.
Tratament post-hibridizare : dupa doua spalari cu solutie 2xSSC, si una cu solutie 4xSSC/Tween 20 0,4%, colorarea lamelor se face cu solutie 2 g/ml DAPI (4',6-Diamidino-2-phenylindole), 5 minute in camera umeda, urmata de 2 spalari in solutie 4xSSC/Tween 20 0,4%. Montarea preparatelor se face in glicerol : tampon Mc Ilvaine 1 :1.
Vizualizarea preparatelor fluorescente, s-a realizat folosit microscopul
Ceti-Triton, programul de prelucarea computerizata de imagine Image-Pro Plus si
imprimata
Studiul a avut doua tipuri de abordari, atat aplicarea metodelor de citogenetica clasica, pentru evidentierea prezentei heterozomilor in genomul plantelor analizate, cat si aplicarea metodelor moderne, aplicarea reactiei de PCR si hibridizarea in situ.
Preparatele microscopice realizate din radicele provenind de la speciile Silene latifolia, Rumex acetosa si Humulus lupulus, au pus in evidenta prezenta cromozomilor de sex heteromorfi. Cromozomii de sex la speciile Silene latifolia si Rumex acetosa sunt cei mai mair din complement. Cromozomul Y la Silene latifolia este mai mare comparativ cu cromozomul X, in timp ce la Rumex acetosa, cromozomul X este mai mare ca dimensiune decat ce doi cromozomi Y. La Humulus lupulus heterozomii sunt de dimensiune mai redusa, comparativ cu cei mai mari autozomi, cromozomul X fiind mai mare decat cromozomul Y.
Extractia ADN-ului genomic total prin metoda CTAB din tesut foliar proaspat, provenit de la cele trei specii de plante dioice, a fost adapata in functie de specie, modificarile efectuate in protocol au vizat in special purificarea ADN-ului prin precipitarea proteinelor si polizaharidelor. Cantitatea de ADN obtinuta prin aplicarea acestei metode este intre 0,3-0,8 mg/g de tesut foliar. Rehidratarea finala a ADN-ului s-a realizat in 50μl tampon TE.
Raporturile A260/280 si A260/230 obtinute in urma analizei spectofotometrice a ADN-ului obtinut, demonstreaza prezenta unor cantitati mici de contaminanti proteici si polizaharidici.
In urma analizei electroforetice a ADN-ului cromozomal izolat de la cele trei specii de plante dioice luate in studiu : Silene latifolia ssp.alba, Humulus lupulus si Rumex acetosa ssp. acetosa, s-a constatat ca metoda aplicata duce la obtinerea unui ADN nefragmentat si intr-o concentratie suficienta pentru a putea fi folosit in reactia de PCR. (fig.1- 3 )
![]()



1 2 3 4
Fig.1 . Electroforeza in gel de agaroza (1%) a ADN-ului extras din plante de Silene latifolia :
1. planta femela, 2-3 planta genetic femela infectata cu Ustilago violacea, 4. planta mascula.
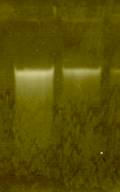
![]()
![]()
Fig.2 . Electroforeza in gel de agaroza (1%) a ADN-ului extras din plante de Humulus lupulus : 1. planta femela, 2. planta mascula.
![]()

1 2 3 4 5
Fig.3 . Electroforeza in gel de agaroza (1%) a ADN-ului extras din plante de Rumex acetosa :
1. Marker de greutate pGEM, 2-3 planta femela, 4-5. planta mascula.
Pentru identificarea prezentei genei MROS2 la Silene latifolia, cu localizare autozomala, prin reactia de PCR, s-au selectat doua probe de ADN genomic total, provenind de la o planta femela si o planta mascula.
Folosind primeri specifici MROS2-F1 si MROS2-R1, s-au obtinut apliconi din ambele probe de ADN, cu greautate moleculara corespunzatoare valorii de 785pb, specifica genei MROS2, iar estimarea greutatii s-a facut prin comparare cu markerii moleculari de greutate DNA/BstEII si pGEM (fig.4)
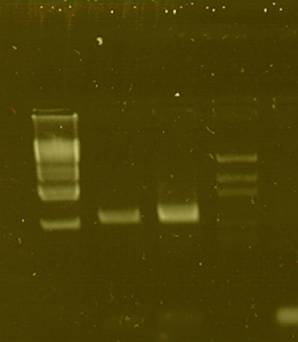
1 2 3 4
![]()
![]()
Fig. 4. Verificarea electroforetica in gel de agaroza (1,5%) a produsilor reactiei de PCR pentru gena MROS2 (785 pb). 1- marker de greutate moleculara DNA/BstEII, 2. aplicon obtinut din ADN izolat de la planta femela 3. aplicon obtinut din ADN izolat de la planta mascula. 4. marker de greutate pGEM , 5. martor negativ
Identificarea genei MROS2 la Silene latifolia, a reprezintat un prim pas pentru studiile ulterioare aplicate la Humuls lupulus si Rumex acetosa, pentru identificarea existentei a acestei gene, la cele doua specii de plante dioice. In literatura de specialiate sunt referiri privind prezenta genei MROS3 si la Arabidopsis thaliana.
Prezenta a genei de interes MROS2 in genomul plantelor de Rumex acetosa a fost stabilita prin reactia PCR cu primeri specifici (tabel 1), pe ADN extras din tesut foliar de la plante mascule si femele. Aplicarea reactiei PCR pe ADN extras din tesut foliar de la plante mascule si plante femele de Humulus lupulus, nu a pus in evidenta prezenta genei MROS2 in genomul acestei plante.
Variantele de reactie au fost stabilite pornind de la protocolul stabilit pentru Silene latifolia, modificarile per reactie au fost: 30-35 cicluri de amplificare, temperatura de denaturare 55-560C, cantitatea de enzima Taq 0,5-2 l.
1 2 3 4 5 6
![]()
![]()
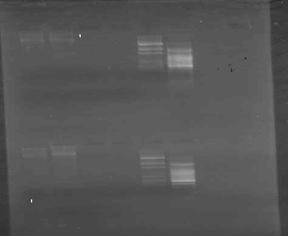
1' 2' 3' 4' 5' 6'
Fig.5 Electroforeza in gel de agaroza (1,5%) a produsilor reactiei de PCR pentru gena MROS2 (785bp): 1,1' produsi de amplificare nespecifici obtinuti din ADN extras din plante femele de Rumex acetosa ; 2, 2' produsi de amplificare nespecifici obtinuti din ADN extras din plante mascule de Rumex acetosa : 3, 3'lipsa produsilor de amplificare din ADN extras din plante femele de Humulus lupulus ;
4, 4' lipsa produsilor de amplificare din ADN extras din plante mascule de Humulus lupulus ;
5, 5' marker molecular de greutate pGEM; 6, 6' marker molecular de greutale de 100pb
In urma efectuarii electroforezei produsilor reactiei de amplificare PCR s-a stabilit prezenta genei MROS2 la plantele mascule si femele de Rumex acetosa si nu s-a pus in evidenta prezenta acesteia la Humulus lupulus (Fig. 5). Intrucat produsii de amplificare PCR obtinuti initial, din ADN de Rumex acetosa au fost partial degradati (fig.6), am adaptat protocolul la particularitatile acestei specii. Prin modificarea conditiilor de lucru, s-a reusit obtinerea de ampliconi specifici genei de interes MROS2 (785bp) in genomul plantelor mascule si o slaba reprezentare in genomul plantelor femele.
De aceea studiile au continuat numai pentru specia Rumex acetosa, atat pentru imbunatatirea parametrilor reactiei de amplificare (Fig. 6, 7) cat si efectuarea hibridizarii in situ pe preparate microscopice mitotice, obtinute de la plante femele si mascule.
1 2 3 4 5 6 7 8 9
![]()
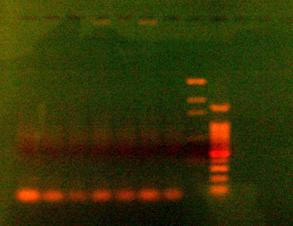
Fig. 6 Electroforeza in gel de agaroza (1,5%) a produsilor reactiei de PCR pentru gena MROS2 (785bp). 1, 3, 5 produsi de amplificare partial degradati obtinuti din ADN extras din plante femele de Rumex acetosa ; 2, 4, 6 produsi de amplificare partial degradati obtinuti din ADN extras din plante mascule de Rumex acetosa ; 7. martor negativ; 8. marker molecular de greutate pGEM; 9. marker molecular de greutate 100bp
![]()
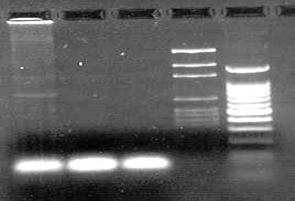
Fig. 7 Electroforeza in gel de agaroza (1,5%) a produsilor reactiei de PCR pentru gena MROS2 (785bp). 1. amplicon obtinut din ADN izolat din plante mascule de Rumex acetosa ; 2. amplicon obtinut din ADN izolat din plante femele de Rumex acetosa; 3. martor negativ ; 4. marker molecular de greutate pGEM; 5. marker molecular de greutate 100bp
Hibridizarea in situ, este o metoda propusa de catre Gall si Pardue (1969) si care permite detectarea diverselor secvente tinta ADN, de la o copie unica pana la secvente inalt repetitive. De obicei secventele ADN sunt hibridizate in nuclei si cromozomi fixati pe lame de sticla, principiul metodei constand in denaturarea acizilor nucleici, direct in preparatul microscopic - in situ- urmata apoi de renaturarea, in prezenta de segmente ADN sau ARN, cu omologie cu o anumita secventa din structura lor. Hibridizarea in situ cu sonde marcate fluorescent poarta numele de FISH ( Fluorescence in situ hybridization), permite evidentierea secventei de interes atat la nivel cromozomial cat si in nucleii interfazici. Sonda este o secventa omoloaga secventei tinta si una din tehnologiile prin care se poate obtine este tehnologia PCR, in care rezulta secvente nucleotidice marcate prin diferite metode. Sondele cu o lungime mare (100-1000pb), ca si cea folosita de noi pentru localizarea genei MROS2 pe autozomi au o stabilitate mai mare a hibridului.
Pentru obtinerea sondei necesare hibridizarii am folosit primeri specifici secventei flancatoare situsului de insertie (tabel 1), si o nucleotida marcata din cele 4 (dTTP, dATP, dGTP, dCTP). Marcarea sondei ADN specifica genei MROS2 de la specia Silene latifolia a fost obtinuta prin reactie de reamplificare a produsilor de 785 pb obtinuti prin reactia de amplificare PCR si folositi ca matrita, utilizand un fluorocrom - Fluorescein-12-2'-deoxy-uridine-5'-triphosphate. Contracolorarea s-a facut cu DAPI (4',6-diamino-2-fenilindol).Aplicarea tehnicii FISH nu a dat rezultate concludente privind localizarea autozomala a genei MROS2 la Rumex acetosa, ceea ce impune continuarea cercetarilor.
|
|
|
Fig. 8 Tehnica FISH aplicata pe nuclei interfazici de Rumex acetosa
CONCLUZII:
Studiul nostru privind identificarea genei implicate in maturarea anterelor, cu localizare autozomala, MROS2 a stabilit :
1. Prezenta genei in genomul plantei Silene latifolia
2. Prezenta acestei gene la Rumex acetosa, atat prin reactia de PCR, cat si prin FISH. Localizarea ei precis autozomala la aceasta specie, urmand a fi rezolvata in studii ulterioare.
La Humulus lupulus, prezenta genei MROS2 nu a fost pusa in evidenta prin reactie de PCR.
Aceste studii vor fi continuate prin metoda Southern blot, pentru confirmarea rezultatelor prezentate.
BIBLIOGRAFIE:
J. ANTONOVICS, H. M. ALEXANDER Proc.R. Soc. London, Ser. B. 250: 157-163 (1992)
N. BARBACAR, S. HINNISDAELS, I. FARBOS, F. MONGER, A. LARDON et al., Plant J., 12: 805-817 (1997)
J. BUZEK, H. KOUTNKOV, A. HOUBEN, K. ŘHA, B. JANOUŚEK et al., Chromosome Res., 5: 57-65 (1997)
D. CHARLESWORTH, D.S. GUTTMAN, in: Sex Determination in Plants, eds C.C. Ainsworth, BIOS Scientific Publisheds Ltd. Oxford, 1999, pp. 25-50
DIG Application Manual for Filter Hybridization Roche Molecular Biochemicals 2000
C. DELICHRE, J. VEUSKENS, M. HERNOULD, N. BARBACAR, A. MOURAS et al., EMBO J., 18: 4169-4179 (1999)
I. S. DONNISON, J. SIROKY, B. VYSKOT, H. SAEDLER, S. R. GRANT, Genetics 144: 1893-1901 (1996)
D.S. GUTTMAN, D. CHARLESWORTH, Nature 393: 263-266 (1998)
S. HINNISDAELS, A. LARDON, N. BARBACAR, I. NEGRUTIU, Plant Mol. Biol., 35: 1009-1014 (1997)
E. KEINOVSK, J. VRNA, S. MATSUNAGA, P. SOUČEK, J. SIROK, J. DOLEZEL, B. VYSKOT, Genetics 158: 1269-1277 (2001)
S. MATSUNAGA, S. KAWANO, H. TAKANO, H. UCHIDA, A. SAKAI et al., Plant J., 10: 679-689 (1996)
S. MATSUNAGA, S. KAWANO, T. KUROIWA, Plant Cell Physiol., 38: 499-502 (1997)
S. MATSUNAGA, K. SCHUTZE, I. S. DONNISON, S. R. GRANT, T. KUROIWA, et al., Plant J., 20: 1-8 (1999)
R. L. MIESFELD, Applied Molecular Genetics, 1999, pp.18-19
D. L. MULCAHY, N. F. WEEDEN, R. KESSELI, S. B. CARROLL, Sex. Plant Reprod., 5: 86-88 (1992)
PARKER J. S., Chromosome today, vol. II, Ed. A.T. Summer, A.C. Chandley, Publised by Chapman &Hall, London (1993)
17.S. E. ROBERTSON, Y. LI, C.P. SCUTT, M. E. WILLIS, P. M. GILMARTIN , Plant J. 12: 155-168, (1997)
18. J. SAMBROOK, E. F. FRITSCH, T. MANIATIS, Molecular Cloning - a laboratory manual, Second Edition, Ed. Cold Spring Harbor Laboratory Press, 1989, 6 (6.3-6.20), 14 (14.5-14.20)
19. C. P. SCUTT, P. M. GILMARTIN, Plant Reprod., 11: 236-240, (1998)
20. C. P. SCUTT, Y. LI, S. E. ROBERTSON, M. E. WILLIS, P. M. GILMARTIN, Plant Physiol., 114: 969-979, (1997)
21.C. P. SCUTT, S. E. ROBERTSON, M. E. WILLIS, Y. KAMISUGI, Y. LI, M. R. SHERNTON, R. H. SMITH, H. MARTIN, P. M. GILMARTIN, Sex determintion in Plants, eds. C.C. Ainsworth, BIOS Scientific Publisheds Ltd. Oxford, 1999, pp. 25-50.
22. SHIBATA F., HIZUME M., KUROKI Y., Genome 43:391-397, 2000
23. SHEPHARD H., PARKER J., DARBAY P., C. AINSWORTH C.C., Sex determintion in Plants, eds. C.C. Ainsworth, BIOS Scientific Publisheds Ltd. Oxford, 1999, pp. 137-147.
24. THE ARABIDOPSIS GENOME INITIATIVE, Nature, 408: 796-815, (2000)
25. T. VASSU, I. STOICA, O. CSUTAK, F. MUSAT, Genetica microorganismelor si inginerie genetica microbiana - note de curs si tehnici de laborator, Ed. Petrion Bucuresti, 2001, pp. 70-82, 143-154
26. A. R. LEITCH, T. Schwarzacher, D. JACKSON, J. LEITCH, In situ ybridization. Microscopy handbooks 27. BIOS Scientific Publishers
27. S. O. ROGERS, A. J. BENDICH, Plant Molecular Biology Manual D1: 1-8, Second edition, eds. Stanton B, Gelvin Robbert A. Schilperoort, Kluver Academic Publishers, Dordrecht-Boston-London, 1994
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2071
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved