| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Determinarea entalpiei de dizolvare
Principiul lucrarii:
Procesul de dizolvare a substantelor este insotit de un efect termic, denumit caldura de dizolvare, care depinde de interactiile moleculelor sau ionilor substantei (ex. NaCl), care se dizolva cu moleculele dizolvantului (H2O). De exemplu, in cazul cristalelor Na+Cl− ionice in apa, caldura de dizolvare la presiune constanta, Hdiz poate fi explicata in felul urmator: intr-o prima etapa, sub actiunea apei, ionii imobili de Na+ si Cl− care ocupa nodurile retelei cristaline sunt indepartati unii de altii pana la distante atat de mari, incat forta coulombiana de interactiune dintre ei devine nula; ionii devin independenti si mobili in apa. Acest proces absoarbe energie din exterior, astfel ca dizolvarea sarurilor ionice are loc cu scadere de temperatura.
Scopul lucrarii este determinarea entalpiei de dizolvare pentru trei saruri, de exemplu: NH Cl, KNO , K SO
Aparatura si substante:
Aparatura: calorimetru, cilindru gradat de 100 cm3, termometru
Substante: saruri NH Cl, KNO , K SO
Modul de lucru:
Caldura de dizolvare se determina cu ajutorul unui sistem adiabat.
se introduc in paharul Berzelius fixat in cilindrul de polistiren expandat 100 cm de apa distilata, masurata cu un cilindru gradat si se urmareste stabilizarea temperaturii la termometru; se noteaza aceasta valoare ti;
se cantaresc la balanta tehnica, pe o hartie lucioasa de cantarire, 1 g dintr-o sare de mai sus si se introduce in apa sistemului calorimetric. Se observa variatia de temperatura in timpul procesului de dizolvare. Cand toata sarea s-a dizolvat, temperatura ramane constanta se noteaza ca temperatura finala tf.
Calcule si rezultate: Entalpia de dizolvare, ca si cea de neutralizare, se calculeaza dupa relatia:
![]() (3.3.1)
(3.3.1)
in care:
Q - cantitatea de caldura din calorimetru (cal);
n - numarul de moli de substanta dizolvata (mol);
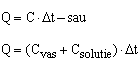 (3.3.2) in cazul de fata Cvas=20 cal/grad,
iar Csolutie=100 cal/grad
(3.3.2) in cazul de fata Cvas=20 cal/grad,
iar Csolutie=100 cal/grad
Deci Q=(20 + 100)t = 120 t (3.3.3.)
Numarul de moli, n, de substanta dizolvata se calculeaza raportand masa de substanta (1g) la masa ei moleculara, M.
De exemplu, pentru KNO3, MKNO3 = 39 + 14 + 48= 101 (g/mol) si deci, n este: n = 1/101 = 0,0099 moli ~ 0,01 moli.
Introducand Q si n in relatia (3.3.1) se obtine entalpia de dizolvare H.
Se alcatuieste tabelul:
Tabelul 3.3.1
|
Sarea |
m (g) |
M (g/mol) |
n (mol) |
ti (oC) |
tf (oC) |
t (oC) |
Q (cal) |
H (cal/mol) |
|
| ||||||||
Interpretarea rezultatelor: In functie de semnul conventional al lui H se apreciaza natura endoterma sau exoterma a procesului, iar in functie de valoarea entalpiei de dizolvare se ordoneaza sarurile studiate in sensul cresterii H.
Tema de casa:
La dizolvarea in 30 cm3 apa a 3 g Mg(NO3)2 se observa o diferenta de temperatura de 20C. Sa se determine entalpia de dizolvare, daca Cvas = 50 cal/grad.
Stiind ca entalpia de dizolvare a Mg(NO3)2 2H2O este 10,32 Kcal/mol sa se stabileasca ce diferenta de temperatura se va obtine la dizolvarea a 2,5 g in 30 mL apa (Cvas = 50 cal/grad).
Marea Neagra contine 14 g/L sare, NaCl; daca la dizolvarea NaCl intr-un calorimetru se formeaza 200 g solutie cu aceeasi concentratie ca in Marea Neagra,iar scaderea temperaturii solutiei (∆t) este 0,23C, caldura specifica a solutiei fiind 4,18 J/g ∙grad , sol = 1 g/mL, entalpia molara de dizolvare a NaCl este:
a. 192,28 J , b. 192,28 kJ mol c. 4,02 kJ mol
Care este entalpia de reactie atunci cand se dizolva 98 g H2SO4 in 36 g apa?
.Sa se determine caldura de dizolvare pentru uree, stiind ca dupa dizolvarea a 5 g uree in 100 g apa cu temperature initiala de 20o C, temperature scade la 18o C. Constanta calorimetrului utilizat este de 0,14 KJ/grad, iar caldura specifica a apei este 4,18 KJ/grad.
.Intr-un calorimetru ce contine 700 g apa la temperatura de 19,2 oC se adauga 200 g apa cu temperatura de 50 o C. Temperatura de echilibru este 24,3 oC. Sa se calculeze constanta calorimetrului. Se cunoaste caldura specifica a apei este 4,18 KJ/grad.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4897
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved