| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
ELECTROLITI AMFOTERI (AMFIPROTICI)
O serie de electroliti ca: Zn(OH)2, Al(OH)3, Sn(OH)2, Pb(OH)2, Sb(OH)3, As(OH)3, Ga(OH)3, aminoacizii etc. sunt electroliti amfoteri (amfiprotici, amfoliti) ca si apa.
La acesti electroliti este caracteristica posibilitatea de a ioniza atat ca baza cat si ca acid, incat solutiile lor apoase sunt sisteme complexe in echilibru:
![]()
![]() 2H+ +
ZnO22- H2ZnO2
= Zn(OH)2 Zn2+
+ 2OH- (6.29)
2H+ +
ZnO22- H2ZnO2
= Zn(OH)2 Zn2+
+ 2OH- (6.29)
![]()
![]() H2O +
H+ + AlO2- H3AlO3=Al(OH)3 Al3+ + 3OH- (6.30)
H2O +
H+ + AlO2- H3AlO3=Al(OH)3 Al3+ + 3OH- (6.30)
Din cele doua sisteme prezentate, rezulta ca, in
prezenta unui exces de ioni
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
Fiind electroliti slabi, electrolitii amfoteri au gradul de
disociere acida si bazica foarte mic. In unele cazuri
predomina caracterul bazic, iar in altele caracterul acid. Astfel, in
Pb(OH)2, prima
![]() Pb(OH)2 PbOH+ + OH- (disociere bazica)
Pb(OH)2 PbOH+ + OH- (disociere bazica)
![]() Pb(OH)2 H+ + HPbO2- (disociere acida)
Pb(OH)2 H+ + HPbO2- (disociere acida)
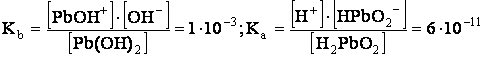
de aceea Pb(OH)2 este un hidroxid.
La As(OH)3, Kb < Ka; de aceea aceasta substanta se numeste acid arsenios.
Apa si Ga(OH)3 sunt electroliti amfoteri ideali, deoarece disociaza in aceeasi masura atat ca acid cat si ca baza, adica Ka=Kb.
Punct izoelectric. Solutia unui electrolit oarecare prezinta caracter acid (pH < 7) daca Ka > Kb si invers, daca Ka < Kb, solutia va fi bazica (pH > 7). Exista insa un pH la care sunt egale concentratiile celor doua forme rezultate prin disocierea acida si bazica. Acest pH se numeste punct izoelectric. Pentru acidul arsenios punctul izoelectric se afla la pH = 4,6.
Aminoacizii ca amfoliti. Aminoacizii sunt substante care provin din proteine prin hidroliza. In organismele vii, ei constituie materia prima pentru sinteza proteinelor. De aceea, prezinta mare importanta cunoasterea unor comportari ale lor, printre care aceea de amfolit, comportare care rezida din structura lor si care le imprima proprietati deosebite.
Aminoacizii sunt formati dintr-un rest organic R de care sunt legate grupari acide - carboxil ( -COOH) si bazice - aminice (-NH2) (formula I). Avand atat o grupare acida cat si una bazica, in interiorul moleculei are loc un transfer de protoni de la gruparea carboxil la cea aminica, incat structura reala a aminoacizilor este de ion dipolar sau amfion (II):
H2N-R-COOH H3N+-R-COO
I II
Datorita transferului intramolecular de protoni, aminoacizii sunt practic neutri in solutie apoasa. Ca orice amfolit, ei se comporta ca baze slabe fata de acizii tari cu formare de cationi:
H3N+-R-COO- + H+ H3N+-R-COOH (6.33)
si ca acizi slabi fata de bazele tari, cand formeaza anioni:
H3N+-R-COO-
+
Ionizarea formei cationice in solutie are loc dupa urmatoarele doua trepte:
H3N+-R-COOH + H2O H3N+-R-COO- + H3O+ (6.35)
H3N+-R-COO- + H2O H2N-R-COO- + H3O+ (6.36)
fapt pus in evidenta prin determinarea a doua constante de disociere. Proportia dintre concentratia cationilor si anionilor este dependenta evident de pH-ul solutiei si ea se poate regla prin adaos de acid sau baza. pH-ul la care concentratia in aminoacidul de forma cationica este egala cu cea de forma anionica poarta numele de punct izoelectric si el corespunde cu existenta a trei forme de aminoacid: forma de amfion aflat in concentratia cea mai mare si formele de cation si anion aflate in concentratii mai mici si egale. Glicocolul, cel mai simplu aminoacid, are punctul izoelectric la pH = 6,1. La trecerea curentului electric printr-o solutie de amfolit cationic, amfolitul se dirijeaza la catod prin fenomenul de cataforeza, iar un amfolit anionic se deplaseaza la anod, fenomen numit anaforeza. Fenomenele de anaforeza si cataforeza decurg simultan in procesul de electroforeza care serveste la analiza de laborator a aminoacizilor. La punctul izoelectric conductibilitatea electrica a aminoacizilor este minima.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1464
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved