| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
INTRODUCERE IN TERMODINAMICA CHIMICA
Termodinamica chimica studiaza conditiile de stabilitate maxima a sistemelor chimice si legile dupa care acestea se transforma pentru a atinge starea de echilibru chimic. De asemenea, studiaza metodele pentru a prevedea daca o anumita reactie poate avea loc si cum se deplaseaza echilibrul sub influenta diferitilor factori. In cercetarea sistemelor chimice in curs de transformare, sunt luate in considerare numai starile initiale si finale ale acestora, fara produsii intermediari sau alte aspecte ale starilor intermediare.
Termodinamica chimica este un capitol al termodinamicii, o stiinta abstracta, deductiva, care studiaza legile ce guverneaza transformarile cantitative ale energiei de la o forma la alta in timpul schimbarilor fizice sau chimice ale unui sistem. Aplicatiile principiilor termodinamice constituie de fapt obiectul de cercetare al termodinamicii chimice. Astfel, termochimia este un rezultat al aplicatiilor principiului I al termodinamicii, schimbarile de caldura ce insotesc reactiile chimice avand loc cu respectarea legii conservarii energiei (principiul I).
La baza termodinamicii stau doua postulate sub numele de principiile I si II ale termodinamicii, principii nedemonstrabile, dar care nu au fost contrazise niciodata pe cale experimentala.
Termodinamica foloseste termeni si notiuni caracteristice ca: sistem, faza, procese (izobare, izocore, izoterme) etc.
Prin sistem se intelege o regiune bine determinata in spatiu in care se gaseste o substanta sau un amestec de substante la o anumita presiune, temperatura sau volum. Daca intre sistem si mediul inconjurator au loc schimburi de energie si de substanta, sistemul se numeste deschis. Daca sistemul nu schimba substanta cu exteriorul, dar poate schimba energie, se numeste sistem inchis iar daca nu schimba nici substanta nici energie (caldura sau lucru mecanic) constituie un sistem izolat.
Faza constituie o portiune dintr-un sistem marginita de suprafete in care proprietatile macroscopice se schimba brusc, aparand o alta faza. Un sistem poate fi format din una sau mai multe faze (lichida, solida, gazoasa). Daca proprietatile macroscopice ale sistemului sunt aceleasi in orice punct al acestuia sistemul este omogen si constituie o singura faza iar in caz contrar, sistemul este eterogen, respectiv este alcatuit din mai multe faze (este polifazic). De ex. apa singura constituie o faza iar in contact cu gheata constituie sistem eterogen ca si o solutie in contact cu substanta nedizolvata.
Prin proces se intelege
orice modificare adusa unui sistem, ca de exemplu un schimb de
caldura sau de lucru mecanic cu mediul inconjurator,
modificandu-se astfel proprietatile fizice sau chimice ale
substantelor. Procesele pot fi izobare
daca se petrec la presiune
Proprietatile care depind de cantitatea de substanta existenta intr-un sistem se numesc proprietati extensive, ca de exemplu: greutatea, volumul, entalpia, entropia, energia interna. Proprietatile care nu depind de cantitatea de substanta ce formeaza sistemul, se numesc intensive (temperatura, presiunea, volumul molar, densitatea, caldura specifica etc.).
Prin starea termodinamica a unui sistem se intelege totalitatea factorilor ce caracterizeaza sistemul la un moment dat, adica totalitatea proprietatilor lor intensive, care se numesc si marimi termodinamice de stare. Marimile de stare pot fi variabile dependente si se numesc functii de stare sau variabile independente, cand se numesc parametrii de stare.
1. Principiul I al termodinamicii sau legea conservarii energiei
Energia nu poate fi nici creata nici distrusa, ea poate fi insa transformata dintr-o forma in alta. Marimile studiate la termochimie in cadrul acestui principiu, entalpia H si energia interna E, sunt proprietati extensive ale substantelor.
Atat entalpia de reactie (caldura de reactie) cat si energia interna se definesc termodinamic ca fiind, pentru o anumita temperatura data, egale cu diferenta dintre suma entalpiilor SH2 respectiv energiilor interne SE2 ale produsilor si reactantilor, SH1 respectiv SE1:
DH = SH2 - SH1 (3.7)
DE = SE2 - SE1 (3.8)
Caldura de reactie variaza cu temperatura dupa ecuatia lui Kirchhoff:
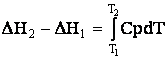 (3.9)
(3.9)
unde DH2 si DH1
sunt entalpiile de reactie la doua temperaturi T1 si
T2, iar DCp diferenta dintre sumele
capacitatilor calorice ale produsilor si reactantilor
[capacitatea calorica a unui sistem reprezinta cantitatea de
caldura necesara pentru a ridica temperatura sistemului cu un
grad, la presiune
DH2 - DH1 = DCp(T2 - T1) (3.10)
in care nu se ia in consideratie variatia lui DCp cu temperatura.
A raspunde la intrebarea de ce unele substante reactioneaza numai cu anumite substante si nu cu oricare, insemneaza a spune care este forta motoare a reactiilor chimice. Din masuratori s-a observat ca decurg spontan, de la sine, adica fara o interventie din afara, acele reactii in care se degaja multa caldura, iar cele in care se degaja putina caldura decurg de multe ori incomplet.
Rezulta ca numai reactiile exoterme decurg spontan, ca si cum forta motoare a reactiilor chimice ar depinde atat de variatia entalpiei (DH) a substantelor cat si de variatia energiei interne (DE) a acestora.
Exista insa multe reactii care contrazic acest principiu asa cum sunt unele reactii endoterme care decurg, fie la temperaturi ridicate, fie la temperaturi joase. S-a stabilit ca forta motoare a reactiilor chimice depinde in realitate de o proprietate extensiva a substantelor numita entalpie libera (G) si anume, de variatia entalpiei libere DG a reactiei, notiune care se va trata ca o aplicatie a principiului II.
2. Principiul II
In timp ce principiul I stabileste transformarea dintr-o forma intr-alta a diferitelor forme de energie dupa o lege de echivalenta, principiul II arata ca, in timp ce toate formele de energie (mecanica, electrica, chimica etc.) pot fi transformate integral in caldura, caldura nu poate fi transformata cantitativ in lucru mecanic, electric, chimic. Intotdeauna ramane o cantitate de caldura ce nu poate fi transformata in alte forme de energie. De aceea, energia calorica a fost considerata ca o forma inferioara de energie. Acest principiu a mai fost formulat si astfel: caldura nu poate trece spontan fara consum de energie produs de un mecanism extern, de la un corp rece la unul mai cald.
Generalizand constatarile facute experimental pe diverse sisteme, pe baza principiului II, se trage concluzia ca procesele prin care un sistem se transforma dintr-o stare initiala intr-o stare finala sunt de doua feluri: procese reversibile, prin care sistemul trece prin stari de echilibru succesive foarte apropiate si procese ireversibile, care decurg spontan si prin care sistemul tinde sa se apropie de o stare de echilibru (un proces este termodinamic reversibil cand decurge atat de incet incat sistemul este in orice moment in echilibru de temperatura, presiune sau concentratie, cu mediul inconjurator).
Pentru a demonstra cel de-al doilea principiu, s-au introdus alte doua marimi termodinamice: entropia si energia libera.
Entropia (S) este proprietatea extensiva a carei valoare rezulta din relatia:
![]() sau
sau ![]() (3.11)
(3.11)
Prin integrare aceasta relatie devine:
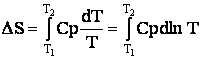 (3.12)
(3.12)
Cunoscand variatia capacitatii calorice Cp a
substantelor intre doua temperaturi T1 si T2,
se poate calcula variatia entropiei. Pentru calcule aproximative, se poate
inlocui Cp, considerata ![]() folosind relatia:
folosind relatia:
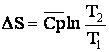 (3.13)
(3.13)
Entropia este o masura a ireversibilitatii termodinamice a transformarilor fizice sau chimice si nu intotdeauna este usor a interpreta semnificatia sa fizica.
In procesele fizice si chimice spontane, ireversibile, care decurg in sisteme ce nu permit un schimb de caldura cu mediul exterior, entropia creste, in timp ce , in procesele reversibile, la echilibru, entropia ramane neschimbata (DS = 0).
In natura toate sistemele tind catre starea maxima de stabilitate ceea ce corespunde starii de dezordine moleculara mare si respectiv starii de echilibru.
Gazele au entropie mai mare decat lichidele, fiind intr-o stare de dezordine mai mare, iar lichidele au entropie mai mare decat solidele. De asemenea, un amestec de doua gaze are o entropie mai mare decat fiecare gaz luat separat.
Variatia entropiei in starea initiala si finala permite sa se aprecieze daca un proces este posibil din punct de vedere termodinamic. Entropia poate fi considerata factor de capacitate calorica necesar pentru a mari starea de dezordine (omogenizare) a partilor componente ale sistemului.
Energia libera este de asemenea o functie termodinamica de stare, extensiva. Se cunosc doua forme de energie libera si anume: energia libera a lui Herman von Helmholtz DF si energia libera a lui J.W. Gibbs DG.
a) Energia libera a lui Helmholtz DF reprezinta capacitatea unui sistem de a produce lucrul maxim in cursul transformarii considerate. Ea constituie acea parte din energia interna E disponibila pentru a fi transformata in lucru mecanic in procesele reversibile ce au loc in conditii izoterm-izocore (T=const., DV=const.).
ΔF = - Wrev (3.14)
b) Energia libera a lui Gibbs DG reprezinta acea parte din entalpia unui sistem, disponibila pentru a fi transformata in lucru mecanic. De aceea este numita entalpie libera in mod frecvent. Ea difera de DF prin lucrul de volum pDV:
DG = DF + pDV (3.15)
Entalpia libera este o proprietate extensiva ca si celelalte functii termodinamice. Nici valoarea sa absoluta nu poate fi determinata ci numai variatia la trecerea sistemului dintr-o stare in alta. Entalpiile libere de formare ale elementelor in stare standard sunt, prin conventie, egale cu zero. Se poate calcula entalpia libera de reactie, cunoscandu-se entalpia libera a reactantilor si a produsilor:
DG = SGprodusi - SGreactanti (3.16)
Aceasta functie fiind mult intrebuintata, intereseaza mai mult.
Intre variatia entalpiei DH, entropiei DS si a entalpiei libere DG exista urmatoarea relatie:
DG = DH - TDS (3.17)
care constituie ecuatia fundamentala a termodinamicii chimice. Cu ajutorul acestei relatii se poate calcula energia libera (entalpia libera) a tuturor proceselor izoterme si deci a reactiilor chimice.
Entalpia libera este
forta motoare a reactiilor chimice deoarece determina
mersul acestora. Astfel, pentru reactiile care decurg de la sine la
temperatura si presiune
Ecuatia fundamentala arata ca mersul unei reactii spontane este determinat de doua tendinte opuse:
tendinta sistemelor chimice de a ajunge la o energie interna cat mai scazuta (ceea ce se traduce prin formarea a cat mai multe electrovalente si covalente) si
tendinta sistemelor din natura de a-si mari entropia prin a ajunge la o stare de dezordine moleculara cat mai avansata. La temperatura joasa este favorizata prima tendinta, iar la temperatura inalta, cea de a doua.
In cazul multor reactii intre molecule la temperatura joasa, nu se ajunge la starea de echilibru, ci rezulta sisteme nestabile (aparent stabile din punct de vedere termodinamic) asa cum se intampla in cazul celor mai multe reactii organice si biochimice.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2011
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved