| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
A fost enuntata in 1836 inaintea principiului I a carui consecinta directa este. Legea lui Hess este legea constantei cantitatii de caldura si legea fundamentala a termochimiei.
Se enunta astfel:
Efectul caloric al unei reactii chimice nu depinde de numarul etapelor intermediare si este egal cu suma efectelor calorice ale acestor etape
Trecerea sistemului de la starea 1 la starea 2 se poate face direct sau prin etape intermediare, asa cum se observa in fig. 4.2.
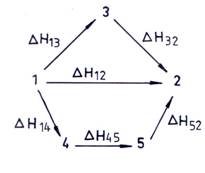
Fig. 4.2. Trecerea sistemului de la starea 1 la starea 2
H12 = H13 + H32 = H14 + H45 + H52 (4.93)
Un exemplu il reprezinta reactia de oxidare a C cu O2. Formarea CO2 poate avea loc din carbune si oxigen pe doua cai diferite: prin combinarea directa sau se formeaza mai intai CO care apoi se transforma in CO2.
C(s) + O2(g) à CO2(g) H1 = -94,04 kcal
C(s)
+ ![]() O2(g)
à CO(g) H2 =
-26,4 kcal
O2(g)
à CO(g) H2 =
-26,4 kcal
CO(g)
+ ![]() O2(g)
à CO2(g) H3 = -67,64 kcal
O2(g)
à CO2(g) H3 = -67,64 kcal
Conform legii lui Hess:
H1 = H2 + H3 (4.94)
O consecinta a legii lui Hess este ca ecuatiile termochimice pot fi adunate, scazute si amplificate cu anumite numere la fel ca ecuatiile algebrice.
O aplicatie practica a legii lui Hess este calculul entalpiilor unor reactii ale caror efecte termice nu se pot determina direct experimental. Astfel, masurandu-se direct efectul caloric de formare a CO2 din elemente sau din CO si O2, s-a putut calcula efectul caloric de formare a CO din elemente care nu se poate masura direct:
H2 = H1 - H3 (4.95)
Alte aplicatii ale legii lui Hess sunt calcularea entalpiei de reactie pe baza entalpiilor de formare ale reactantilor si produsilor de reactie, respectiv calcularea entalpiei de formare a unei hidrocarburi pe baza caldurilor de combustie.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 18473
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved