| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
In functie de structura moleculelor lor, substantele chimice supuse actiunii unui camp electric pot suferi doua procese distincte: conductibilitate sau polarizatie.
Daca moleculele sunt formate din particule cu sarcini electrice de semn opus, acestea sub influenta campului electric se pun in miscare dand nastere fenomenului de conductibilitate.
Daca substantele sunt neconducatoare sau dielectrici, iar sarcinile electrice (electroni sau ioni) nu sunt mobile, atunci moleculele sufera fenomenul de polarizare. Acest fenomen consta in interactiunea complexa dintre campul electric si moleculele dielectricului si este de doua tipuri: polarizatie de deplasare si polarizatie de orientare.
Polarizatia de deplasare este un fenomen pe care il prezinta toate substantele indiferent daca moleculele lor sunt polare sau nepolare si consta in separarea sarcinilor electrice din interiorul moleculei, sub influenta campului electric. In urma acestui proces de deplasare, moleculele devin dipoli electrici, formati din doua sarcini opuse separate la o anumita distanta.
Marimea dipolului electric se numeste moment de dipol electric (
Clausius si Mosotti au dedus relatia care defineste polarizatia de deplasare (Pd), respectiv polarizatia molara (P) pentru substantele nepolare:
![]() (3.1)
(3.1)
unde: ε = constanta dielectrica a mediului;
M = masa moleculara a substantei;
= densitatea substantei;
NA = numarul lui Avogadro;
Relatia (3.1) stabileste legatura dintre parametrul macroscopic al dielectricului ( ) si parametrul microscopic molecular ( ) al substantelor nepolare.
O molecula polara este o molecula cu un moment de dipol electric permanent (
Substantele care au in molecula un dipol permanent vor suferi in camp electric, pe langa polarizatia de deplasare (Pd) si o polarizatie de orientare (Po) a carei relatie a fost dedusa de catre Debye.
Polarizatia de orientare se defineste conform relatiei:
![]() (3.2)
(3.2)
unde: = moment de dipol electric;
k = constanta lui Boltzmann.
Polarizatia molara totala (P) se compune din polarizatia de deplasare (Pd) si polarizatia de orientare (Po):
![]() (3.3)
(3.3)
Relatia (3.3) poate fi scrisa sub forma:
![]() (3.4)
(3.4)
unde: ![]() (3.5)
(3.5)
![]() (3.6)
(3.6)
Relatia lui Debye (3.3) se reduce in cazul substantelor nepolare ( ) la relatia lui Clausius si Mosotti (3.1).
Reprezentand grafic P in functie de 1/T (fig. 3.1.), se obtin drepte paralele cu axa abscisei pentru moleculele nepolare si drepte cu panta pozitiva pentru cele polare.
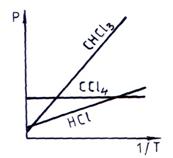
Fig. 3.1. Variatia polarizatiei molare cu temperatura
pentru molecule polare si nepolare
Din valoarea pantei (B) se poate calcula momentul dipolar permanent (
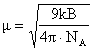 (3.7)
(3.7)
iar din valoarea ordonatei la origine, A = Pd rezulta parametrul
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1969
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved