| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Incadrarea anionilor in grupe analitice se efectueaza pe baza comportarii diferite a anionilor fata de sarurile solubile de argint si bariu, conform principiului de separare a lui Bunsen.
Tehnica:
-0,02g substanta se dizolva in 3 ml apa si se adauga 5 picaturi HNO3 diluat (R). Solutia se imparte in 2 portiuni : in prima se adauga 3-4 picaturi AgNO3 (R) iar in cea de-a doua 3-4 picaturi BaCl2 sau Ba(NO3)2 (R). Diferentierea anionilor se face conform tabelului.
Tabelul 3.1.Incadrarea anionilor in grupele analitice
|
Nr. grupei |
Comportarea anionilor fata de sarurile solubile de Ag si Ba |
Anionii care reactioneaza |
|
I |
Saruri de Ag insolubile in apa si acid azotic diluat Saruri de Ba solubile in apa |
Cl-, Br-, I-, CN- pp. alb- pp. alb- pp. pp. cazeos galbui galben alb - - - - |
|
II |
Saruri de Ag insolubile in apa, solubile in acid azotic diluat Saruri de Ba solubile in apa |
NO2-, PO22-, CH3COO- pp. alb pp. alb- pp. alb negru - - - |
|
III |
Saruri de Ag si Ba insolubile in apa, solubile in acizi |
CO32-, HCO3-, BO2- (OOC-(CHOH)2-COO)2- [C3H4(OH)(COO)3]3- pp. albe |
|
IV |
Saruri de Ag colorate, insolubile in apa,solubile in acizi Saruri de Ba insolubile in apa, solubile in acizi diluati |
PO43-, S2O32-, AsO43- pp. galben pp. alb- pp. brun galben-negru |
|
V |
Saruri de Ag si Ba solubile in apa |
NO3-, MnO4- |
|
VI |
Saruri de Ag solubile in apa Saruri de Ba insolubile in apa si acizi diluati |
SO42- F- |
Observatie:
Dupa adaugarea HNO3 se va controla pH-ul solutiei care trebuie sa fie puternic acid.
I.Reactii specifice anionilor grupei I: Cl-, Br-, I-, CN-
a.) Reactii specifice ionilor Cl- si CN-
1)Reactia cu amoniac
Clorurile si cianurile formeaza cu azotatul de argint clorura de argint, respectiv cianura de argint. Acestea se comporta diferit fata de amoniac. Clorura de argint si cianura de argint sunt solubile in amoniac cu formare de complecsi, bromura de argint este partial solubila, iar iodura de argint este insolubila.
AgCl + 2NH4OH Ag(NH3)2Cl + 2H2O
AgCN + 2NH4OH Ag(NH3)2CN + 2H2O
Din solutia amoniacala acidulata cu HNO3 precipita AgCl:
[Ag(NH3)2]+Cl- + HNO3 AgCl + 2NH4+ + NO3-
Precipitatul obtinut la capitolul Reactii generale, se trateaza cu hidroxid de amoniu (R) si se observa dizolvarea precipitatului.
2)Reactia specifica ionului CN- de transformare in hexacianoferat II de potasiu
Ionul CN- in prezenta sulfatului de fier (II) se trasforma in cianura de fier (II) solubila in exces de cianura , cu formarea anionului haxacianoferat II.
Acesta, in prezenta ionilor de Fe (III) in mediu acid, va forma hexacianoferatul (II) de Fe (III), de culoare albastra.
2CN- + FeSO4 Fe(CN)2 + SO42-
Fe(CN)2 + 4CN- [Fe(CN)6]4-
3[Fe(CN)6]4- + 4Fe3+ Fe4[Fe(CN)6]3
Tehnica:
-0,05g substanta se dizolva in 2 ml apa si se trateaza cu 0,01g sulfat de fier (R). Se incalzeste la fierbere, se aciduleaza cu acid clorhidric diluat (R) si se adauga 1 picatura clorura de fier (III) (R), cand apare un precipitat albastru.
b.) Reactia specifica ionilor Br- si I-
Reactia cu cloramina in mediu acid
Reactia se bazeaza pe deplasarea bromului din bromuri si a iodului din ioduri sub actiunea cloraminei in mediu acid, urmata de punerea in evidenta a coloratiei extrase in cloroform.
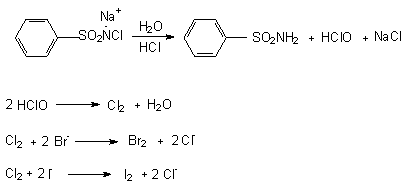
Tehnica:
-0,02g substanta se dizolva in 2 ml apa, se aciduleaza cu acid clorhidric (R), se adauga
1 ml cloroform si 0,5 ml cloramina (R) si se agita. Stratul cloroformic se coloreaza in brun in cazul bromului si in violet in cazul iodului.
Reactia cu apa oxigenata si acid sulfuric concentrat
Cu o solutie de apa oxigenata, in prezenta acidului dulfuric concentrat, se elibereaza bromul din bromuri, respectiv iodul din ioduri, solubile in cloroform (benzen) cu o coloratie portocalie, respectiv violeta.
Tehnica:
- 0,2 g substanta se dizolva in 1 ml apa, se trateaza cu 1 ml apa oxigenata 3 % si 1 ml acid sulfuric concentrat (R). Apare o coloratie galben - portocalie in cazul bromului si violeta in cazul iodului, care se extrage in cloroform.
II.) Reactii specifice anionilor grupei II: NO2-, PO22-, CH3COO-
a.) Reactii specifice ionului NO2-
Reactia de diazotare
Ionul NO2- in mediu acid, formeaza cu aminele primare aromatice, la rece (0-5 C), saruri de diazoniu. Acestea se pot cupla cu fenoli in mediu bazic sau cu amine aromatice in mediu acid, conducand la coloratii caracteristice.
Reactia de diazotare a aminelor aromatice primare se efectueaza la temperaturi joase, cuprinse intre 0-5 C, sarurile de diazoniu fiind stabile numai la aceste temperaturi.
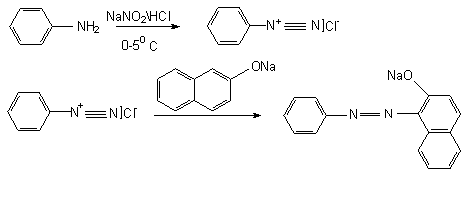
Tehnica:
- 0,1 g amina primara aromatica (anilina) se dizolva in 2 ml acid clorhidric 10 % (R). 0,1 g substanta de analizat se dizolva in 1 ml acid clorhidric 10 % (R). Ambele eprubete se racesc sub un jet de apa, dupa care se amesteca. Se obtine sarea de diazoniu incolora. Se adauga cateva picaturi din solutia sarii de diazoniu peste o solutie preparata din 0,1 g β-naftol in 2 ml hidroxid de sodiu 10 % (R) racita. Se obtine o coloratie sau un precipitat rosu- portocaliu.
b.) Reactii specifice ionului hipofosforos
1)Reactia cu ionul de As (III)
Hipofosfatii reduc ionii As (III), in mediu puternic acid la arsen metalic.
![]()
Tehnica:
-0,1g substanta se dizolva in 1 ml apa, se trateaza cu 0,1g clorura de arsen (III) si se incalzeste pe baia de apa. Se formeaza un precipitat brun-cenusiu de arsen metalic.
2)Reactia cu iod
Solutia de iod este decolorata de hipofosfati alcalini si acidul hipofosforos.
H2PO2- + I2 + H2O H2PO3- + 2HI
Tehnica:
-peste o solutie apoasa de iod se adauga, picatura cu picatura dintr-o solutie de hipofosfit.
Solutia de iod se decoloreaza imediat.
III.) Reactii specifice anionilor grupei III: CO32-, HCO3-, BO2-,
(OOC-(CHOH)2-COO)2-, [C3H4(OH)(COO)3]3-
a.) Reactia specifica ionilor CO32- si HCO3- de descompunere cu acizi minerali
Acizii minerali diluati si concentrati deplaseaza acidul carbonic din carbonati si bicarbonati, care se descompun imediat in bioxid de carbon si apa.
CO32- + 2H+ CO2 + H2O
HCO3- + H+ CO2 + H2O
H2CO3 CO2 + H2O
Tehnica:
-0,1g substanta se trateaza cu cateva picaturi de acid clorhidric diluat (R), pe o sticla de ceas. Se formeaza o efervescenta.
b.) Reactia de diferentiere intre anionii CO32- si HCO3- prin comportarea fata de fenolftaleina
Carbonatii neutrii solubili se diferentiaza de cei acizi prin pH-ul solutiei.
Carbonatii neutri in solutie apoasa hidrolizeaza conform reactiei:
CO32- + H2O HCO3- + HO-
pH-ul solutiei este puternic bazic, cu fenolftaleina se obtine o coloratie rosie.
Carbonatii acizi in solutie apoasa hidrolizeaza dupa reactia:
HCO3- + H2O H2CO3 + HO-
pH-ul solutiei este slab bazic (pH=8,4), cu fenolftaleina se obtine o coloratie slab roz, iar prin incalzire coloratia devine rosie, ca urmare a transformarii bicarbonatilor in carbonati.
2NaHCO3 Na2CO3 + CO2 + H2O
Tehnica:
-0,10g substanta se dizolva in 2 ml apa, se trateaza cu o picatura fenolftaleina(I). In cazul prezentei carbonatilor neutri solutia se coloreaza in rosu intens, iar in prezenta carbonatilor acizi in slab roz.
c.) Reactia specifica ionului borat de esterificare cu etanol si acid sulfuric
Boratii ard cu o flacara verde, dupa tratarea lor cu acid sulfuric concentrat in prezenta alcoolului etilic (metilic).
H3BO3 + 3C2H5OH BO3(C2H5)3 + 3H2O
Tehnica:
-0,1g substanta se trateaza intr-o capsula de portelan cu 2 ml etanol (R), 1 ml acid sulfuric (R). Se agita si apoi se aprinde. Se formeaza esterul boric volatil, care arde cu flacara verde.
IV.) Reactii specifice anionilor grupei IV: PO43-, S2O32-, AsO43-
a.) Reactia specifica ionilor PO43- si AsO43- cu molibdatul de amoniu
Ionii fosfat formeaza cu molibdatul de amoniu in mediu puternic acid, un precipitat galben microcristalin de fosfomolibdat de amoniu, solubil in hidroxizi alcalini.
H3PO4 + 12(NH4)2MoO4 + 21HNO3 (NH4)3H4[P(Mo2O7)6] + 21NH4NO3 + 10H2O
H3AsO4 + 12(NH4)2MoO4 + 21HNO3 (NH4)3H4[As(Mo2O7)6] + 21NH4NO3 + 10H2O
Tehnica:
-0,10g substanta se dizolva in 2 ml apa, se trateaza cu 2 ml acid azotic (R) si 3 ml molibdat de amoniu (R). Se formeaza un precipitat galben.
Observatii:- reactia are loc in timp la temperatura camerei, iar la cald instantaneu
- arseniatii precipita numai la fierbere
b.) Reactia specifica ionului arseniat cu azotatul de argint
Ionul arseniat precipita la tratare cu o solutie de azotat de argint 5 %, arseniatul de argint, galben-brun, solubil in acid azotic si amoniac.
AsO43- + 3Ag+ Ag3AsO4
Tehnica:
- 0,1 g substanta se dizolva in 2 ml apa si se trateaza cu 2 ml solutie azotat de argint 5%. Se formeaza arseniatul de argint, precipitat galben-brun.
c.) Reactii specifice ionului S2O32-
1)Reactia cu I2
Iodul oxideaza tiosulfatul la tatrationat, el reducandu-se la iodura.
I2 + 2S2O32- S4O62- + 2I-
Tehnica:
La o solutie de iod 1% se adauga picatura cu picatura, o solutie de tiosulfat de sodiu. Solutia de iod este imediat decolorata.
2)Reactia de descompunere cu acizii
Acizii minerali deplaseaza acidul tiosulfuric din tiosulfati. Acidul tiosulfuric fiind instabil, se descompune, cu degajare de dioxid de sulf,cu miros caracteristic, iar solutia se tulbura din cauza sulfului format.
S2O32- + 2H+ H2S2O3
H2S2O3 S + SO2 + H2O
Tehnica:
-0,10g substanta se dizolva in 1 ml apa, se trateaza cu 5 picaturi acid clorhidric 10% (R). Solutia se tulbura, se separa sulful si se degaja dioxidul de sulf cu miros caracteristic.
V.) Reactii specifice ionilor gr.V: NO3-, MnO4-
a.) Reactia specifica ionului NO3- cu sulfat de fier
Ionul nitrat in mediu de acid sulfuric (R) oxideaza sulfatul feros la sulfat de fier (III), el reducandu-se la oxid de azot, care reactioneaza cu sulfatul feros in exces, formand un complex de culoare bruna, sulfat nitrozoferos.
6FeSO4 + 2HNO3 + 3H2SO4 3Fe2(SO4)3 + 2NO + 4H2O
xFeSO4 + yNO (FeSO4)x(NO)y
Tehnica:
-0,10g substanta se dizolva in 1 ml apa, se trateaza cu 0,2 g sulfat feros (R), peste care se toarna cu precautie, pe peretii eprubetei, 1 ml acid sulfuric (R). La zona de contact a celor doua lichide se formeaza un inel brun.
Observatie: Reactia este data si de nitriti, dar spre deosebire de nitrati, reactia are loc si in prezenta acidului sulfuric diluat.
b.) Reactia specifica ionului MnO4- de oxidare cu H2O2
Ionul permanganat in mediu acid oxideaza peroxidul de hidrogen, decolorandu-se.
2MnO4- + 6H+ + 5H2O2 2Mn2+ + 8H2O + 5O2
Tehnica:
-0,01g substanta se dizolva in 3 ml apa, se adauga cateva picaturi acid sulfuric (R), iar solutia se trateaza apoi cu o solutie de peroxid de hidrogen. Se observa decolorarea solutiei violet de permanganat de potasiu.
VI.) Reactii specifice ionilor grupei VI: SO42- F-
a) Reactia specifica ionului SO42- cu BaCl2
Ionul sulfat reactioneaza cu clorura de bariu un precipitat de sulfat de bariu, practic insolubil in apa si acizi. Se dizolva numai in acid sulfuric (R) la fierbere, cu formarea sulfatului acid de bariu.
![]()
BaSO4 + H2SO4 Ba(HSO4)2
Tehnica:
0,2g substanta se dizolva in 2 ml apa si se trateaza cu cateva picaturi de clorura de bariu (R). Se formeaza un precipitat alb, insolubil in acid clorhidric si acid azotic.
Observatie: Ionul fluorura reactioneaza similar cu clorura de bariu, precipitatul de fluorura de bariu, spre deosebire de sulfatul de bariu este solubil in acid azotic (R) si acid clorhidric (R).
b.) Reactia specifica ionului F- cu acid sulfuric
Acidul sulfuric concentrat, deplaseaza la cald, acidul fluorhidric din fluoruri, iar acidul fluorhidric rezultat ataca sticla formand cu bioxidul de siliciu (din sticla de ceas), tetrafluorura de siliciu.
2F- + H2SO4 2HF + SO42-
SiO2 + 4HF SiF4 + 2H2O
Tehnica:
-0,1g substanta se trateaza pe o sticla de ceas cu 3 picaturi acid sulfuric (R). Amestecul se incalzeste 1 minut la o flacara mica. Sticla de ceas dupa racire, spalare si uscare, prezinta urme de coroziune.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2608
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved