| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Echilibrul de faze in sisteme ternare
. Sisteme ternare cu lichide partial miscibile
Pentru un sistem ternar format din trei lichide complet miscibile varianta sistemului este: v = 3 + 2 - 1 = 4. Starea sistemului este complet definita daca se cunosc temperatura, presiunea, si doua concentratii a doi componenti. Mentinand temperatura si presiunea constante, mai raman doua grade de libertate - fractiile molare ale celor doi componenti - si sistemul devine bivariant.
Daca doua dintre lichide sunt nemiscibile sau partial miscibile, iar al treilea se distribuie in cele doua faze, atunci varianta sistemului scade la trei. In aceste conditii, compozitia sistemului ternar se poate determina cu ajutorul triunghiului Gibbs-Roozeboom.(Fig. 10.3).
Fractiile molare ale celor trei componenti dintr-un sistem ternar satisfac relatia: xA + xB + xC = 1, relatie satisfacuta de proprietatile unui triunghi echilateral:
suma distantelor de la un punct P, din interiorul triunghiului, trasate paralel cu laturile, este egala cu lungimea laturii triunghiului care poate fi luata ca unitate de lungime;
![]()
Compozitia sistemului in punctul figurativ P, este:
xA = ![]() ; xB
=
; xB
= ![]() ; xC
=
; xC
= ![]()
dreapta care uneste un varf al triunghiului cu un punct de pe latura opusa, de exemplu AD, reprezinta locul geometric al tuturor punctelor pentru care raportul concentratiilor componentilor B si C este constant:
![]() , sau :
, sau : ![]()

Figura 10.3
Consideram ca lichidele B si C sunt partial miscibile, iar lichidul A complet miscibil atat in B cat si in C.
In figura 10.3 punctul D reprezinta compozitia solutiei saturate de component C in solventul B, iar punctul E reprtezinta compozitia solutiei saturate de component B in solventul C.Adaugand component C peste solutia de compozitie corespunzatoare punctului D, apar doua faze a si b de compozitie constanta. Faza a este formata de component C in solventul B, iar faza b este formata din component B in solventul C. Se adauga cel de-al treilea component A, miscibil cu cele doua lichide si se determina compozitia celor doua faze aflate in echilibru, corespunzatoare punctelor F si G de pe curba. Se observa ca faza a are concentratia mai mare in component C, iar faza b este mai bogata in component B, in raport cu compozitiile initiale reprezentate prin punctele D si E. Rezulta ca lichidul A, miscibil cu cele doua lichide B si C (nemiscibile) duce la cresterea miscibilitatii reciproce a lichidelor B si C. Adaugand treptat component A in cele doua solutii conjugate a si b si determinand de fiecare data compozitia acestora, se obtin punctele: FG; HI; JK. Se observa ca domeniul de miscibilitate se micsoreaza din ce in ce mai mult, cu adaugarea componentului A, pana cand sistemul devine monofazic.
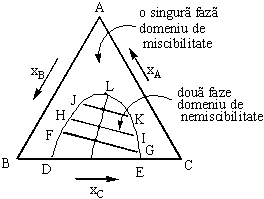
Figura 10.
Punctul care corespunde la cantitatea maxima de component A adaugat, ce duce la aparitia unei solutii omogene formata din trei componente lichide A, B, C se numeste punctcritic de solubilitate. (punctul L din Fig.10.4).Curba DFHJKLIG obtinuta prin unirea punctelor ce exprima compozitia fazelor conjugate in echilibru se numeste curba solubilitatii reciproce. Dreptele FG; HI; etc care unesc doua puncte ce exprima compozitia fazelor conjugate se numesc conode.
Legea de distributie a lui Nernst
Consideram un sistem lichid format din componentii B si C partial miscibili, iar lichidul A este complet miscibil cu B si C. Cele doua solutii conjugate: (A + C) in solventul B (faza a) si (A + B) in solventul C (faza b) au o comportare ideala. La echilibru, potentialele chimice ale substantei A in cele doua faze sunt egale:
![]() =
= ![]()
![]()
sau:
![]() (10.47)
(10.47)
de unde:
![]() (10.48)
(10.48)
Intr-un sistem ideal cu doua faze, raportul fractiilor molare ale aceluiasi component distribuit in cele doua faze conjugate, in echilibru, este independent de compozitia sistemului, depinzand numai de T si p.
Pentru solutii reale, potentialele chimice se scriu in functie de activitatea componentului A, adica:
![]() =
= ![]() (10.49)
(10.49)
sau:
![]() (10.50)
(10.50)
![]()
![]() = Ka
(T,p) (10.51)
= Ka
(T,p) (10.51)
La echilibru, raportul activitatilor substantei A distribuita in cele doua faze conjugate, a si b este constant.
Ecuatiile (10.48) si (10.51) exprima legea de distributie a lui Nernst, iar constantele Kx si Ka se numesc constante de distributie.
Daca una din solutii are o
comportare ideala, de exemplu faza b, atunci ![]() si
relatia (10.51) devine:
si
relatia (10.51) devine:
![]() (10.52)
(10.52)
Cu relatia (10.52) se poate calcula coeficientul de activitate ![]() ,
respectiv activitatea
,
respectiv activitatea ![]()
Legea de distributie Nernst ofera posibilitatea rezolvarii problemei legate de extractia unei substante dintr-un amestec.
Consideram ca in volumul V0 de amestec (in mL) se gasesc go grame substanta ce trebuie extrasa. In fiecare din cele n extractii se foloseste aceeasi cantitate de solvent (V mL). Dupa fiecare extractie cantitatile de substanta ramase neextrase sunt: g1, g 2, ..g n .
Dupa prima extractie, in solutie raman g1 grame de substanta neextrasa si se extrag (g0 - g1) grame continute in volumul V de solvent. Conform legii de distributie Nernst, se poate scrie:
Kc
= ![]() (10.53)
(10.53)
(la dilutii mari fractiile molare se pot inlocui cu concentratiile).
Kc = 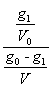 ; de
unde : g1 =
; de
unde : g1 = ![]()
Dupa a doua extractie:
Kc =  ; de unde : g 2 =
; de unde : g 2 = ![]()
Sau dupa inlocuirea lui g1, se obtine:
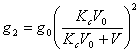
Pentru cazul general, dupa n extractii repetate cu aceeasi cantitate de solvent V, cantitatea de substanta ramasa neextrasa, va fi :
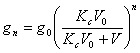 (10.54)
(10.54)
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1403
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved