| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
FARMACOCINETICA GENERALA - Transformarea biochimica a medicamentelor
Farmacocinetica este acea parte a farmacologiei care studiaza procesele de baza ale cineticii medicamentelor si etapele prin intermediul carora se realizeaza circulatia acestora in organism, respectiv absorbtia, distributia, biotransformarea si eliminarea medicamentelor din organism.
1. Procese de baza ale cineticii medicamentelor
Procesele de baza ale cineticii medicamentelor, care intervin în diverse etape ale circulatiei acestora în organism sunt:
trecerea prin membrane (taversarea membranelor);
legarea de proteine;
transformarea medicamentelor prin metabolizare;
1.1. T r a v e r s a r e a m e m b r a n e l o r
Din punct de vedere farmacocinetic organismele superioare sunt vazute ca un sistem multicompartimental în care traseul prin care medicamentul circula, actioneaza si se transforma este separat prin intermediul membranelor biologice. Traversarea membranelor este fenomenul esential al intregului ciclu farmacocinetic.
Structura fundamentala membranara a celulelor consta dintr-un strat bimolecular de fosfolipide orientate perpendicular pe planul membranei, cu capatul polar orientat catre cele doua suprafete si cu lanturile hidrocarbonate spre interior. Componenta predominanta lipidica este hotarâtoare pentru proprietatile fizico-chimice ale membranelor vii si explica permeabilitatea lor pentru moleculele lipofile. In stratul bimolecular fosfolipidic sunt inglobate macromoleculele proteice globulare si glicoproteine. Acestea formeaza sau marginesc canale apoase, pori, care reprezinta adevarate porti de legatura directa între mediul extern si cel intern al celulei. Peretii interni ai porilor au sarcini electrice (+) date de grupele aminice si (-) date de grupele carboxilice si hidroxilice ale aminoacizilor din structura proteinelor, ceea ce explica selectivitatea membranelor celulare la trecerea anumitor substante.
Desi asemanatoare ca organizare generala, membranele biologice se deosebesc prin grosime, densitate, compozitie, ceea ce explica unele particularitati de absorbtie, difuzie tisulara si eliminare.
Propietatile fizico-chimice ale medicamentelor, esentiale pentru procesul de trecere prin membrane sunt:
- dimensiunea moleculei,
- solubilitatea
- coeficientul de partitie
- gradul de ionizare.
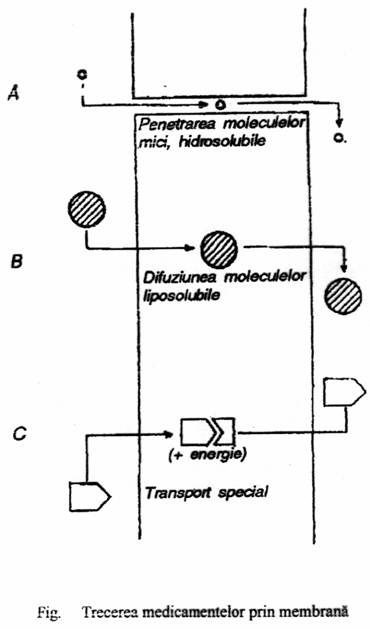
În functie de proprietatile sus-mentionate, medicamentele pot traversa membranele biologice prin urmatoarele mecanisme:
- filtrare sau penetrare
- difuziune simpla (pasiva)
- transport specializat (activ)
Filtrarea sau penetrarea implica trecerea medicamentului prin pori sau prin alte discontinuitati ale membranei lipidice umplute cu apa. Prin urmare, prima conditie pentru traversarea membranei prin acest mecanism este ca substanta sa fie hidrosolubula. Pentru ca diametrul porilor membranelor celulare este mic (cca 0,8 nm), prin acesti pori nu pot trece decât moleculele hidrosolubile mici (sub 100A), ceea ce pentru medicamente constituie o situatie de exceptie. Situatia este diferita în cazul majoritatii capilarelor, care având diametrul mai mare (6-8 nm), pot fi traversate de molecule mari, factorul limitativ în acest caz fiind reprezentat de legarea substantei medicamentoase de proteine, macromolecule care în mod obisnuit nu trec prin porii capilari.
Difuziunea simpla (pasiva), proportionala cu gradientul de concentratie, este mecanismul ce permite traversarea fazei lipidice a membranelor de catre medicamente. Difuziunea simpla este un proces fizic, pasiv. Prima conditie pentru traversarea membranei celulare prin acest mecanism este ca substanta sa fie liposolubila, respectiv sa aiba un coeficient de partitie grasimi-apa mare. Coeficientul de partitie intre grasimi si apa rezulta din solubilitatea relativa a medicamentelor intre doua faze nemiscibile: o grasime nepolara (ulei de masline) sau un solvent organic (heptan, octanol), reprezentand membrana si o solutie apoasa tampon (obisnuit la pH=7,4), reprezentand plasma. Corficientul de partitie poate fi considerat ca masura a afinitatii relative a substantei medicamentoase fata de faza lipidica si faza apoasa. Pentru stabilirea coeficientului de partitie grasimi-apa a fost folosit initial uleiul de masline, iar în prezent se folosesc solventi organici lipofili ca octanolul (pentru modelarea trecerii prin mucoasa intestinala) sau heptanul, pentru traversarea barierei hematoencefalice.
În afara de liposolubilitate, difuziunea simpla este influentata si de polaritatea moleculelor, de gradul lor de ionizare.
Majoritatea medicamentelor sunt electroliti slabi. În solutie apoasa substantele medicamentoase exista sub forma unui amestec de ioni si molecule neionizate. Ionii au o solubilitate mica în grasimi, deoarece în jurul sarcinii lor electrice se aglomereaza dipoli de apa. Prin urmare, liposolubilitatea medicamentelor, respectiv capacitatea lor de a difuza prin membrane, este determinata de constanta de ionizare – pKa- proprie moleculei. Cunoscând valoarea acestei constante se poate calcula proportia formei ionizate pentru diferite valori ale pH-ului, folosind ecuatia Henderson-Hasselbach.
log (concentratia molara a formei protonate / concentratia molara a formei neprotonate) = pKa – pH
În cazul medicamentelor acide:
log([AH]/[A-]) = pKa – pH
sau rearanjând,
[A-]/[[AH] = 10 pH-pKa
iar pentru baze:
log([BH+]/[B]) = pKa – pH
sau rearanjând,
[B]/[[ BH+] = 10 pH-pKa
unde: [AH] = concentratia formei neionizate (protonate) pentru substantele acide
[A-] = concentratia formei ionizate (neprotonate) pentru substantele acide
[BH+] = concentratia formei ionizate (protonate) pentru substantele bazice
[B] = concentratia formei neionizate (neprotonate) pentru substantele bazice
Când pH=pKa, concentratiile celor doua forme sunt egale. Valoarea diferentei pH - pKa are semnificatii diferite în functie de caracterul acid sau bazic al medicamentului. Astfel, pentru medicamentele cu caracter acid valoarea pozitiva a acestei diferente indica o proportie mai mare a formei ionizate, iar pentru medicamentele bazice, o proportie mai mare a formei neionizate si invers pentru valorile negative ale diferentei pH - pKa.
La pH-ul obisnuit al mediului intern (putin mai mare de 7), pentru medicamentele slab acide cu pH>7 si pentru medicamentele slab bazice cu pH<7, predomina forma neionizata, care poate traversa cu usurinta membranele lipidice. Alcalinizarea pH-ului mediului intern mareste proportia formei ionizate a medicamentelor acide si acidularea mediului intern mareste proportia formei ionizate a medicamentelor bazice.
Electrolitii tari, care disociaza complet în solutie, nu sunt practic liposolubili si nu pot difuza prin membrana lipidica. Asa se explica faptul ca medicamentele care sunt acizi tari, ca de exemplu acizii sulfonici, sau baze tari, ca de exemplu bazele cuaternare de amoniu, nu se absorb sau se absorb limitat, nu patrund sau patrund putin în mediul intracelular, (actionând la suprafata membranelor), nu pot trece sau trec cu greutate în sistemul nervos central.
Transportul specializat (activ) este un mecanism în care moleculele incapabile de a traversa membrana prin difuziune simpla sunt transportate prin interventia unor sisteme transportoare specifice, active. Practic, molecula de medicament devine difuzibila prin complexarea cu astfel de transportori, care preiau molecula de o parte a membranei si o cedeaza de cealalta parte, transportorul circulând în forma legata într-o directie, si liber, în cealalta, în cadrul unui proces ciclic. În mod obisnuit acest sistem activ functioneaza împotriva gradientului de concentratie, deci cu consum de energie. Existsi situatii când transportul se poate face în gradient de concentratie sau de potential electric, în care caz nu necesita energie si poarta numele de difuzie facilitata. Mecanismul transportor se caracterizeaza printr-o înalta specificitate sterica, fixând numai anumite molecule si putând fi inhibat competitiv de catre compusi analogi cu moleculele transportate în mod obisnuit.

Pinocitoza este o alta modalitate de transport activ, rareori întâlnita în cazul medicamentelor, care consta în înglobarea de catre celula a picaturii ce contine substanta dizolvata. Picatura este înconjurata de o portiune de membrana, formând o vezicula, care apoi se detaseaza de membrana, patrunzând în citoplasma. Sunt transportate astfel lipidele, glicerina, amidonul, vitaminele liposolubile (A, D, E,K), insulina, etc.
O serie de medicamente pot traversa membranele prin mai multe mecanisme: vitamina B12 (transport facilitat, difuziune pasiva), glicozidele tonicardiace (partial transport activ, partial difuziune pasiva), medicamentele cu molecule mici (difuziune si filtrare)
Medicamentele se pot lega de diferite macromolecule din componenta materiei vii. Din punct de vedere farmacocinetic, este foarte importanta legarea de proteinele plasmatice si anume legarea de albumina, care reprezinta jumatate din proteinele plasmatice. Alte proteine, mai putin importante cantitativ, beta-globulina si alfa1-glicoproteina pot forma si ele complexe, dar cu mult mai putine substante, cu caracter bazic în special. Anumite globuline leaga specific hormoni (tiroxina, hormoni steroizi), vitamine (cianocabalamina, vitamine liposolubile), metale (Zn2+, Zn2+, Fe2+) Albumina are o greutate moleculara de 66400 si poate lega o serie de medicamente cu caracter acid precum si unele (mai putine) cu caracter bazic. Legarea moleculelor medicamentoase se face in principiu la nivelul grupelor polare de pe suprafata proteinei (-NH3+ a lizinei, -NH+ a histinei, -S- a cisteinei) prin forte electrostatice. La fixarea medicamentelor mai pot interveni si punti de hidrogen, legaturi hidrofobe, forte van der Waals. Legarea covalenta este o situatie de exceptie. Fixarea moleculelor este influentata de conformatia macromoleculei proteice, care determina disponibilizarea grupelor reactive si recunoasterea moleculei de medicament datorita unor complementaritati infrastrcturale.
In mod obisnuit, fixarea are un caracter reversibil si dinamic, conformandu-se legii actiunii maselor:
M + P ![]() MP
MP
Unde:
M = molecula de medicament,
P= molecula de proteina,
MP = complexul medicament – proteina,
k1 si k2 – constantele vitezelor de asociere si disociere ale complexului medicament-proteina
Fixarea reversibila se caracterizeaza prin 2 parametrii:
afinitatea, exprimata
prin
Ka = k1/k2
procentul de fixare, care rezulta din raportul dintre fractia legata si cantitatea totala de medicament din plasma.
Masura în care medicamentele se leaga de proteinele plasmatice depinde de urmatorii factori: concentratia medicamentului, concentratia proteinei, afinitatea pentru locurile de legare. Fixarea moleculelor de medicament este posibila atâta timp cât exista sedii de legare disponibile (neocupate). Cum concentratia normala de albumina este de 0,6 mM si fiecare molecula cuprinde doua sedii de legare, capacitatea maxima de legare este de 1,2 mM. Deoarece majoritatea medicamentelor administrate în dozele uzuale, realizeaza concentratii plasmatice mult mai mici de 1,2 mM, numarul de sedii de legare nu reprezinta un factor limitativ pentru fixarea moleculelor de medicament, care practic este proportionala cu concentratia moleculelor libere de medicament. Procentul de fixare poate fi influentat de scaderea concentratiei proteinelor plasmatice ca si de interventia competitiva a unor metaboliti sau a altor medicamente.
Forma legata a medicamentelor este inactiva biologic, deoarece complexul macromolecular proteina-medicament nu poate trece in tesuturi. În functie de taria si stabilitatea legaturii, fixarea de proteinele plasmatice poate fi o simpla modalitate de transport, poate determina retinerea in sange sau poate controla distributia catre tesuturi.
Combinarea cu o proteina circulanta reprezinta un factor de modulare a concentratiei formei libere, respectiv a difuzarii tisulare si a activitatii farmacologice.
1.3. T r a n s f o r m a r e a b i o c h i m i c a a m e d i c a m e n t e l o r. Multe medicamente se metabolizeaza, adica sufera in organism transformari chimice, care le modifica proprietatile fizico-chimice si biologice. Sunt metabolizati mai ales compusii liposolubili. Metabolitii rezultati rezultati sunt mai polari si au in consecinta o solubilitate mai scazuta in grasimi. Reactiile chimice prin care are loc metabolizarea medicamentelor sunt catalizate enzimatic si sunt de mai multe tipuri: oxidari, reduceri, hidrolize si conjugari (cuplari),
Majoritatea proceselor de biotransformare a medicamentelor are loc in ficat, sub actiunea enzimelor microzomale si nemicrozomale.
Enzimele microzomale sunt enzime localizate în reticulul endoplasmatic neted, care este cuprins în fractiunea microzomala a omogenatelor de organ.
Enzime microzomale metabolizante ale medicamentelor se mai gasesc si în rinichi, mucoasa intestinala, glanda corticosuprarenala. Enzimele microzomale catalizeaza reactiile de oxidare, reducere si gluconoconjugare a multor medicamente si ale câtorva substante fiziologice endogene (acizi grasi, hormoni steroidici, bilirubina).
În reactiile de oxidare a medicamentelor care conduc la formarea unor derivati hidroxilici, un rol deosebit de important revine sistemului enzimatic microzomal, cunoscut sub denumirea de monooxigenaza, oxidaza mixta sau hidroxilaza. Acest sistem este lipsit de specificitate si cuprinde NADPH citocrom P 450 reductaza si citocromul P 450, care realizeaza transferul de electroni. NADPH este sursa de electroni, iar NADPH citocrom P 450 reductaza este o flavoproteina care reduce citocromul P 450. Acesta este o hemoproteina, care formeaza un complex ternar cu medicamentul (substrat) si cu oxigenul, rezultând în final substratul hidroxilat, citocrom P 450 oxidat si apa. Dintre cele 12 familii de citocrom P 450 identificate la om, primele 3 intervin în majoritatea biotransformarilor medicamentelor. În multe cazuri, asupra unei substante medicamentoase actioneaza mai multi citocromi P 450.
Reactiile de oxidare produse sub actiunea enzimelor microzomale din ficat sunt: dezalchilari oxidative, oxidari ale catenelor alifatice, oxidari ale compusilor aromatici, epoxidari, N-oxidari, sulfoxidari, dezaminari, desulfurari, S-demetilari. Tot sub actiunea unor enzime microzomale din ficat se produc si reactiile de glucuronoconjugare (cu acidul uridin-difosfat glucuronic) la nivelul grupelor amino, carboxil, sulfhidril si oxidril.
Sub actiunea unor enzime microzomale extrahepatice se produc reactii de azo si nitroreducere.
O serie de enzime nemicrozomale (libere, solubile) din ficat, plasma si alte tesuturi catalizeaza alte biotransformari si anume: reactii de oxidare a unor alcooli, aldehide, amine, baze purinice, reactii de hidroliza a unor esteri, amine, peptide, reactii de transsulfurare, reactii de conjugare cu acid acetic, metil-derivati, sulfati, glicina, gflutation, inclusiv formarea de ribonucleotide si nucleozide.
Tipul de reactie prin care se realizeaza metabolizarea unui medicament depinde de grupele functionale prezente în molecula, dupa cum urmeaza:
grupele hidroxil alcoolice sunt oxidate sau glucuronoconjugate;
grupele hidroxil aromatice sunt glicino- sau glucuronoconjugate;
grupele aminoalifatice sunt eliminate (dezaminare) sau glucuronoconjugate;
grupele aminoaromatice sunt acetilate, glucuronoconjugate sau metilate
nucleele aromatice sunt hidroxilate.
În ceea ce priveste viteza reactiilor de metabolizare, aceasta poate fi:
dependenta de cantitatea de medicament si deci corespunzatoare unei cinetici de ordinul 1, care se întâlneste la cele mai multe dintre reactiile de biotransformare, în care cantitatea de medicament reprezentata de dozele uzuale este mult inferioara celei necesare pentru saturarea enzimelor metabolizante.
independenta de cantitatea de medicament, ceea ce corespunde unei cinetici de ordinul 0, întâlnita destul de rar, ca de exemplu în cazul alcoolul etilic, care este metabolizat cu ritm constant, indiferent de cantitatea de introdusa în organism.
o viteza care se modifica în functie de cantitatea de medicament astfel: dupa o cinetica de ordinul 1 pentru doze relativ mici si dupa o cinetica de ordinul 0, corespunzoare unei viteze scazute, pentru cantitatile care depasesc acste doze, saturând enzimele metabolizante.

|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 63
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved