| CATEGORII DOCUMENTE |
| Aeronautica | Comunicatii | Electronica electricitate | Merceologie | Tehnica mecanica |
Expresia analitica a principiului I al termodinamicii
1. Sisteme termodinamice inchise
Expresia analitica a principiului I al termodinamicii (PITD) dobandeste o forma particulara in functie de tipul sistemului termodinamic inchis. Astfel:
Ø
pentru sisteme termodinamice
inchise izolate, care nu schimba energie cu mediul
exterior sub nici o forma (nici caldura, nici lucru mecanic), legea generala a
conservarii si transformarii energiei ia forma particulara: ![]() , [J] (2.25), in care U reprezinta energia interna a
sistemului termodinamic.
, [J] (2.25), in care U reprezinta energia interna a
sistemului termodinamic.
Un exemplu de sistem termodinamic izolat este un fluid aflat intr-o incinta izolata termic (Figura 2.11).
In mod evident, in absenta oricarei
interactiuni intre ST si ME, energia continuta in ST ramane constanta. In
consecinta, eventuale procese care au loc intre diferitele parti ale
sistemului sau intre diferitele subsisteme componente au ca efect
redistribuirea diferitelor energii de acumulare, in sensul uniformizarii
lor in interiorul sistemului termodinamic, fara modificarea energiei
continute in sistem.
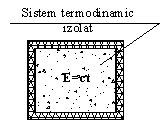
Figura 2.11. ST izolat
Enuntul Principiului I al Termodinamicii in acest caz este urmatorul: "Energia unui sistem termodinamic izolat se mentine constanta, oricare ar fi procesele care se desfasoara in interiorul sistemului".
Ø
pentru
sisteme termodinamice inchise adiabatice, care schimba cu mediul exterior energie numai sub forma
de lucru mecanic, transferul de caldura fiind nul, legea
generala a conservarii si transformarii energiei ia forma particulara: ![]() , [J] (2.26)
, [J] (2.26)
in care: - dU - variatia elementara a energiei interne a sistemului termodinamic, [J];
![]() - lucrul mecanic
elementar primit de sistemul termodinamic din mediul exterior, [J].
- lucrul mecanic
elementar primit de sistemul termodinamic din mediul exterior, [J].
Ca exemplu de sistem termodinamic inchis adiabatic poate fi considerat gazul aflat intr-un cilindru izolat termic, in interiorul caruia se deplaseaza fara frecare un piston (Figura 2.12).
Prin integrarea ecuatiei (2.26) intre starile 1 si 2 se obtine: Interpretarea ecuatiei este urmatoarea: lucrul mecanic
primit de ST inchis adiabatic de la ME conduce la
cresterea energiei sale interne.
![]() si
si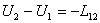 , [J] (2.27)
, [J] (2.27)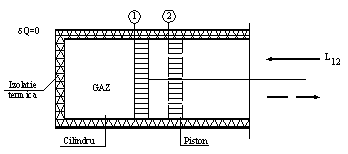
Figura 2.12. Sistem termodinamic inchis adiabatic
Pentru m =1
kg, ecuatia (2.27) devine: ![]() , [J/kg] (2.28)
, [J/kg] (2.28)
Ø pentru sisteme termodinamice inchise, care schimba energie sub forma de lucru mecanic si de caldura cu mediul exterior, sa consideram exemplul unui gaz aflat intr-un cilindru, in interiorul caruia se deplaseaza etans si fara frecare, un piston (Figura 2.13).
Daca acest ST primeste energie termica
(caldura) de la ME, atunci, potrivit principiului
I al termodinamicii, aceasta energie se conserva si se transforma in
alte forme de energie. Care sunt acestea? Este vorba despre
lucru mecanic si de energie interna.
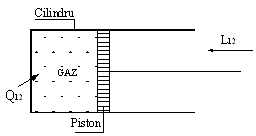
Figura 2.13. Sistem termodinamic inchis
Asadar, in starea termodinamica 1, gazul din cilindru, cu masa constanta, m = ct., are energia interna U1; ca urmare a aportului de caldura de la mediul exterior, gazul parcurge un proces termodinamic, la finele caruia atinge o noua stare de echilibru, 2, caracterizata prin energia interna U2. Pe parcursul acestui proces, gazul efectueaza lucru mecanic de variatie de volum (pistonul se deplaseaza in interiorul cilindrului).
Bilantul
energetic, care exprima egalitatea intre energia intrata si cea iesita din
sistemul termodinamic, are urmatoarea forma: ![]() , [J] (2.29)
, [J] (2.29)
In aceasta relatie, Q12 reprezinta caldura primita de ST de la ME in procesul 1 - 2, iar Lv12 reprezinta lucrul mecanic de variatie de volum efectuat de ST in procesul 1 - 2.
Relatia (2.29) reprezinta exprimarea matematica finita a principiului I al termodinamicii, pentru sisteme termodinamice inchise. Ea poate fi pusa si sub forma:
![]()
care permite formularea enuntului principiului I al termodinamicii: alimentarea simultana a unui sistem termodinamic inchis cu caldura si cu lucru mecanic (cazul cel mai general posibil) conduce la modificarea energiei lui interne.
In ipoteza ca masa ST este m = 1 kg, relatia (2.29) se scrie:
![]() , [J/kg] (2.30)
, [J/kg] (2.30)
Exprimarea matematica diferentiala a PITD pentru sisteme termodinamice inchise este:
![]() , [J] (2.31)
, [J] (2.31)
in care: - ![]() - caldura elementara
primita de sistemul termodinamic de la mediul
exterior, [J];
- caldura elementara
primita de sistemul termodinamic de la mediul
exterior, [J];
-
![]() - lucrul mecanic
elementar cedat de sistemul termodinamic mediului exterior, [J].
- lucrul mecanic
elementar cedat de sistemul termodinamic mediului exterior, [J].
In ipoteza ca masa ST este m = 1 kg, relatia (2.31) se scrie:
![]() (2.31)*
(2.31)*
Pentru procese
reversibile (cvasistatice), care se desfasoara cu viteza infinit de lenta,
expresia diferentiala a principiului intai este: ![]()
In ipoteza ca masa ST este m = 1 kg, relatia (2.32) se scrie:
![]() (2.32)*
(2.32)*
In cazul particular in care un sistem termodinamic evolueaza intr-un proces ciclic, principiul intai al termodinamicii are urmatoarea expresie analitica:
![]() , [J]
(2.33)
, [J]
(2.33)
Intrucat energia interna este o marime de stare, variatia ei este data de diferenta intre valoarea finala si cea initiala. Cum pentru un proces ciclic valoarea initiala a parametrului de stare este egala cu valoarea finala, rezulta:
![]() (2.34)
(2.34)
In consecinta, expresia analitica a principiului intai al termodinamicii pentru sisteme termodinamice inchise care evolueaza in procese ciclice este:
![]() , [J] (2.35)
, [J] (2.35)
Prin integrarea ecuatiei (2.35) de-a lungul ciclului termodinamic se obtine:
![]() , [J] (2.36)
, [J] (2.36)
Interpretarea relatiei (2.36) este urmatoarea: lucrul mecanic si caldura transferate intre un sistem termodinamic si mediul exterior in cadrul unui proces ciclic sunt echivalente.
Alte formulari ale principiului intai al termodinamicii, care decurg din legea generala a conservarii si transformarii energiei sunt:
Nu se poate realiza o masina termica cu functionare continua, care sa produca lucru mecanic, fara a consuma o cantitate echivalenta de caldura.
O astfel de masina, care ar produce continuu lucru mecanic fara sa consume o cantitate echivalenta din alta forma de energie a primit denumirea de perpetuum mobile de speta intai, intrucat contrazice principiul intai al termodinamicii, prin aceea ca afirma posibilitatea crearii de energie.
Un perpetuum mobile de speta intai este imposibil.
Caldura se poate transforma in lucru mecanic, sau poate fi produsa din lucru mecanic, totdeauna cu respectarea urmatorului raport de echivalenta:
![]() .
.
![]()
EXEMPLE de CALCUL
Principiul I al Termodinamicii pentru sisteme termodinamice inchise
E 1. Un kg de gaz perfect aflat intr-un cilindru, in care se deplaseaza etans si fara frecare un piston, primeste de la mediul exterior, caldura q12 = 600 kJ/ kg.
a) Sa se determine variatia energiei sale interne, stiind ca gazul efectueaza un lucru mecanic de variatie de volum, lv 12 = 350 kJ/ kg;
b) Care este variatia energiei interne a gazului, in ipoteza ca pistonul este impiedicat sa se deplaseze in interiorul cilindrului?
R e z o l v a r e
a) Gazul perfect aflat in
cilindru reprezinta un sistem termodinamic inchis (Figura
2.13), pentru care, PITD are urmatoarea exprimare matematica (relatia 2.30): ![]() .
.
Rezulta: ![]() = 600 - 350 = 250 kJ/
kg.
= 600 - 350 = 250 kJ/
kg.
b) Ipoteza ca pistonul este impiedicat sa se deplaseze in cilindru conduce la concluzia ca gazul este impiedicat sa efectueze lucru mecanic de variatie de volum. In consecinta, lv 12 = 0.
Ca urmare, PITD are urmatoarea exprimare
matematica particulara: ![]() .
.
![]() Rezulta ca intreaga caldura primita de
gazul perfect de la mediul exterior are ca efect variatia energiei sale
interne: u2 - u1
= 600 kJ/ kg.
Rezulta ca intreaga caldura primita de
gazul perfect de la mediul exterior are ca efect variatia energiei sale
interne: u2 - u1
= 600 kJ/ kg.
E 2. Intr-un cilindru izolat termic, in care se deplaseaza etans si fara frecare un piston (Figura 2.12), se afla un gaz perfect cu masa m = 2 kg de aer si cu temperatura T1 = 300 K. Prin deplasarea pistonului, acesta sufera un proces reversibil de comprimare, iar temperatura lui creste la T2 = 500 K.
Sa se determine:
a) lucrul mecanic necesar comprimarii, stiind ca valoarea medie a caldurii specifice a aerului, la volum constant, este: cv = 0,727 kJ/(kg K);
b) variatia energiei interne a aerului.
R e z o l v a r e
a) Intrucat gazul
perfect aflat in cilindru reprezinta un sistem termodinamic inchis, expresia
matematica PITD este urmatoarea (relatia 2.29):
![]() , [J].
, [J].
Izolatia termica impiedica schimbul de caldura intre gaz si mediul exterior, asadar Q12 = 0.
Rezulta: Lv12 = U1 - U2 = m cv (T1 - T2) = 2 727 (300 - 500) = - 290800 J = - 290,8 kJ.
Conform conventiei de semne in termodinamica tehnica, semnul minus asociat valorii lucrul mecanic inseamna ca mediul exterior efectueaza lucru mecanic asupra sistemului termodinamic, altfel spus sistemul termodinamic primeste lucru mecanic de la mediul exterior.
b) Variatia energiei interne a aerului, U2 - U1 = - Lv12 = 290,8 kJ.
E 3. In cilindrul unui motor cu aprindere prin comprimare, agentul termodinamic, considerat gaz perfect, este comprimat adiabatic de la presiunea p1 = 1 bar si volumul V1 = 0,5 dm3, la presiunea p2 = 49 bar si volumul V2 = 0,025 dm3, ceea ce face ca energia sa interna sa varieze cu 225 J.
Sa se determine:
a) variatia entalpiei agentului termodinamic, ca urmare a comprimarii sale adiabatice;
b) lucrul mecanic de variatie de volum, necesar comprimarii.
a) Pornind de la relatia de definitie a entalpiei (relatia 2.7), rezulta ca:
H2 - H1 = (U2 - U1 ) - (p2 V2 - p1 V1) = 255 + (49 105 0,025 10-3 - 105 0,5 10-3) =
= 297,5 J.
b) Lucrul mecanic de variatie de volum,
necesar comprimarii poate fi calculat din expresia matematica PITD (relatia 2.29),
pentru ST inchise: ![]() , [J].
, [J].
Intrucat agentului termodinamic este comprimat adiabatic, acesta nu schimba caldura cu mediul exterior, pe parcursul acestui proces, asadar: Q12 = 0.
Rezulta: Lv12 = - (U2 - U1 ) = - 225 J.
E 4. Pe parcursul evolutiei sale in cilindrul unui motor cu ardere interna, agentul termodinamic primeste de la ME caldura Q12 = 320 kJ si cedeaza ME lucrul mecanic de variatie de volum Lv12 =120468 J. Stiind ca, in evolutia sa, agenul termodinamic inchide ciclul 1a2b1 si ca, in starea finala, 2, volumul agentului termodinamic este egal cu volumul
![]() starii initiale, 1 (Figura E 4), sa se determine:
starii initiale, 1 (Figura E 4), sa se determine:
a) variatia energiei interne a acestuia, in procesul 1 - 2;
b) caldura schimbata de agentul termic cu mediul exterior, in procesul 2 - 1;
c) lucrul mecanic schimbat de agentul termic cu mediul exterior, pe parcursul intregului ciclu termodinamic;
d) caldura schimbata de agentul termic cu mediul exterior, pe parcursul intregului ciclu termodinamic;
e) sa se verifice rezultatele cu ajutorul expresiei matematice a PITD pentru procese ciclice (relatia 2.36).
R e z o l v a r e
a) Variatia
energiei interne a agentului termic, in procesul 1 - 2, rezulta din relatia: ![]() .
.
Astfel, U2 - U1 = Q12 - Lv12 = 320000 - 120468 = 199532 J = 199,5 kJ.
b)
Pentru a calcula caldura
schimbata de agentul termic cu mediul exterior, in procesul 2 - 1, vom
scrie expresia matematica a PITD pentru acest proces: Q21 = Lv21 + (U1 - U2) . Cum volumul agentului termodinamic
in starea finala, 2, notat V2
, este egal cu volumul starii initiale, 1, notat V1 , inseamna
ca in transformarea 2 - 1, lucrul mecanic de variatie de volum, Lv21 = 0.
Figura E 4.
Caldura Q21 este data asadar de variatia energiei interne a agentului termic:
Q21 = U1 - U2 = - (U2 - U1 ) = - 199,5 kJ.
c) Lucrul mecanic schimbat de agentul termic cu ME, pe parcursul intregului ciclu termodinamic este dat de urmatoarea suma: Lc = L12 + L21 = L12 = 120468 J = 120,46 kJ.
d) Caldura schimbata de agentul termic cu ME, pe parcursul intregului ciclu termodinamic este data de urmatoarea suma:
Qc = Q12 + Q21 = 320 + (- 199,532) = 120,46 kJ.
e) Expresia matematica a PITD pentru procese ciclice este urmatoarea: Qc = Lc . Se observa ca rezultatele obtinute la punctele c) si d) verifica aceasta egalitate; ele sunt asadar, corecte.
E 5. In cilindrul unei masini termice, agentul termic se destinde - pe traseul 1a2 - si efectueaza lucrul mecanic Lv12 = 35 kJ, ca urmare a caldurii primite, Q12 = 60 kJ. Pe traseul de revenire in starea termodinamica initiala, agentul termic cedeaza mediului exterior caldura Q21 = - 45 kJ. Sa se determine:
a) lucrul mecanic efectuat de agentul termic pe intreg ciclul termodinamic, 1a2b1;
b) caldura schimbata de agentul termic cu mediul exterior pe intreg ciclul termodinamic, 1a2b1.
Sa se verifice rezultatele obtinute cu ajutorul expresiei matematice a PITD pentru procese ciclice.
a) Scris
pentru traseul 1a2, PITD are forma: Din
aceasta relatie se poate calcula variatia energiei interne: U2 - U1 = 60 - 35 = 25 kJ. Scris pentru traseul 2b1, PITD are
forma: Q21 = Lv21 + (U1
- U2). Din
aceasta relatie se poate calcula lucrul mecanic efectuat de agentul termic: Lv21 = - 45 + 25 = -20
kJ.![]()
R e z o l v a r e
![]() .
.

Figura E 5.
Lucrul mecanic efectuat de agentul termic pe intreg ciclul termodinamic, 1a2b1, se calculeaza cu relatia: Lc = L12 + L21 = 35 + (- 20) = 15 kJ.
b) Caldura schimbata de agentul termic cu mediul exterior pe intreg ciclul termodinamic, 1a2b1, se calculeaza cu relatia: Qc = Q12 + Q21 = 60 + (- 45) = 15 kJ.
Expresia matematica a PITD pentru procese ciclice este urmatoarea: Qc = Lc . Se observa ca rezultatele obtinute la punctele b) si a) verifica aceasta egalitate; ele sunt asadar, corecte.
E 6. Un frigider casnic elimina, zilnic, prin condensatorul agregatului sau frigorific, spre aerul ambiant, caldura Q = 2592 kJ. Dupa o perioada de functionare de o zi, consumul de energie electrica la motorul frigiderului a fost de 0,6 kWh. Sa se determine aportul de caldura zilnic, furnizat de aerul ambiant, aerului din interiorul frigiderului.
R e z o l v a r e
Conform PITD pentru ST inchise, suma
energiilor intrate in ST este egala cu suma energiilor iesite din ST: QA
+ L = Q , [J], in care, QA
reprezinta necunoscuta problemei, respectiv caldura furnizata
de mediul ambiant sistemului termodinamic. Rezulta: QA
= Q - L
= 2592 - 2160 = 432 kJ.
Frigiderul
reprezinta un ST inchis, care elimina (altfel spus cedeaza), in decurs de o zi,
mediului exterior - aerul ambiant -, caldura Q = 2592 kJ, si care consuma, in aceeasi perioada de timp (o zi),
energie electrica, altfel spus lucru mecanic electric, L = 0,6 kWh = 0,6 kJ/s
3600 s = 2160 kJ.

Figura E 6.
E 7. In cilindrul unui compresor se afla argon, cu masa m = 0,5 kg, la presiunea initiala p1 = 1 bar. Argonul, considerat gaz perfect, sufera un proces reversibil de comprimare, pana la presiunea finala p2 = 4 bar. Volumul ocupat de argon, in starea initiala este V1 = 0,10 m3. Ecuatia transformarii de stare, suferite de argon, este data de relatia: p v1,4 = ct. Energia interna specifica a argonului variaza dupa legea: u = 1,5 p v + u0
Sa se determine caldura schimbata de argon cu mediul exterior, pe parcursul procesului de comprimare.
![]() R e z o l v a r e
R e z o l v a r e
Gazul perfect aflat in cilindru reprezinta un sistem termodinamic inchis, pentru care, PITD are urmatoarea exprimare matematica (relatia 2.29):
![]() , [J], in care:
, [J], in care: ![]() .
.
Scrise pentru un ST cu masa de 1 kg, relatiile anteriore
devin: ![]() , [J/kg], si
, [J/kg], si ![]() . Rezulta:
. Rezulta: ![]() , care se poate scrie:
, care se poate scrie:
![]() .
.
Prin urmare, ![]() .
.
Asadar: ![]() , in care v1 si v2
trebuie calculate.
, in care v1 si v2
trebuie calculate.
Volumul
specific masic al argonului, in starea termodinamica initiala, rezulta din
relatia lui de definitie:![]() m3/kg.
m3/kg.
Pentru a
determina volumul specific masic al argonului, in starea termodinamica finala,
folosim ecuatia de stare a transformarii: ![]() , de unde rezulta:
, de unde rezulta: 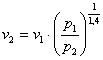 . Inlocuind cu cifre, obtinem:
. Inlocuind cu cifre, obtinem: 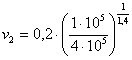 = 0,0743 m3/kg.
= 0,0743 m3/kg.
Revenind la calculul caldurii, obtinem:
q12 9720 J/kg = 9,72 kJ/kg.
In final: Q12 = m q12 4860 J = 4,86 kJ.
Observatie: Potrivit conventiei de semne din termodinamica, semnul minus obtinut pentru caldura semnifica faptul ca ST cedeaza caldura mediului exterior.
2. Sisteme termodinamice deschise
Fie un sistem termodinamic deschis, reprezentat de o masina termica de forta (MT), adica de o masina care primeste caldura de la mediul exterior, pentru a produce lucru mecanic.
Exemple de masini termice de forta: masina cu abur, care utilizeaza energia acestuia, pentru a produce lucru mecanic; motoarele cu ardere interna, care utilizeaza caldura degajata prin arderea combustibilului, in scopul producerii de lucru mecanic ciclic; instalatiile de turbine cu abur, care utilizeaza combustibil pentru producerea aburului, iar acesta produce lucru mecanic prin destinderea sa in turbina; instalatiile de turbine cu gaz, care transforma energia termica continuta de gazele de ardere, in lucru mecanic, prin destinderea acestora in turbina.
In Figura 2.14 este reprezentata, schematic, o masina termica de forta, care schimba cu mediul exterior atat energie, cat si masa (substanta), prin cele doua racorduri - de intrare, respectiv iesire - a curentului de materie, aflat in curgere.
Fie
![]() debitul masic de agent termodinamic, care primeste
caldura Q12 de la ME si efectueaza (cedeaza mediului
exterior), lucrul mecanic tehnic, Lt12, pe parcursul procesului
termodinamic 1-2, care se desfasoara la curgerea agentului termodinamic
intre sectiunile 1 si 2.
debitul masic de agent termodinamic, care primeste
caldura Q12 de la ME si efectueaza (cedeaza mediului
exterior), lucrul mecanic tehnic, Lt12, pe parcursul procesului
termodinamic 1-2, care se desfasoara la curgerea agentului termodinamic
intre sectiunile 1 si 2.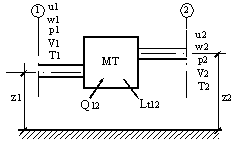
Figura 2.14. Sistem termodinamic deschis
In sectiunea 1 - de
intrare in MT -, agentul termodinamic se caracterizeaza prin urmatorii
parametri de stare: energia interna, U1, presiunea ![]() , volumul
, volumul ![]() , temperatura
, temperatura ![]() , viteza
, viteza ![]() si cota z1,
in raport cu un sistem de referinta.
si cota z1,
in raport cu un sistem de referinta.
In sectiunea 2 - de
iesire din MT -, agentul termodinamic se caracterizeaza prin urmatorii
parametri de stare: energia interna, U2, presiunea ![]() , volumul
, volumul ![]() , temperatura
, temperatura ![]() , viteza
, viteza ![]() si cota z2,
in raport cu acelasi sistem de referinta.
si cota z2,
in raport cu acelasi sistem de referinta.
Admitem ipoteza curgerii stationare a agentului termic prin motorul termic, ceea ce inseamna ca parametrii mentionati mai sus nu se modifica in timp.
Intrucat PITD se exprima matematic printr-un bilant intre energiile intrate in sistem si cele iesite din sistem, ne punem problema sa determinam energia totala a agentului termodinamic la intrarea, respectiv iesirea sa din ST deschis.
Energia totala a agentului termodinamic la intrarea in ST deschis, notata E1
, este formata din energia interna ![]() , la care se adauga energia de dislocare (de curgere),
, la care se adauga energia de dislocare (de curgere), ![]() , energia cinetica,
, energia cinetica, ![]() si energia potentiala
a agentului termodinamic,
si energia potentiala
a agentului termodinamic, ![]() . Asadar,
. Asadar,
![]() , [J] (2.37)
, [J] (2.37)
In mod similar, energia totala a agentului termic la iesirea din ST deschis este data de relatia:
![]() , [J] (2.38)
, [J] (2.38)
Prin aplicarea bilantului energiilor se
obtine:![]() , [J] (2.39)
, [J] (2.39)
![]() , [J] (2.40)
, [J] (2.40)
Prin inlocuirea expresiilor ![]() si
si ![]() , date de ecuatiile (2.37) si (2.38) in ecuatia (2.40)
rezulta:
, date de ecuatiile (2.37) si (2.38) in ecuatia (2.40)
rezulta:
![]() , [J] (2.41)
, [J] (2.41)
Tinand seama de relatia de definitie a entalpiei: ![]() , relatia (2.41) devine:
, relatia (2.41) devine:
![]() , [J] (2.42)
, [J] (2.42)
Relatia (2.42) reprezinta expresia analitica a principiului intai al termodinamicii
pentru sisteme termodinamice deschise, in regim stationar. Pentru ![]() agent termic, se
obtine, din relatia (2.42), forma specifica
a principiului I:
agent termic, se
obtine, din relatia (2.42), forma specifica
a principiului I:
![]() , [J/kg] (2.43)
, [J/kg] (2.43)
Forma diferentiala a PITD pentru sisteme termodinamice
deschise, care corespunde transformarilor elementare ale sistemului
termodinamic cu ![]() , se obtine din relatia (2.43):
, se obtine din relatia (2.43):
![]() (2.44)
(2.44)
![]()
EXEMPLE de CALCUL
Principiul I al Termodinamicii pentru sisteme termodinamice deschise
E 8. Printr-un canal de ventilatie, cu sectiunea transversala interioara de 500
x 500 mm, este vehiculat un debit volumic de aer ![]() = 2000 m3/h, avand temperatura t = +20C.
Canalul, montat in pozitie orizontala, este prevazut cu un confuzor, care
micsoreaza sectiunea lui transversala, la dimensiunile: 250 x 250 mm. Sa se
determine presiunea aerului in sectiunea transversala ingustata, stiind ca:
= 2000 m3/h, avand temperatura t = +20C.
Canalul, montat in pozitie orizontala, este prevazut cu un confuzor, care
micsoreaza sectiunea lui transversala, la dimensiunile: 250 x 250 mm. Sa se
determine presiunea aerului in sectiunea transversala ingustata, stiind ca:
presiunea manometrica a aerului in sectiunea initiala este p1 = 60 mmCA;
presiunea barometrica a aerului este p = 101325 Pa;
densitatea aerului, considerata constanta, este ρ = 1,2 kg/m3.
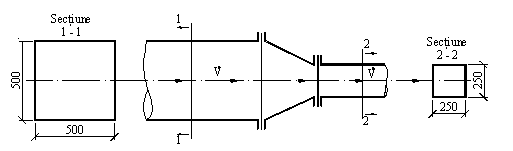
Figura E 8.
Aerul care circula prin canalul de ventilatie reprezinta un ST deschis, pentru care PITD are urmatoarea formulare matematica finita (relatia 2.43):
![]() , [J/kg], care poate
fi scrisa si sub forma:
, [J/kg], care poate
fi scrisa si sub forma:
![]()
Aceasta relatie generala admite, in cazul concret al acestei aplicatii, urmatoarele particularizari:
aerul, cu temperatura t = +20C, nu schimba caldura cu ME, la trecerea lui prin canalul de ventilatie, intre sectiunile transversale 1 si 2; in consecinta, q12 = 0;
aerul nu schimba lucru mecanic cu ME, la trecerea lui prin canalul de ventilatie, intre sectiunile transversale 1 si 2; in consecinta, lv12 = 0;
temperatura aerului nu se modifica, asadar energia lui interna (care este o functie de temperatura) are aceeasi valoare si in sectiunea transversala 1 si in sectiunea transversala 2; in consecinta, u2 - u1 = 0;
canalul de ventilatie este pozitionat orizontal, asadar z2 = z;
densitatea aerului este constanta la trecerea lui prin canalul de ventilatie, intre sectiunile transversale 1 si 2, ceea ce face ca volumul specific masic al aerului, care este inversul densitatii, sa pastreze de asemenea o valoare constanta; in consecinta, v1 = v2.
![]() Tinand seama de toate acestea, expresia
matematica finita a PITD devine:
Tinand seama de toate acestea, expresia
matematica finita a PITD devine:
![]() , in care necunoscuta este p2.
, in care necunoscuta este p2.
Este nevoie asadar de valorile vitezelor
aerului, in sectiunile transversale 1 si 2. Scriem pentru acest calcul ecuatia
de continuitate: ![]() si o aplicam pe rand,
celor doua sectiuni transversale. Rezulta:
si o aplicam pe rand,
celor doua sectiuni transversale. Rezulta: ![]() si
si ![]() , relatii in care debitul volumic are valoare cunoscuta.
, relatii in care debitul volumic are valoare cunoscuta.
Putem deci calcula: ![]() 2,22 m/s si
2,22 m/s si
![]() 8,88 m/s.
8,88 m/s.
Relatia de
calcul a presiunii p2 este: ![]()
= 101913,6 - 44,35 = 101868,25 N/m2 = 101868,25 Pa.
Observatie: In relatiile de calcul intervin valorile absolute ale presiunii si nu cele manometrice. Se stie ca relatia dintre cele doua este: pabs = pman + pbar .
E 9. O pompa de apa, montata la adancimea z1 = -10m in
raport cu nivelul solului, alimenteaza un consumator, aflat la cota z2
=+1m, cu un debit volumic ![]() = 2m3/h.
Pompa creste presiunea apei, de la valoarea p1 = 1 bar, la
valoarea p2 = 6 bar. Sa se determine:
= 2m3/h.
Pompa creste presiunea apei, de la valoarea p1 = 1 bar, la
valoarea p2 = 6 bar. Sa se determine:
a) lucrul mecanic tehnic consumat de aceasta pompa;
b) puterea electrica teoretica necesara motorului de antrenare al pompei.
Se admite ca temperatura apei nu se modifica in timpul procesului de pompare, astfel incat densitatea ei are valoarea constanta de 1000 kg/m3. In plus, se admite ca viteza apei, in sectiunea de aspiratie, 1, este aproximativ egala cu viteza din sectiunea de refulare, 2.
a) Apa vehiculata de pompa reprezinta un ST
deschis, pentru care PITD are urmatoarea formulare matematica finita: ![]() .
.
apa nu schimba caldura cu ME, pe parcursul procesului de pompare, intre sectiunile transversale 1 si 2; in consecinta, q12 = 0;
temperatura apei fiind constanta, asadar energia ei interna (functie de temperatura) are aceeasi valoare si in sectiunea transversala 1 si in sectiunea transversala 2; in consecinta, u2 - u1 = 0;
- viteza apei, in sectiunea de aspiratie, 1, este aproximativ egala cu viteza din sectiunea de refulare, 2, respectiv: w1 = w2.
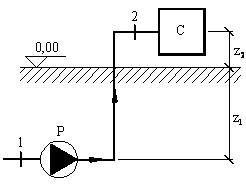
Figura E 9.
![]() Tinand seama de toate acestea, expresia
matematica finita a PITD devine:
Tinand seama de toate acestea, expresia
matematica finita a PITD devine:
lt12 = - (p2 v2 - p1 v1) - g (z2 - z1) = ![]() (p1 - p2) - g (z2 - z1) =
(p1 - p2) - g (z2 - z1) =
607,91 J/kg 608 J/kg.
Interpretarea semnului minus obtinut pentru lucrul mecanic tehnic: ST consuma lucru mecanic, primit de la ME.
b) Puterea electrica teoretica
necesara motorului de antrenare al pompei se calculeaza cu relatia: ![]() 337,7 J/s 338 W.
337,7 J/s 338 W.
E 10. Printr-un
dispozitiv de reducere adiabatica a presiunii (ventil de laminare, VL) circula
un debit masic de abur ![]() = 300 kg/h. La intrarea in dispozitiv, aburul are urmatorii parametri: presiunea p1
= 2 bar, volumul specific v1 = 0,9603 m3/kg si
entalpia specifica h1
= 2769 kJ/kg. La iesirea din ventilul de laminare, aburul are presiunea p2 =
1,5 bar si volumul specific v2 = 1,285 m3/kg.
Sectiunea de trecere a ventilului de laminare este S = 0,02 m2. Sa se determine entalpia starii finale a aburului,
dupa laminare.
= 300 kg/h. La intrarea in dispozitiv, aburul are urmatorii parametri: presiunea p1
= 2 bar, volumul specific v1 = 0,9603 m3/kg si
entalpia specifica h1
= 2769 kJ/kg. La iesirea din ventilul de laminare, aburul are presiunea p2 =
1,5 bar si volumul specific v2 = 1,285 m3/kg.
Sectiunea de trecere a ventilului de laminare este S = 0,02 m2. Sa se determine entalpia starii finale a aburului,
dupa laminare.
R e z o l v a r e
Dispozitivul de reducere adiabatica a presiunii aburului reprezinta un ST deschis (Figura E 10). Laminarea aburului la trecerea prin acest dispozitiv este un proces pe parcursul caruia aburul nu schimba nici caldura, nici lucru mecanic cu ME, asadar Q12 = 0 si Lt12 = 0; in plus, cota de intrare a aburului in VL este aceeasi cu cota de iesire, deci: z1 = z2.
Tinand seama de toate aceste particularizari,
expresia PITD pentru ST deschise, data de relatia (2.43),
devine: 
![]() , de unde entalpia specifica necunoscuta, h2
, se calculeaza cu
relatia:
, de unde entalpia specifica necunoscuta, h2
, se calculeaza cu
relatia:![]() .
.
Figura E 10.
Vitezele aburului in sectiunile de intrare si de iesire din VL se calculeaza pornind de la ecuatia de
continuitate: ![]() . Pe de alta parte, debitul volumic de abur este dat si de
relatia:
. Pe de alta parte, debitul volumic de abur este dat si de
relatia: ![]()
Scrisa pentru sectiunea transversala de intrare in
VL, ecuatia de continuitate are forma: ![]() , de unde:
, de unde: ![]() = 4,001 m/s.
= 4,001 m/s.
In mod similar, se calculeaza viteza
aburului in sectiunea transversala de iesire din VL, cu relatia: ![]() 5,35 m/s.
5,35 m/s.
Rezulta: ![]() 2762,68 kJ/kg.
2762,68 kJ/kg.
Se observa ca termenul care reprezinta variatia energiei cinetice a aburului (6,311 kJ/kg) este neglijabil in raport cu valoarea initiala a entalpiei, intrucat el reprezinta numai 0,22%.
![]() Se poate asadar considera ca procesul de
laminare adiabatica a unui fluid este unul desfasurat la entalpie constanta (h2 = h1).
Se poate asadar considera ca procesul de
laminare adiabatica a unui fluid este unul desfasurat la entalpie constanta (h2 = h1).
E 11. In radiatorul unei instalatii de incalzire se utilizeaza abur, la presiunea initiala p1 = 1,0499 bar, avand volumul specific v1 = 1,618 m3/kg si energia interna specifica u1 = 2507,13 kJ/kg. Aburul cedeaza caldura aerului ambiant, prin intermediul suprafetei radiatorului, condenseaza si paraseste radiatorul la aceeasi presiune. Volumul specific al condensului este v2 =1,618 m3/kg, iar entalpia lui specifica este h2 = 423,3 kJ/kg. Diferenta de cota dintre axele conductelor de intrare a aburului si de evacuare a condensului este de 0,6 m. Sa se determine caldura cedata de abur aerului inconjurator.
R e z o l v a r e
Cu aceste particularizari, expresia
matematica a PITD pentru sisteme termodinamice deschise devine: q12 =(h2 h1) + g (zz z1), [J/kg] , care, scrisa in functie de energia
interna, are forma: q12 = h2 (u1 +p1 v1) + g (zz z1), [J/kg]. Inlocuind cu
valori numerice, obtinem: q12 = 2253697,934 J/kg = = 2253,697 kJ/kg.
Aburul care circula
prin radiatorul instalatiei de incalzire reprezinta un ST deschis, care cedeaza
caldura mediului exterior, i.e. aerului ambiant. Curgerea lui prin radiator nu
are ca efect schimb de lucru mecanic cu mediul exterior, asadar lt12 = 0. In plus, se poate
admite ca viteza agentului termic la intrarea in radiator este egala cu viteza
agentului termic la iesirea in radiator: w2
= w1.

Figura E 11.
Observatie: Potrivit conventiei de semne din termodinamica, semnul minus obtinut pentru caldura semnifica faptul ca ST cedeaza caldura mediului exterior.
E 12. Intr-un compresor de aer, gazul este comprimat reversibil, de la presiunea initiala, p1 = 1 bar, si temperatura t1 =+20C, la presiunea p2 = 5 bar. Ecuatia de stare a transformarii este: p (v + 0,1) = C. Viteza aerului la intrarea in compresor, w1, este considerata neglijabila, iar viteza lui la refulare, este w2 = 11 m/s. Sa se determine lucrul mecanic tehnic consumat pentru comprimarea unui kg de aer, considerat gaz perfect .
Intrucat compresorul de aer reprezinta un ST deschis, pentru a calcula lucrul mecanic tehnic consumat de el pentru comprimarea unui kg de aer, vom utiliza PITD, exprimat matematic, pentru un kg de aer, de ecuatia ( ):
![]() , [J/kg].
, [J/kg].
Pentru cazul de fata, aceasta ecuatie sufera urmatoarele particularizari:
caldura schimbata de aer cu ME este neglijabila;
variatia de cota intre sectiunea de intrare si cea de iesire a aerului din compresor este egala cu zero;
 procesul fiind adiabatic, variatia
entalpiei aerului rezulta din integrarea ecuatiei:
procesul fiind adiabatic, variatia
entalpiei aerului rezulta din integrarea ecuatiei:
![]()
In consecinta, PITD ia urmatoarea forma particulara:
Figura E 12.

In aceasta relatie de calcul, toti termenii din dreapta egalului sunt cunoscuti, cu exceptia volumului specific masic de aer, la intrarea in compresor, notat v1.
Pentru determinarea lui, se scrie ecuatia termica de stare
a gazelor perfecte: p1 v1 = R T1 , din care rezulta: ![]() = 0,84 m3/kg.
= 0,84 m3/kg.
Revenind in ecuatia de calcul a lucrului mecanic tehnic, obtinem:
![]() = −112739,5 J/kg = −112,79 kJ/kg.
= −112739,5 J/kg = −112,79 kJ/kg.
Observatie: Potrivit conventiei de semne din termodinamica, semnul minus obtinut pentru lucrul mecanic tehnic semnifica faptul ca, ST consuma lucru mecanic, primit de la ME.
E 13. In camera de dezumidificare a unei
instalatii pentru conditionarea aerului intra un amestec de aer si vapori de
apa, cu debitul masic ![]() =330 kg/h si entalpia specifica h1 = 125
kJ/kg. Vaporii de apa condenseaza la contactul cu apa de racire, apa eliminata
din dezumidificator avand debitul
=330 kg/h si entalpia specifica h1 = 125
kJ/kg. Vaporii de apa condenseaza la contactul cu apa de racire, apa eliminata
din dezumidificator avand debitul ![]() =7 kg/h si entalpia specifica h2 = 40
kJ/kg. Dupa uscare, aerul paraseste camera cu entalpia h3
= 47 kJ/kg. Sa se determine fluxul de caldura schimbat de aer, la
contactul cu apa, in dezumidificator.
=7 kg/h si entalpia specifica h2 = 40
kJ/kg. Dupa uscare, aerul paraseste camera cu entalpia h3
= 47 kJ/kg. Sa se determine fluxul de caldura schimbat de aer, la
contactul cu apa, in dezumidificator.
R e z o l v a r e
Scrisa pentru mai multi curenti de materie care intersecteaza granitele unui ST deschis, ecuatia PITD are urmatoarea forma matematica:
![]() , [J], in care: mi
> 0 pentru curentii de materie care intra in ST si mi < 0 pentru curentii de
materie care ies din ST.
, [J], in care: mi
> 0 pentru curentii de materie care intra in ST si mi < 0 pentru curentii de
materie care ies din ST.
In cazul acestei camere de dezumidificare, aerul nu schimba lucru mecanic cu ME pe parcursul procesului de uscare a sa; in plus, se poate accepta ca suma dintre energia sa cinetica si energia sa potentiala este neglijabila in raport cu entalpia sa. Cu aceste particularizari, PITD capata urmatoarea forma:
![]() , [J].
, [J].
Pentru a determina fluxul de caldura schimbat de aer, la
contactul cu apa, in dezumidificator, trebuie sa impartim aceasta ecuatie
la timp. Obtinem: = Observatie: Potrivit conventiei de semne din
termodinamica, semnul plus obtinut pentru fluxul de
caldura semnifica faptul ca, ST primeste caldura de la ME.![]()
![]() =
= ![]() =7,16kW.
=7,16kW.
Figura E 13.
E 14. O pompa de saramura - cu diametrul conductei de aspiratie d1 = 75 mm -
aspira clorura de calciu, cu densitatea ρ =1,20 kg/m3 si
temperatura t1 = - 8C, la presiunea p1 = 0,97 bar. Dupa pompare,
saramura este refulata la presiunea p2 = 3,1 bar, printr-o
conducta cu diametrul d2 = 50 mm. Axul conductei de refulare
se afla la 1 m deasupra axului conductei de aspiratie. Stiind ca debitul pompei
este ![]() =760 l/min, sa se determine puterea necesara electromotorului
de antrenare a pompei. Se admite ipoteza ca schimbul de caldura intre clorura
de calciu si mediul exterior ei, pe parcursul procesului de pompare, este
neglijabil.
=760 l/min, sa se determine puterea necesara electromotorului
de antrenare a pompei. Se admite ipoteza ca schimbul de caldura intre clorura
de calciu si mediul exterior ei, pe parcursul procesului de pompare, este
neglijabil.
R e z o l v a r e
Intrucat pompa de clorura de calciu reprezinta un ST deschis, pentru a calcula puterea necesara electromotorului de antrenare a pompei, vom utiliza expresia matematica a PITD, data de ecuatia (2.42), pe care o vom imparti la timp. Obtinem:
![]() , [W].
, [W].
In aceasta ecuatie, variatia de entalpie
a clorurii de calciu, se calculeaza cu relatia: h2 - h1
= (u2 - u1) - (p2 v2 - p1
v1) = - (p2 v2 - p1 v1),
Tinand seama de
ipoteza ca schimbul de caldura intre clorura de calciu si mediul exterior ei,
pe parcursul procesului de pompare, este neglijabil, particularizam ecuatia de
mai sus cu: Q12 = 0 si obtinem:
![]() , [W], care, scrisa in functie de debitul volumic, are
urmatoarea forma:
, [W], care, scrisa in functie de debitul volumic, are
urmatoarea forma:![]()

Figura E 14.
in care s-a considerat ca variatia de energie interna este nula, ca urmare a faptului ca temperatura clorurii de calciu ramane constanta, pe parcursul pomparii.
In plus, avand in vedere ca lichidul (clorura de calciu) este incompresibil, v = ct., ceea ce inseamna: v1 = v2 . Putem acum calcula:
![]() h2 - h1
= v1 (p2 - p1)=
h2 - h1
= v1 (p2 - p1)=
![]()
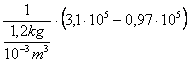 = = 1,775 102
J.
= = 1,775 102
J.
Este nevoie in continuare de valorile vitezelor clorurii de calciu, in sectiunile transversale 1 si 2.
Scriem pentru acest calcul ecuatia de
continuitate: ![]() si o aplicam pe rand,
celor doua sectiuni transversale. Rezulta:
si o aplicam pe rand,
celor doua sectiuni transversale. Rezulta: ![]() si
si ![]() , relatii in care debitul volumic are valoare cunoscuta.
, relatii in care debitul volumic are valoare cunoscuta.
Putem deci calcula: 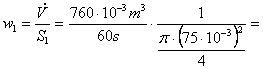 2,867 m/s si
2,867 m/s si
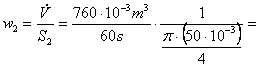 6,451 m/s.
6,451 m/s.
Rezulta: P12
= −![]() =− 3100,919 W = − 3,1 kW
=− 3100,919 W = − 3,1 kW
2.3. Ecuatii calorice de stare si calduri specifice
2.3.1. Ecuatiile calorice ale energiei interne si entalpiei
Aceste ecuatii exprima marimile calorice
de stare - energia interna ![]() , si entalpia
, si entalpia ![]() -, in functie de marimile termice de stare - presiune
-, in functie de marimile termice de stare - presiune ![]() , volumul specific
, volumul specific ![]() si temperatura
si temperatura ![]() . Altfel spus, ecuatiile calorice de stare sunt ecuatii de
calcul ale marimilor
. Altfel spus, ecuatiile calorice de stare sunt ecuatii de
calcul ale marimilor ![]() si
si ![]() , in functie de parametrii termici direct masurabili,
, in functie de parametrii termici direct masurabili, ![]() ,
, ![]() si
si ![]() .
.
Cautam asadar o ecuatie calorica a energiei interne, de forma: u = u(p,v,T) si o ecuatie calorica a entalpiei, de forma: h = h(p,v,T).
Dar, intre parametrii termici de stare ai unui ST, fie el gaz real, vapori, lichid sau solid, exista o relatie de dependenta, de forma: j (p,v,T) = 0, numita ecuatie termica de stare.
De exemplu: intre parametrii termici de
stare ai unui gaz perfect, exista relatia de dependenta, de forma: p v = R T, care se numeste ecuatia termica de stare a gazelor perfecte. Cu
ajutorul acestei ecuatii se poate exprima oricare din cei trei parametri
termici de stare, in functie de ceilalti doi. Astfel: relatia ![]() exprima dependenta v
= v (T, p) s.a.m.d. Pentru substantele
reale insa, adica pentru ST constituite din gaze reale, lichide,sau solide, nu
este posibila stabilirea formei cantitative de dependenta intre parametrii
termici de stare, pe cale analitica. In aceste cazuri, ecuatia termica de stare
este stabilita experimental si este exprimata grafic in diagramele de stare ale
substantelor reale, pure.
exprima dependenta v
= v (T, p) s.a.m.d. Pentru substantele
reale insa, adica pentru ST constituite din gaze reale, lichide,sau solide, nu
este posibila stabilirea formei cantitative de dependenta intre parametrii
termici de stare, pe cale analitica. In aceste cazuri, ecuatia termica de stare
este stabilita experimental si este exprimata grafic in diagramele de stare ale
substantelor reale, pure.
Rezulta asadar, ca energia interna, ![]() , este functie de numai doi parametri de stare si anume, de
volumul specific si de temperatura ST:
, este functie de numai doi parametri de stare si anume, de
volumul specific si de temperatura ST:
![]()
iar entalpia , ![]() , este de asemenea, functie de numai doi parametri de stare
si anume, de presiunea si de temperatura ST:
, este de asemenea, functie de numai doi parametri de stare
si anume, de presiunea si de temperatura ST:
![]() (2.46)
(2.46)
Atat energia interna, cat si entalpia, sunt marimi de stare, ceea ce face ca ele sa admita o diferentiala totala exacta. Prin diferentierea relatiei (2.45) se obtine:
![]() (2.47)
(2.47)
Prin diferentierea relatiei (2.46) se obtine:
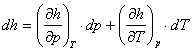 (2.48)
(2.48)
Ne propunem sa analizam urmatorii termeni continuti in aceste ecuatii:
![]() - variatia energiei
interne specifice (masice) a ST cu temperatura, intr-un proces termodinamic
desfasurat la volum constant.
- variatia energiei
interne specifice (masice) a ST cu temperatura, intr-un proces termodinamic
desfasurat la volum constant.
Daca un ST cu m = 1 kg sufera o transformare (incalzire/racire),
corespunzatoare unei variatii elementare de temperatura la volum constant,
atunci, conform relatiei generalizate din calorimetrie, cantitatea elementara
de caldura ![]() este data de relatia:
este data de relatia:
![]() , J/kg (2.49)
, J/kg (2.49)
Inlocuind relatia (2.49) in expresia analitica
a PITD: ![]() , se obtine:
, se obtine:
![]() , pentru
, pentru ![]() (2.50)
(2.50)
Rezulta din (2.50) expresia caldurii specifice la volum constant:
![]() , J/(kg K) (2.51)
, J/(kg K) (2.51)
Revenind in ecuatia (2.47) obtinem: ![]() (2.52)
(2.52)
Aceasta este expresia matematica diferentiala a ecuatiei calorice de stare a energiei interne, pentru un sistem termodinamic oarecare (gaze reale, vapori, lichide, solide).
![]() - variatia entalpiei specifice (masice) a ST cu temperatura,
intr-un proces termodinamic desfasurat la presiune constanta.
- variatia entalpiei specifice (masice) a ST cu temperatura,
intr-un proces termodinamic desfasurat la presiune constanta.
Daca un ST cu m = 1 kg sufera o transformare (incalzire/racire),
corespunzatoare unei variatii elementare de temperatura la presiune constanta,
atunci, conform relatiei generalizate din calorimetrie, cantitatea elementara
de caldura, ![]() , este data de relatia:
, este data de relatia:
![]() , J/kg (2.53)
, J/kg (2.53)
Inlocuind relatia (2.53) in expresia
analitica a PITD: ![]() , se obtine:
, se obtine: ![]() , pentru
, pentru ![]() (2.54)
(2.54)
Rezulta din (2.54) expresia caldurii specifice la presiune constanta:
![]() , J/(kg K) (2.55)
, J/(kg K) (2.55)
Revenind in ecuatia (2.48) obtinem:
![]() (2.56)
(2.56)
Aceasta este expresia diferentiala a ecuatiei calorice de stare a entalpiei pentru un sistem termodinamic oarecare (gaze, vapori, lichide, solide).
2.3.2. Relatii intre caldurile specifice. Relatia Robert Mayer
Odata determinata expresia matematica a ecuatiei calorice de stare pentru
energia interna, acesta poate fi inlocuita in expresia PITD pentru ST inchise (![]() ), care devine:
), care devine:
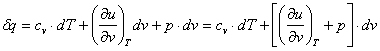 , (2.57)
, (2.57)
Se considera ca ST schimba caldura cu ME intr-un proces desfasurat la
presiune constanta: 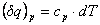 si atunci ecuatia (2.57) devine:
si atunci ecuatia (2.57) devine:
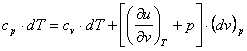 (2.58)
(2.58)
Prin impartirea ambilor membri ai ecuatiei (2.58)
cu variatia elementara de temperatura, ![]() , se obtine:
, se obtine:
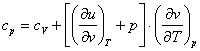 (2.59)
(2.59)
Aceasta este ecuatia Robert Mayer, care exprima relatia dintre caldurile specifice la presiune constanta si la volum constant, pentru un sistem termodinamic oarecare (gaze, vapori, lichide, solide).
Pentru gazele perfecte, ecuatia (2.59) sufera urmatoarele particularizari:
![]() , avand in vedere
ecuatia termica de stare a gazului perfect:
, avand in vedere
ecuatia termica de stare a gazului perfect: ![]() .
.
Tinand seama de acestea, ecuatia lui Robert Mayer ia urmatoarea forma pentru gaze perfecte:
![]() , J/(kg K) (2.60)
, J/(kg K) (2.60)
in care: ![]() este constanta
caracteristica a gazului perfect respectiv. Deoarece
este constanta
caracteristica a gazului perfect respectiv. Deoarece ![]() >
>![]() , rezulta ca intotdeauna
, rezulta ca intotdeauna ![]() >
>![]() .
.
Interpretarea ecuatiei lui Mayer pentru
gaze perfecte este
urmatoarea: pentru a mari temperatura unui kg de gaz perfect cu un grad, la
presiune constanta, este necesara cantitatea de caldura ![]() , din care o parte -
, din care o parte - ![]() - este utilizata la
cresterea energiei interne a gazului, iar restul
- este utilizata la
cresterea energiei interne a gazului, iar restul ![]() este utilizat pentru
efectuarea de lucru mecanic de destindere a gazului. Astfel, constanta
caracteristica a gazului respectiv
este utilizat pentru
efectuarea de lucru mecanic de destindere a gazului. Astfel, constanta
caracteristica a gazului respectiv ![]() , capata semnificatie fizica de lucru mecanic specific (m = 1 kg gaz), efectuat la presiune
constanta si se masoara in J/(kg )K
, capata semnificatie fizica de lucru mecanic specific (m = 1 kg gaz), efectuat la presiune
constanta si se masoara in J/(kg )K
Prin inmultirea fiecarui membru al ecuatiei lui Robert Mayer (2.60) cu masa ²![]() ² a sistemului termodinamic se obtine:
² a sistemului termodinamic se obtine:
![]() , J/K (2.61)
, J/K (2.61)
in care:
- produsul ![]() se numeste capacitate
calorica la presiune constanta si se noteaza
se numeste capacitate
calorica la presiune constanta si se noteaza ![]() ;
;
- produsul ![]() se numeste capacitate
calorica la volum constant si se noteaza
se numeste capacitate
calorica la volum constant si se noteaza ![]() .
.
Relatia (2.61) se poate scrie asadar si sub forma:
![]() , J/K
, J/K
Prin inmultirea fiecarui membru al ecuatiei lui Mayer (2.60) cu masa molara, ![]() kg/kmol , a sistemul termodinamic, se obtine:
kg/kmol , a sistemul termodinamic, se obtine: ![]() , J/(kmol K) (2.63)
, J/(kmol K) (2.63)
in care:
- produsul ![]() se numeste capacitatea
calorica molara la presiune constanta si se noteaza
se numeste capacitatea
calorica molara la presiune constanta si se noteaza ![]()
- produsul ![]() se numeste capacitatea
calorica molara la volum constant si se noteaza
se numeste capacitatea
calorica molara la volum constant si se noteaza ![]() ;
;
- produsul ![]() reprezinta constanta
universala a gazelor perfecte si se noteaza
reprezinta constanta
universala a gazelor perfecte si se noteaza ![]() .
.
In aceste conditii, relatia (2.60) devine:
![]() -
- ![]() =
= ![]() , J/(kmol K) (2.64)
, J/(kmol K) (2.64)
Prin impartirea relatiei (2.60) cu ![]() se obtine:
se obtine:
![]() (2.65)
(2.65)
Pentru gaze perfecte monoatomice, raportul ![]() se poate considera
constant, respectiv independent de temperatura; el se numeste exponent
(coeficient) adiabatic si se noteaza cu
se poate considera
constant, respectiv independent de temperatura; el se numeste exponent
(coeficient) adiabatic si se noteaza cu ![]() .
.
Tinand seama de ![]() , relatia (2.65) devine:
, relatia (2.65) devine:![]()
![]() , J/(kg K)
, J/(kg K)
iar relatia (2.60) devine:
![]() , J/(kg K) (2.67)
, J/(kg K) (2.67)
Pentru gaze monoatomice (gaze nobile, vapori): ![]() ; pentru gaze
biatomice:
; pentru gaze
biatomice: ![]() ; pentru gaze poliatomice (CO2; HCN; C2H2):
; pentru gaze poliatomice (CO2; HCN; C2H2):
![]() .
.
Pentru gazele perfecte, experimentele lui Joule si Gay-Lussac au demonstrat ca energia interna si entalpia depind numai de temperatura, nu si de volum si respectiv presiune.
Dispozitivul
experimental folosit de Joule a constat dintr-un sistem
termodinamic izolat, format din 2 recipienti - A si B, aflati in interiorul
unui vas calorimetric, izolat termic. Acesta reprezinta, pentru cei 2
recipienti, mediul exterior (Figura 2.15).
Recipientii sunt legati intre ei printr-o conducta prevazuta cu robinetul de
inchidere R. Recipientul ![]() , avand volumul
, avand volumul ![]() , contine gaz la presiunea
, contine gaz la presiunea ![]() si temperatura
si temperatura ![]() , iar recipientul
, iar recipientul ![]() avand volumul
avand volumul ![]() , este vidat
, este vidat ![]() . Temperatura apei din calorimetru este masurata cu ajutorul
unui termometru. Dupa ce valoarea indicata de acesta se stabilizeaza, semn ca
sistemul termodinamic a atins o stare de echilibru, se deschide robinetul R. Ca
urmare a faptului ca
. Temperatura apei din calorimetru este masurata cu ajutorul
unui termometru. Dupa ce valoarea indicata de acesta se stabilizeaza, semn ca
sistemul termodinamic a atins o stare de echilibru, se deschide robinetul R. Ca
urmare a faptului ca ![]() >
>![]() , are loc trecerea gazului din recipientul
, are loc trecerea gazului din recipientul ![]() in recipientul
in recipientul ![]() , respectiv destinderea lui in recipientul
, respectiv destinderea lui in recipientul
Se
masoara din nou temperatura apei din calorimetru si se constata ca aceasta
se mentine constanta, ceea ce indica absenta transferului de caldura dintre
gazul Pentru
studiul variatiei energiei interne a gazului se utilizeaza expresia PITD
pentru sisteme inchise:
![]() , pana la egalizarea presiunilor in toate punctele
recipientilor
, pana la egalizarea presiunilor in toate punctele
recipientilor ![]() si
si ![]() si in conducta de legatura.
si in conducta de legatura.![]() si apa din calorimetru, in timpul procesului de
destindere (crestere a volumului ocupat de gaz de la valoarea
si apa din calorimetru, in timpul procesului de
destindere (crestere a volumului ocupat de gaz de la valoarea ![]() , la valoarea
, la valoarea ![]() ).
).![]() (
(
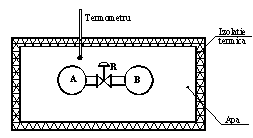
Figura 2.15 Dispozitiv experimental.
Experienta lui Joule
Intrucat pe parcursul
procesului de destindere, gazul nu schimba caldura cu mediul exterior - apa,
rezulta ca: ![]() . Intrucat volumele celor doua rezervoare nu variaza pe
parcursul procesului de destindere a gazului, rezulta ca acesta nu efectueaza
lucru asupra mediului exterior - apa, deci
. Intrucat volumele celor doua rezervoare nu variaza pe
parcursul procesului de destindere a gazului, rezulta ca acesta nu efectueaza
lucru asupra mediului exterior - apa, deci ![]() . Ca urmare, ecuatia (2.68)
devine:
. Ca urmare, ecuatia (2.68)
devine: ![]() .
.
In concluzie procesul de egalizare a presiunilor este caracterizat de mentinerea constanta a energiei interne a gazului, ceea ce se exprima matematic cu ajutorul relatiei:
![]() (2.69)
(2.69)
Interpretarea relatiei (2.69) este aceea ca energia interna a
gazului perfect nu depinde de volumul sau, ci depinde numai de temperatura: ![]() .
.
In mod similar se demonstreaza experimental ca entalpia gazelor perfecte depinde numai de temperaturi, nu si de presiune. Dispozitivul experimental consta dintr-un sistem termodinamic deschis, reprezentat de o conducta parcursa de un gaz, in interiorul careia s-a montat o diafragma (placa prevazuta cu un orificiu central) (Figura 2.16).
Parametrii gazului in
sectiunea transversala (1), aflata in amonte de diafragma, sunt: ![]() ; in sectiunea (2), situata in aval de diafragma, parametrii
de stare ai gazului sunt:
; in sectiunea (2), situata in aval de diafragma, parametrii
de stare ai gazului sunt: ![]() .
.
Pentru studiul variatiei entalpiei gazului perfect intre sectiunile transversale (1) si (2) ale conductei se utilizeaza expresia PITD pentru sisteme deschise:
![]() (2.70)
(2.70)
Datorita
faptului ca circulatia gazului nu are ca efect producerea de lucru mecanic
asupra mediului exterior, rezulta: Presupunand
ca debitul volumic de gaz aflat in circulatie este constant si tinand seama
de faptul ca sectiunea transversala a conductei ramane aceeasi intre (1) si
(2), rezulta ca In aceste conditii, ecuatia (2.70) ia forma particulara: Prin integrarea ecuatiei (2.71) intre
sectiunile transversale (1) si (2) se obtine:
Intrucat la trecerea sa prin conducta, intre sectiunile
(1) si (2), gazul nu schimba caldura cu mediul exterior, rezulta:
![]() . Conducta fiind orizontala:
. Conducta fiind orizontala:![]() .
.![]() .
.![]() (2.71)
(2.71)![]() (2.72)
(2.72)![]() .
.
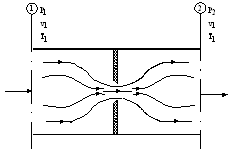
Figura 2.16 Dispozitiv experimental pentru studiul
parametrilor de care depinde entalpia gazului perfect
Interpretarea relatiei (2.72) este aceea ca entalpia gazului perfect nu depinde de presiunea lui, ci
este functie numai de temperatura: ![]() .
.
Ø Ecuatia calorica de stare a energiei interne
Asadar, pentru gazele perfecte,
variatia energiei interne cu volumul: ![]() . Ca urmare, ecuatia calorica de stare a energiei interne,
pentru un sistem termodinamic oarecare (ecuatia 2.52)
capata, pentru gazele perfecte urmatoarea forma particulara:
. Ca urmare, ecuatia calorica de stare a energiei interne,
pentru un sistem termodinamic oarecare (ecuatia 2.52)
capata, pentru gazele perfecte urmatoarea forma particulara: ![]() , (2.73)
, (2.73)
Pentru un sistem termodinamic cu masa ![]() :
: ![]() , J
, J
Prin integrarea ecuatiei (2.73) intr-un
interval de temperaturi ![]() , rezulta variatia finita a energiei interne pentru gaze perfecte
(valabila pentru orice fel de proces - nu numai pentru cele izocore -, pentru
ca energia interna este o marime de stare):
, rezulta variatia finita a energiei interne pentru gaze perfecte
(valabila pentru orice fel de proces - nu numai pentru cele izocore -, pentru
ca energia interna este o marime de stare):
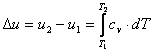 (2.75)
(2.75)
Daca
intervalul de variatie al temperaturii ![]() nu depaseste cateva
sute de grade, atunci se poate utiliza valoarea caldurii specifice medii
nu depaseste cateva
sute de grade, atunci se poate utiliza valoarea caldurii specifice medii ![]() , in intervalul de temperatura
, in intervalul de temperatura ![]() si relatia (2.75) devine:
si relatia (2.75) devine: ![]() , J/kg (2.76)
, J/kg (2.76)
Daca
se accepta in plus ipoteza simplificatoare potrivit careia caldura specifica la
volum constant a gazelor perfecte este constanta ![]() , respectiv independenta de temperatura, atunci relatia (2.75) devine:
, respectiv independenta de temperatura, atunci relatia (2.75) devine: ![]() J/kg (2.77)
J/kg (2.77)
Ø Ecuatia calorica de stare a entalpiei
Intrucat pentru gazele perfecte ![]() , ecuatia calorica de stare a entalpiei, pentru un sistem
termodinamic oarecare (ecuatia 2.56) capata,
pentru gazele perfecte, urmatoarea forma particulara:
, ecuatia calorica de stare a entalpiei, pentru un sistem
termodinamic oarecare (ecuatia 2.56) capata,
pentru gazele perfecte, urmatoarea forma particulara: ![]() , J/kg
, J/kg
Pentru un sistem termodinamic cu masa ![]() , ecuatia calorica de stare (2.78)
are forma:
, ecuatia calorica de stare (2.78)
are forma:
![]() , J (2.79)
, J (2.79)
Prin integrarea ecuatiei (2.79) intr-un
interval de temperaturi ![]() , rezulta variatia finita a entalpiei pentru gazele perfecte
(valabila pentru orice proces, nu numai cel izobar, pentru ca entalpia este o
marime de stare):
, rezulta variatia finita a entalpiei pentru gazele perfecte
(valabila pentru orice proces, nu numai cel izobar, pentru ca entalpia este o
marime de stare):
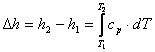 , J/kg
, J/kg
Daca
procesele se desfasoara cu variatia temperaturii intr-un interval restrans,
atunci se poate utiliza valoarea caldurii specifice medii, ![]() , in intervalul de temperatura
, in intervalul de temperatura ![]() si relatia (2.80) devine:
si relatia (2.80) devine: ![]() , J/kg
, J/kg
![]() , J/kg (2.82)
, J/kg (2.82)
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2316
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved