| CATEGORII DOCUMENTE |
| Aeronautica | Comunicatii | Electronica electricitate | Merceologie | Tehnica mecanica |
TERMODINAMICA TEHNICA
NOTIUNI GENERALE
1.1 Introducere
Termodinamica este unul dintre capitolele fundamentale ale fizicii clasice care are drept obiect de studiu: forma termica de miscare a materiei in cadrul sistemelor si intre diferite sisteme fizice; transformarile diferitelor forme de energie in si din caldura si proprietatile substantelor care participa la aceste transformari; starile de echilibru energetic si termic ale sistemelor fizice si procesele care conduc la stabilirea starilor de echilibru.
Termodinamica studiaza fenomenele pe baza cunoasterii proprietatilor macroscopice ale corpurilor pe baze experimentale. Ea realizeaza o descriere completa a fenomenelor temice, iar marimile si principiile ei au fost obtinute pe cale experimentala.
Metodele termodinamicii nu au la baza nici un model de reprezentare atomo-moleculara a substantei, si din acest motiv, termodinamica este o stiinta metodologica.
Termotehnica sau termodinamica tehnica se ocupa de aplicatiile termodinamicii in tehnica, avand ca obiect de studiu transformarile de energie sub forma de caldura si lucru mecanic precum si aplicarea metodelor generale de analiza termodinamica in studiul masinilor si instalatiilor termice. In consecinta, termotehnica se ocupa cu producerea, transportul, transformarile si utilizarea caldurii in tehnica.
Termotehnica este in stransa legatura cu alte stiinte sau domenii de studiu ale caror notiuni le utilizeaza sau in cadrul carora isi gaseste aplicabilitate (figura 1.1):
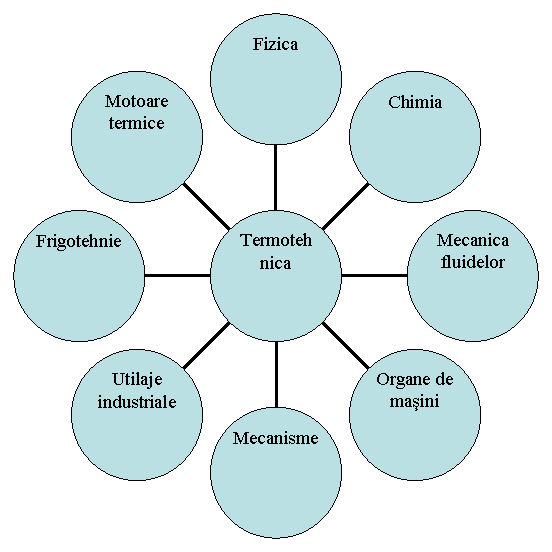
Fig. 1.1 Stiinte si domenii conexe
Prin analiza termodinamica a proceselor care au loc in masinile termice se pot stabili cai si metode pentru imbunatatirea randamentului masinilor producatoare de energie mecanica: masini cu aburi, motoare cu ardere interna, turbine, instalatii nucleare, etc., precum si pentru imbunatatirea eficientei consumatorilor de energie: pompe de caldura, instalatii de climatizare, instalatii frigorifice, compresoare, cuptoare electrice, etc.
SCURT ISTORIC
Preocupari privind urmarirea si interpretarea fenomenelor termice, in vederea utilizarii combinate a potentialului energetic al focului, apei si aerului, au existat inca din antichitate, dar incepand cu epoca renasterii ele au devenit obiect de studiu.
Dezvoltarea cercetarilor si aparitia termotehnicii ca obiect de studiu de sine statator s-a realizat pe doua directii.
Din punct de vedere teoretic, s-a urmarit o definire si descriere completa a fenomenelor termice ca o consecinta a cercetarilor experimentale efectuate.
Astfel, inca din secolul XVII au existat preocupari privind stabilirea relatiilor care exisa intre diferitele marimi de stare termic. In aceasta perioada, Boylle enunta teoretic si Mariotte confirma experimental legea transformarii izoterme. Aceasta activitate a fost continuata in secolul XIX de catre alti cercetatori care au stabilit si enuntat legile care le poarta numele (Charles - legea transformarii izocore, Gay-Lussac - legea transformarii izobare, Joule, Toricelli, etc.).
Sunt de remarcat in aceasta perioada experimentele efectuate de catre Lomonosov, Davy si Rumford, care au vizat transformarile diferitelor forme de energie.
In secolul XIX, cunoscut ca secolul revolutiei tehnice s-a dezvoltat si fundamentat termotehnica ca stiinta. Necesitatea obtinerii de energie mecanice pe seama caldurii, extinderea constructiei masinilor cu abur, cerinta fabricarii unor masini termice de puteri si turatii superioare, avand un randament ridicat de transformare a energiei calorice in lucru mecanic util, au condus la rezolvarea unor probleme teoretice fundamentale privind desfasurarea proceselor termice.
Astfel, in anul 1824, inginerul francez Sadi Nicolas Carnot a evidentiat ideea echivalentei dintre caldura si lucru mecanic ca forma de transmitere a energiei. Pe baza observatiilor lui Carnot, naturalistul Julius Robert Mayer a enuntat in anul 1842 principiul general al transformarii si conservarii energiei, cunoscut in prezent sub denumirea de principiul intai al termodinamicii. Concluziile teoretice ale lui Mayer au fost confirmate de experientele riguroase efectuate de catre James Prescott Joule, H. Lenz, H. Helmholtz si romanul Constantin Miculescu.
Acesta din urma si-a sustinut la Paris teza de doctorat cu titlul "Masurarea echivalentului mecanic al caldurii", obtinand rezultate foarte apropiate de cele obtinute de Joule. Tot Robert Mayer a introdus notiunea de echivalent mecanic al unitatii de caldura.
Tot in aceasta perioada au fost stabilite, enuntate teoretic si fundamentate matematic principiile termodinamicii. Astfel, Maxwell enunta principiul zero al termodinamicii
Helmholtz a determinat experimental principiul I al termodinamicii (principiul conservarii energiei termice), care a fost anterior fundamentat teoretic de Clausius. De remarcat faptul ca, dupa refuzul Academiei Franceze (1775) de a mai primi proiecte de perpetuum mobile de speta I, s-a renuntat la aceasta aberatie.
Clausius a formulat principiul II al termodinamicii si a introdus entropia ca unitate de masura a sensului transformarilor termice.William Thomson (Lord Kelvin) a stabilit imposibilitatea construirii unui perpetuum mobile de speta II.
Nernst a formulat principiul III al termodinamicii prin care arata egalitatea lucrului mecanic reversibil si a entalpiei de reactie in apropierea punctului de zero absolut, precum si imposibilitatea atingerii pe cale experimentala a temperaturii de zero absolut.
In anul 1834 Clapeyron stabileste ecuatia de stare temica a gazelor ideale, iar Joule stabileste dependenta energiei interne a gazelor ideale fata de parametrii de stare termica, prin legea care ii poarta numele.
Prin aplicarea la gaze a teoriei cinetice a caldurii enuntata de Clausius, J. M. Maxwell, M. Plank si L. Boltzmann au pus bazele termodinamicii statistice (microscopice).
Datorita dezvoltarii si perfectionarii masinilor termice, au existat preocupari continue pentru studierea comportarii gazelor reale. Asfel, in anul 1879, Amagat a studiat abaterile comportarii gazelor reale de la legile gazelor ideale.
De-a lungul timpului au fost formulate peste 150 de ecuatii caracteristice ale gazelor reale, dintre care cele mai importante apartin lui Van der Waals; Berthelot; Beatie si Bridgeman.
O alta sfera de preocupare a constituit-o determinarea unor modalitati de determinare a valorilor parametrilor de stare termica.
Primele scari empirice de temperatura au fost introduse in secolu XVIII de catre Celsius, respectiv Fahrenheit. Ulterior, in anul 1848, William Thomson (Lord Kelvin) a introdus o scara de temperatura care nu depinde de natura corpurilor (scara Kelvin).
Pentru a se putea masura si temperaturi inalte, in anul 1968 s-a introdus scara internationala practica de temperatura (S.I.P.T.-68).
Se poate afirma ca in secolul al XIX-lea, prin contributia unor ingineri, medici, fizicieni si chimisti de prestigiu, care au fructificat rezultatele cercetarilor experimentale vizand modul de transformare reciproca a celor doua forme de energie - caldura si lucrul mecanic - s-au pus bazele termodinamicii. Acest lucru a fost posibil si datorita dezvoltarii aparatului matematic care a facut posibila perfectionarea metodelor termodinamicii si definirea sa ca stiinta a sistemelor fizice macroscopice masurabile. Extinderea legilor termodinamicii la alte domenii a permis dezvoltarea altor stiinte: chimia, biologia, ecologia, astrofizica, tehnica spatiala.
Din punct de vedere al realizarilor practice, in secolul XVIII au aparut si s-au perfectionat masinile cu aburi. Prima masina cu abur a fost realizata in anul 1705 de catre Thomas Newcomen.
In anul 1770 Cugnot construieste primul autovehicul autopropulsat. Ulterior au construit masini propulsate cu motoare cu abur C. Huygens, D. Popin, I. Polzunov, V. Borodino, si James Witt, ultimul realizand in anul 1784 o masina cu abur cu sertaras de distributie, volant si regulator

Fig. 1.2 Masina Cugnot cu abur
Dezvolta o viteza de 56 km/h. Nu avea frane. Utilizat ca tractor de artilerie

Fig. 1.3 Masina Borodino cu abur
Consum 30 kg. carbune/ora. Atingea 8 km/h pe drum plan
Punerea bazelor termodinamicii, precum si dezvoltarea si diversificarea industriei, au impus construirea de masini termice de puteri mici si mijlocii, cu gabarite mai reduse si economicitate mai mare decat cele cu abur. Prima incercare de a proiecta un motor cu ardere interna ii apartine luiPhillipe Lebon care in anul 1801 a solicitat brevet pentru proiectul unui motor bazat pe principiul exploziei unui gaz inflamabil, iar in anul 1807 Francois Isaak a proictat, fara a-l realiza, un motor care foloesa ca si carburant un amestec de oxigen si hidrogen. .
Cercetarile in acest sens au continuat, conducand la aparitia motorului cu ardere interna cu piston, realizat prima oara de E. Lenoir in anul 1860 (figura 1.4). Motorul conceput de acesta era un motor cu ardere interna cu electroaprindere, functionand cu un amestec de petrol lampant si aer. In vederea obtinerii unui randament superior, acest motor a fost perfectionat de o serie de inventatori dinre care remarcam:
Fig. 1.4 Masina cu motor Lenoir
- in anul 1864 Otto construieste un motor in 4 timpi cu ardere interna (brevetat in 1876);
- tot in anul 1864, australianul Siegfried Marcus a construit un motor monocilindru cu un carburator rudimentar;
- in anul 1873, americanul George Brayton a incercat, fara succes, sa construiasca un motor care sa functioneze cu xeroxen, cu formarea amestecului in afara cilindrilor;
- in anul 1885 Gottlieb Daimler a inventat si brevetat un motor cu cilindri verticali, cu gazolina pulverizata prin injectare in carburator;
- 1886 -Karl Benz breveteaza un motor cu amestec aer-combustibil;

Fig. 1.5 Masina echipata cu motor Benz (1886)
- 1889 - Daimler foloseste supape cu taler in forma de ciuperca la un motor in 4 timpi cu cilindri in V;
- 1890 - Wilhelm Maybach a construit primul motor cu 4 cilindri in 4 timpi;
- 1891 - Rene Panhard si Emile Levassor construiesc primul autovehicul cu motor frontal;
- in 1898 Opel construieste primul motor racit cu aer;
- in 1910 Henri Coanda construieste primul motor cu reactie din lume;

Fig. 1.6 Avion echipat cu motor cu reactie
- in 1931 este construit un motor cu cilindri in V montat pe un automobil Cadillac;
- in 1951 este brevetat primul motor rotativ Wankel;

Fig. 1.7 Motor Wankel

Fig. 1.8 Motor Wankel sectionat
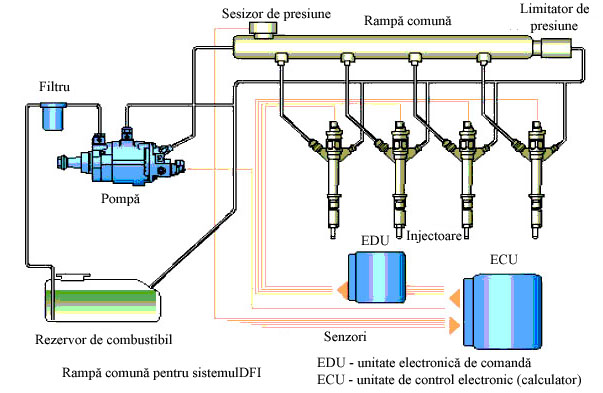
In a doua jumatate a secolului XX apar si sunt utilizate pe scara tot mai larga motoarele supraalimentate, precum si motoarele cu injectie de benzina.

Fig. 1.9 Turbosuflanta
Fig. 1.10 Sistem de alimentare cu injectie de benzina COMMON RAIL
La sfarsitul secolului XIX, in conditiile unei remarcabile dezvoltari industriale, apare necesitatea creerii unor masini termice deosebite, cu puteri si turatii ridicate. Problema a fost rezolvata de inginerul suedez Gustav Patrik de Laval care in anul 1889 a inventat turbina cu abur cu actiune, urmata de construirea de catre A. Parsons a turbinei cu abur cu reactiune. Ulterior, in anul 1897 s-a realizat prima turbina cu gaze, care va fi utilizata cu succes pentru echiparea vehiculelor de transport aerian, naval si rutier.

Fig. 1.11 Turbina cu abur Laval
1.2 NOTIUNI FUNDAMENTALE
1.2.1 Sisteme de unitati de masura
In sistemul international de unitati de masura (S.I.) adoptat la cea de-a X-a Conferinta generala de masuri si greutati din anul 1954 se prevede ca unitate de masura fundamentala specifica termodinamicii temperatura termodinamica q masurata in grade Kelvin [K]. Aceasta reprezinta unitatea de masura din scara termodinamica in care pentru punctul triplu al apei (punctul de congelare) s-a atribuit valoarea de 273,15.
1.2.2 Sisteme termodinamice. Parametri de stare. Ecuatia caracteristica de stare
Sistemul reprezinta un ansamblu de elemente aflate in interdependenta, constituite intr-un intreg organizat.
Prin sistem termodinamic se intelege un domeniu finit din spatiu, bine precizat, compus din mai multe corpuri cu proprietati diferite care se gasesc in interactiune mecanica si termica atat intre ele, cat si cu mediul inconjurator. Daca sistemul termodinamic cuprinde si ansamblul corpurilor din mediul ambiant, atunci rezulta un sistem termodinamic largit.
Dimensiunile spatiale si existenta in timp ale sistemelor termodinamice permit efectuarea unor procese normale de masurare.
Mediul ambiant (mediul inconjurator) reprezinta totalitatea corpurilor care nu apartin sistemului termodinamic.
Interactiunile unui sistem cu mediul ambiant se manifesta prin schimburi de energie si de substanta. Dupa natura acestei interactiuni sistemele pot fi clasificate ca in figura 1.12.
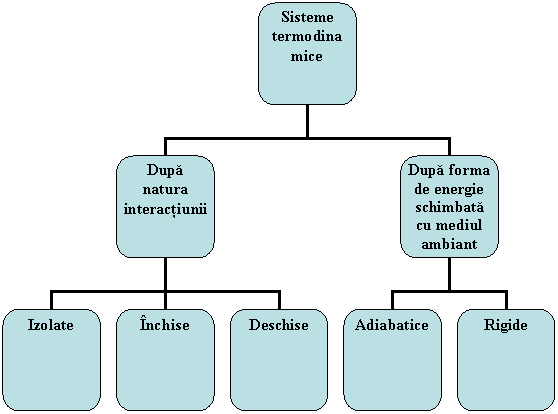
Fig. 1.12 Tipuri de sisteme termodinamice
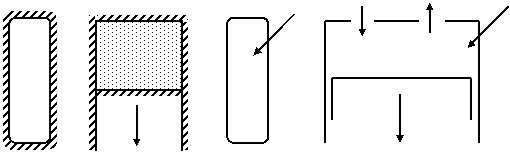
a) Sistemele termodinamice izolate care sunt sistemele precis delimitate, care nu schimba cu mediul ambiant nici substanta si nici energie sub forma de lucru mecanic sau caldura, cum ar fi de exemplu un recipient inchis, perfect izolat termic (fig. 1.13a);
b) Sistemele termodinamice inchise reprezinta sistemele care schimba cu mediul exterior numai energie.
c) Sisteme termodinamice deschise sunt sistemele care pot schimba cu mediul exterior atat caldura cat si lucru mecanic, de exemplu camera de ardere de la motoarele cu ardere interna cu piston (figura 1.13d);
Dupa forma de energie schimbata cu mediul exterior ele pot fi:
a) Sistemele termodinamice adiabatice sunt sisteme perfect izolate termic, asfel incat nu are loc schimb de energie sub forma de caldura, dar in raport cu mediul ambiant sistemul poate efectua lucru mecanic. De exemplu un cilindru de lucru perfect izolat termic, in interiorul caruia se destinde un gaz care actioneaza un piston (figura 1.13b);
Q
Q
Q
L L
a. b. c. d.
Fig. 1.1 Sisteme termodinamice
a - izolat; b - adiabatic; c - rigid; d - deschis
b) Sistemele termodinamice rigide care au cu mediul exterior schimb de energie sub forma de caldura, dar nu si de lucru mecanic cum ar fi cazul unui recipient inchis, prin peretii caruia se executa transfer de caldura (figura 1.13c);
Analiza termodinamica are ca obiect de studiu sistemul simplu, care nu este influentat de efectele miscarii si ale campurilor de forte exterioare (gravitational, electric, magnetic). Schimburile energetice care pot surveni ca urmare a acestor efecte nu se manifesta sau sunt neglijabile.
Prin starea unui sistem se intelege totalitatea proprietatilor masurabile, independente de forma exterioara a acelui sistem. Starea energetica a unui sistem termodinamic este determinata, prin natura, masa si energia corpurilor componente, de conditiile sale interioare si exterioare. Daca modificarea conditiilor interioare ale unui sistem termodinamic nu presupune neaparat o schimbare a conditiilor sale exterioare, variatia conditiilor exterioare ale sistemului termodinamic este insotita intotdeauna de modificarea conditiilor lui interioare.
Un sistem se gaseste in stare de echilibru termodinamic atunci cand, aflandu-se in conditii exterioare invariabile, conditiile lui interioare nu sufera modificari, ci se mentin constante in timp. Starea de echilibru termodinamic se caracterizeaza deci prin repartizarea uniforma a densitatii, temperaturii si presiunii in toate punctele sistemului.
Un sistem izolat ajunge intotdeauna dupa un interval de timp in stare de echilibru termodinamic si nu poate iesi de la sine din aceasta stare.
Echilibrul termodinamic implica echilibrul mecanic, termic si chimic. In cazul starii de echilibru termodinamic nu exista nici un fel de schimbari la scara macroscopica in interiorul sistemului sau la granitele sale.
Starea de echilibru termodinamic este o stare ideala, deoarece presupune ca parametrii macroscopici care caracterizeaza starea sistemului au valori riguros constante atat in timp cat si in cadrul sistemului. In realitate, valorile acestor parametri nu sunt constante, ci efectueaza anumite oscilatii, numite fluctuatii, in jurul valorii medii.
Marimile macroscopice care exprima proprietatile unui sistem se numesc parametri sau marimi de stare si determina starea sistemului. Marimile de stare reiau aceeasi valoare, ori de cate ori sistemul revine in aceeasi stare, independent de starile intermediare prin care a trecut sistemul, fiind deci functii de stare.
Parametrii de stare reprezinta valorile instantanee ale marimilor fizice ce caracterizeaza atat sistemul considerat, cat si interactiunea dintre sisteme si mediul inconjurator.
Descrierea unui sistem termodinamic cu ajutorul marimilor de stare este posibila numai in cazul in care marimile de stare nu se modifica in timp, daca asupra sistemului nu se exercita influente exterioare.
Parametrii de stare pot fi clasificati ca in figura 1.14:
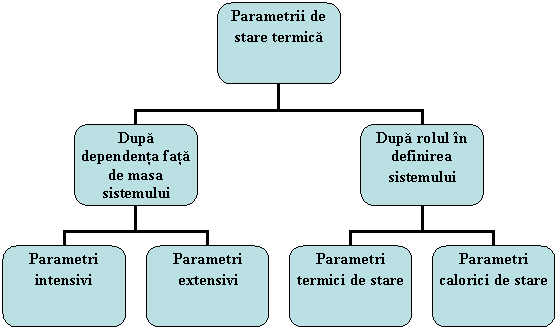
Fig. 1.14 Clasificarea parametrilor de stare
parametrii intensivi - sunt marimile de stare ale caror valori nu depind de masa sistemului: presiunea, temperatura, densitatea, concentratia.
parametrii extensivi - sunt parametrii care depind de masa sistemului. De exemplu volumul si energia care sunt proportionale cu masa sistemului.
Parametrii
intensivi care rezulta prin impartirea parametrilor extensivi la
masa se numesc parametri specifici.
De exemplu: volumul specific ![]() ; energia specifica
; energia specifica ![]() ; entalpia specifica
; entalpia specifica ![]() , etc. Prin conventie, parametrii
extensivi se noteaza cu majuscule (V, E, U, I), in timp ce parametrii
intensivi se noteaza cu litere mici (p, r, v, e). Exceptie de la aceasta regula face
temperatura, care se noteaza cu majuscula T.
, etc. Prin conventie, parametrii
extensivi se noteaza cu majuscule (V, E, U, I), in timp ce parametrii
intensivi se noteaza cu litere mici (p, r, v, e). Exceptie de la aceasta regula face
temperatura, care se noteaza cu majuscula T.
- parametri termici de stare - sunt parametrii care definesc sistemul din punct de vedere termic: presiunea, temperatura si volumul;
- parametri calorici de stare - parametri care variaza prin intermediul schimbului de energie sub forma de caldura: energia interna, entalpia, entropia.
Experimental s-a demonstrat ca intre marimile de stare exista o interdependenta care permite determinarea unei stari de echilibru termodinamic chiar in conditiile in care nu cunoastem valorile tuturor parametrilor de stare. Numarul minim de parametri necesari pentru definirea unei stari de echilibru termodinamic este precizat in urmatorul postulatul de stare:
"Daca se iau in considerare numai actiunile mecanice si termice dintre corpuri, starea de echilibru termodinamic a unui sistem omogen cu n componenti poate fi precizata in mod univoc prin valorile a n + 2 parametri, care pot fi cantitatile celor n corpuri, presiunea si volumul sistemului."
In aceste conditii, starea termodinamica a unui sistem omogen si izotrop este precizata daca se cunoaste masa m a sistemului, presiunea p a lui si volumul V pe care acesta il ocupa; temperatura T a sistemului sau oricare alta marime de stare, se poate exprima printr-o functie de acesti parametri:
f(m,p,V,T) = 0 (1.1)
care reprezinta ecuatia caracteristica de stare si arata interdependenta dintre masa si marimile de stare ale sistemului.
Ecuatia caracteristica exprimata pentru masa unitara a sistemului rezulta din introducerea in relatia (1.1) a volumului specific "v" [m3/Kg]:
f(p,v,T) = 0 (1.2)
care, explicitand una din variabile ca o functie de celelalte doua, se poate scrie sub formele:
v = v(p,T) (1.3)
p = p(v,T) (1.4)
T = T(v,p) (1.5)
Din faptul ca v, p, T sunt marimi de stare rezulta ca din punct de vedere matematic admit o diferentiala totala:
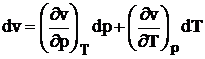
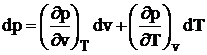
Prin egalarea coeficientilor celor doua diferentiale obtinem:
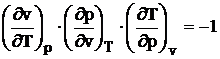 (1.7)
(1.7)
Aceasta relatie reprezinta ecuatia termica de stare sub forma diferentiala. Ea permite obtinerea unor legaturi intre marimile fizice importante, dinpunct de vedere experimental, fara a cunoaste forma explicita a ecuatiei de stare. Este singura ecuatie termica de stare, valabila pentru toate starile de agregare, obtinuta pe cale teoretica, insa deoarece derivatele partiale sunt functii complexe de presiune si temperatura care variaza pentru fiecare corp, nu poate fi folosita in calculele practice. Utilitatea ei practica consta in faptul ca derivatele partiale reprezinta coeficientii termodinamici ai corpurilor, dupa cum urmeaza:
a) In cazul proceselor izobare (care se desfasoara la presiune constanta), din relatia (1.6):
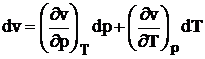
se obtine:
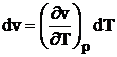 (1.8)
(1.8)
Introducem notiunea de coeficient de dilatare volumica a corpului la temperatura T, in conditiile in care presiunea ramane constanta a si raportam aceasta variatie de volum la volumul initial al corpului. Obtinem relatia:
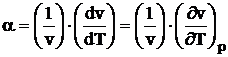 [K-1] (1.9)
[K-1] (1.9)
La o crestere finita DT, rezulta o variatie de volum Dv si relatia (1.9) devine:
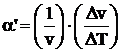 (1.10)
(1.10)
relatie in care a' reprezinta coeficientul mediu de dilatare volumica a corpului la presiune constanta, intre temperaturile T si T + DT.
b) Similar, in cazul incalzirii izocore (la volum constant), din relatia (1.6), introducand coeficientul b, care este coeficientul real de crestere de presiune la temperatura T, cand volumul ramane constant, (coeficient de elasticitate termica) se obtine:
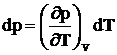 (1.11)
(1.11)
din a carei raportare la presiunea initiala rezulta:
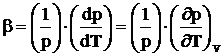 (1.12)
(1.12)
c) In cazul incalzirii la temperatura constanta, presiunea creste cu dp si volumul scade cu dv.
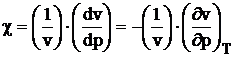
relatie in care c
reprezinta modulul de compresibilitate termica la presiunea p cand
temperatura T ramane constanta. Semnul (-) apare deoarece ![]() v si
v si ![]() p au semne contrare.
p au semne contrare.
Inlocuind in relatia (1.7) obtinem:
a = b c p (1.14)
relatia de interdependenta a coeficientilor termodinamici. Aceasta relatie serveste de regula pentru calculul coeficientului de elasticitate termica b care nu poate fi determinat cu precizie pe cale experimentala decat numai pentru gaze.
In
cazul gazelor reale, la presiuni mici, s-a demonstrat experimental ca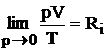 unde Ri este constanta gazului ideal si ecuatia de
stare devine:
unde Ri este constanta gazului ideal si ecuatia de
stare devine:
![]() (1.15)
(1.15)
Din analiza ecuatiei caracteristice f(p,v,T) = 0 se observa ca un sistem poate avea o infinitate de stari de echilibru. Pentru a se putea evalua diferitele stari de echilibru ale unui sistem s-au adoptat starile de referinta.
Prin stare de referinta a unui sistem intelegem starea in raport cu care se pot evalua celelalte stari ale sistemului. Cele mai utilizate stari de referinta sunt prezentate in figura 1.15:
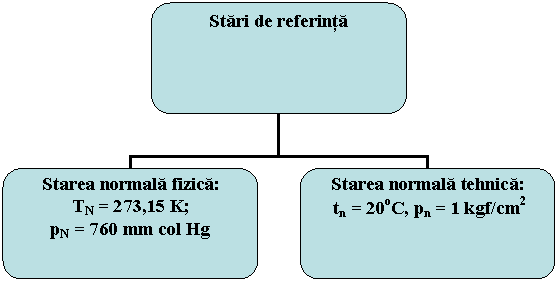
Fig. 1.15 Starile de referinta in termotehnica
1.2.3 Proces termodinamic
Procesul termodinamic reprezinta modificarea starii unui sistem prin modificarea in timp a parametrilor acestuia, ca urmare a unei interventii exterioare.
Procesele termodinamice pot fi clasificate ca in figura 1.16:
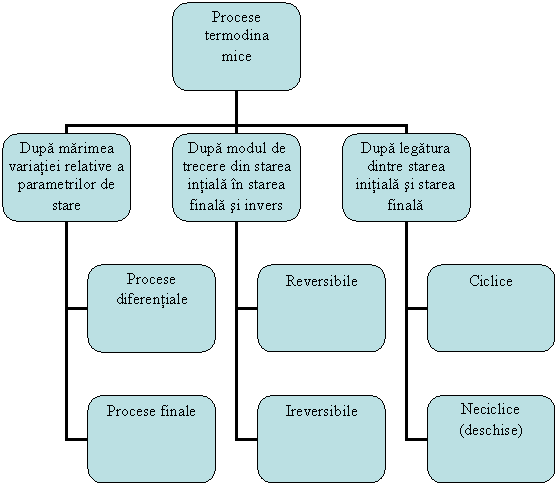
Fig. 1.16 Tipuri de procese termodinamice
Procesele diferentiale sunt procesele pentru care variatia relativa a parametrilor de stare este foarte mica.
Procesele finale sunt procesele in care cel putin un parametru de stare sufra o variatie relative mare.
Procesul termodinamic reversibil este procesul in cursul caruia un sistem termodinamic poate fi readus in starea initiala fara a aparea schimbari remanente in sistem sau in mediul exterior. Procesul reversibil consta dintr-o succesiune de stari de echilibru si este un proces ideal, care se desfasoara fara pierderi energetice. In termodinamica aceste procese servesc drept criterii de comparatie pentru aprecierea gradului de perfectiune al unei masini sau instalatii termice in care procesele reale care se desfasoara sunt ireversibile.
Procesul termodinamic ireversibil este procesul prin care un sistem nu poate reveni la starea initiala fara a apare schimbari remanente in sistem sau in mediul exterior. Procesele ireversibile evolueaza de la sine intr-un singur sens. Procesele reale din natura sunt ireversibile, deoarece se desfasoara cu pierderi energetice sub forma de caldura din cauza frecarilor.
Procesele ciclice sunt procesele in cadrul carora starea finala coincide cu starea initiala;
Procesele neciclice (deschise)se caracterizeaza prin faptul ca starea finala nu coincide cu starea initiala.
Un sistem termodinamic scos din starea de echilibru, revine la starea initiala dupa un timp numit timp de relaxare. Exisa un timp de relaxare specific pentru fiecare parametru de stare.
Timpul de relaxare pentru sistemul termodinamic este dat de timpul de relaxare cel mai mare.
Daca intr-un sistem termodinamic, procesele au loc cu viteze mai mici decat viteza de relaxare in orice etapa a procesului, parametrii de stare au valori care corespund starii respective de echilibru si procesul este cvasistatic.
Trecerea unui sistem termodinamic dintr-o stare de echilibru, in alta stare de echilibru prin parcurgerea unei succesiuni de stari, caracterizate prin valori precise ale marimilor de stare, reprezinta transformarea de stare termodinamica.
Sistemul sau corpul care parcurge o transformare termodinamica de stare este denumit agent termic, agent evolutiv sau agent de lucru.
Transformarile de stare termodinamice sunt de doua tipuri (figura 1.17):
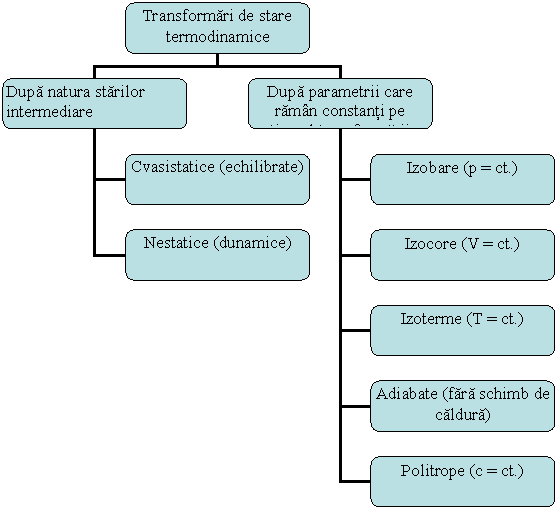
Fig. 1.17 Transformarile termodinamice
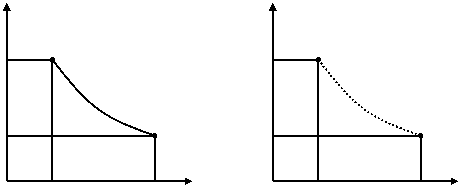
Transformarile termodinamice cvasistatice sunt transformari de stare provocate de variatii elementare ale mediului exterior in cursul carora sistemul trece prin stari intermediare avand abateri infinit de mici de la echilibrul termodinamic. Aceste transformari reprezentate prin diagrama continua p-v din figura 1.2a au o viteza de desfasurare infinit mica, ca urmare a variatiilor infinit mici ale parametrilor de stare.
Transformarile termodinamice nestatice sunt transformarile in care starile parcurse de sistem nu sunt stari de echilibru, presiunea, volumul si temperatura avand valori diferite in diferitele puncte ale sistemului. Reprezentarea acestor transformari se face numai prin punctele extreme (initial si final), singurele in care marimile se gasesc in echilibru. Punctele intermediare, in care nefiind realizat echilibrul termodinamic in sistem nu pot fi precizate valorile marimilor de stare, sunt marcate in diagrama prin linia punctata care reprezinta punctele intermediare incerte, in care valorile parametrilor din diagrama nu mai caracterizeaza starea intregului sistem in momentul respectiv (figura 1.2b).
 P P
P P
![]() 1 1
1 1
![]() P1 P1
P1 P1
P2 2 P2 2
v1 v2 v v1 v2 v
a. b.
Fig. 1.18 Reprezentarea in coordonate p-v a transformarilor cvasistatice (a) si nestatice (b)
1.2.4 Postulatele termodinamicii
Studiul termodinamicii se bazeaza pe doua postulate.
Postulatul I Un sistem izolat ajunge intotdeauna, dupa un interval de timp, in stare de echilibru termodinamic intern si nu poate iesi niciodata de la sine din aceasta stare.
Aceasta presupune ca intre corpurile din cadrul sistemului termodinamic izolat are loc un schimb de energie pana cand se ajunge la o stare de echilibru.
Deoarece termodinamica se ocupa numai de sisteme aflate in stare de echilibru intern, postulatul I sta la baza tuturor legilor si aplicatiilor termodinamicii.
Postulatul II Sistemele termodinamice, care desi aflate in contact, nu schimba caldura intre ele, sunt in echilibru termic.
Acest postulat este cunoscut sub denumirea de postulatul tranzitivitatii echilibrului termic.
Sistemele aflate in echilibru termic, trebuie sa fie caracterizate de un parametru intern de stare, care va trebui sa aiba aceeasi valoare pentru toate sistemele termodinamice aflate in echilibru. Acest parametru intern a fost denumit temperatura empirica t.
1.2.5 Temperatura. Principiul zero al termodinamicii
Temperatura este parametrul ce caracterizeaza starea interna a sistemului, cel care arata daca el este in echilibru termic cu un alt sistem. Alaturi de presiune si volum, temperatura face parte din parametrii fundamentali sau parametrii termici de stare.
Experimental J. Maxwell in 1891 a extins posibilitatea realizarii echilibrului termic intre mai mult de doua sisteme, enuntand principiul zero al termodinamicii astfel:
"Doua sisteme aflate in echilibru termic cu un al treilea simultan sau succesiv, se afla in echilibru termic si intre ele".
Acest principiu sta la baza metodelor de masurare a temperaturii.
Masurarea temperaturii se face pe cale indirecta cu ajutorul termometrelor aduse in stare de echilibru termic prin contact direct cu sistemul termodinamic si care au o proprietate care se modifica in mod univoc cu temperatura si poate fi masurata usor si precis. Aceasta proprietate (fenomen termic) poate fi: dilatarea unui corp, variatia presiunii unui gaz, variatia rezistentei electrice a unui conductor, fenomenul termoelectric, etc.
Pentru masurarea temperaturilor se folosesc scari empirice de temperatura. Acestea se stabilesc cu ajutorul termometrelor, daca fiecare valoare a proprietatii alese pentru termometre este corelata cu o anumita valoare a temperaturii. Se poate deci alege arbitrar punctul de zero si marimea diviziunilor in care se imparte intervalul dintre doua temperaturi bine determinate, usor si sigur reproductibile. Scarile empirice de temperatura prezinta dezavantajul ca nu coincid intre ele in intervalul dintre punctele de etalonare.
Cea mai cunoscuta scara empirica de temperatura, scara centisimala, a fost propusa de Celsius in secolul XVIII si este utilizata si in prezent tolerata in S.I. Aceasta scara are ca punct zero, punctul de inghetare a apei la presiunea de 760 torr, iar ca punct de 100o C, punctul de fierbere a apei la aceeasi presiune. Variatia de temperatura in aceasta scara, gradul centisimal sau Celsius, se obtine impartind in 100 de parti egale alungirea prin dilatare corespunzatoare intervalului de temperatura 0 -100o C.
O alta scara empirica de temperatura, folosita mai ales in tarile anglo-saxone, este scara Fahrenheit, la care pentru aceleasi puncte fixe adoptate la scara Celsius corespund valorile de 32o F, respectiv 212o F.
Pentru a putea compara temperaturile determinate cu diferite termometre trebuie sa existe o scara termometrica perfect definita, independenta de proprietatile aleatoare ale unui corp termometric.
Intrucat coeficientul de dilatare a tuturor gazelor tinde catre aceeasi valoare constanta daca presiunea gazului tinde catre zero, s-a ales drept fluid termometric al termometrului de referinta un gaz ideal. In aceste conditii W.Thomson (Lord Kelvin) a propus in anul 1848 o scara absoluta de temperatura (scara Kelvin) ale caror valori absolute se mentin mereu aceleasi, indiferent pe ce baza se determina ele. Valoarea conventionala a lui zero absolut 0K = - 273,15o C corespunde punctului la care agitatia moleculara a gazului perfect ar trebui sa inceteze. Principiile II si III ale termodinamicii arata ca in scara absoluta a temperaturilor nu pot exista temperaturi negative, adica punctul de zero absolut reprezinta cea mai scazuta temperatura imaginabila, punct care de altfel nu poate fi atins prin transformari termodinamice.
Dificultatile tehnice mari intampinate la masurarea temperaturilor inalte (peste 1000oC) cu termometrele cu gaz, precum si constructia destul de complicata a acestora, au impus utilizarea unei scari de temperatura mai accesibila denumita scara internationala practica de temperatura (SIPT - 68).
Aceasta scara nu are scopul de a inlocui scara gazului ideal, ci de a se apropia cat mai mult de aceasta. In acest sens s-au stabilit o serie de puncte fixe usor de reprodus, indicandu-se temperaturile atribuite acestor puncte (Anexa nr. 2) si s-au fixat procedee relativ simple de masurare a temperaturii in intervalul dintre aceste puncte fixe cu ajutorul termometrelor cu rezistenta fixa si al pirometrelor optice.
Din Anexa nr. 2 se observa ca unitatea de masura pentru scarile Celsius si Kelvin este aceeasi, diferenta dintre scari consta doar in alegerea originii scarii. Legatura intre temperatura exprimata in grade Kelvin (T) si temperatura masurata in grade Celsius (t) este data de relatia:
T = t + 273,15 [K] (1.16)
Aparatele utilizate pentru masurarea temperaturii se nimesc termometre. Termometrele utilizate pentru masurarea temperaturilor se clasifica dupa principiul care sta la baza lor astfel:
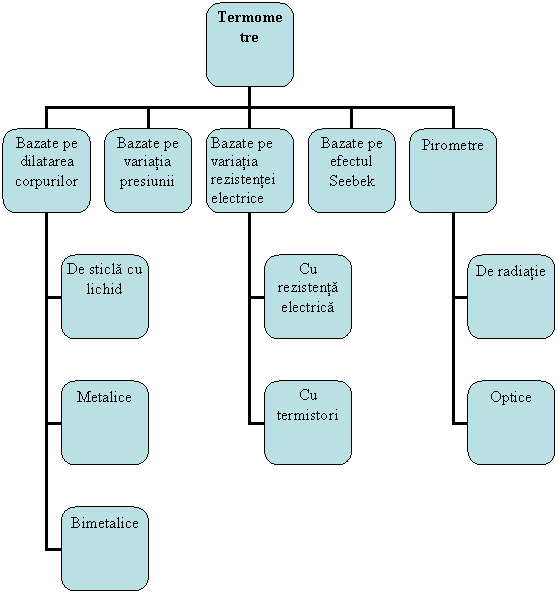
Fig. 1.19 Tipuri de termometre
1. Termometre bazate pe dilatarea corpurilor al caror principiu de functionare se bazeaza pe proprietatea corpurilor solide si lichide de a-si modifica volumul la variatia temperaturii. Dupa solutia constructiva si materialul utilizat ca agent de lucru, aceste termometre pot fi:
a. Termometre de sticla cu lichid (figura 1.20) - cele mai utilizate aparate pentru masurarea temperaturilor, putand fi folosite atat pentru masurari de precizie in laboratoare cat si pentru masurarea temperaturilor in domeniul industrial, medical, etc., deoarece sunt simple, usor de manevrat si au o precizie de masurare ridicata. De asemenea, permit masurarea temperaturilor pe un domeniu larg cuprins intre -200+750o C.
Principiul lor de functionare se bazeaza pe dilatarea unui lichid inchis intr-un tub capilar de sticla. Nu pot fi utilizate ca aparate cu indicatie indirecta.
In functie de domeniul in care se masoara temperatura, lichidul termometrului poate fi: mercurul, pentanul, alcoolul etilic sau toluenul (tabelul 1.1).
Tab. 1.1
Lichide utilizate pentru masurarea temperaturii
|
Lichidul termometric |
Domeniul de utilizare |
|
Mercur |
-35...3000 C (750 0 C)* |
|
Pentan tehnic |
-200...20 o C |
|
Alcool etilic |
-110...50o C |
|
Toluen |
-70...100o C |
*Pentru masurarea temperaturilor mai mari de 300o C, in spatiul liber din tubul capilar se introduce un gaz inert (azot, hidrogen, argon, bioxid de carbon) care prin marirea presiunii ridica temperatura de vaporizare a mercurului.
Tubul de sticla pentru termometrele care masoara temperaturi mai mici de 600o C se confectioneaza din sticla termometrica care are un coeficient de dilatare mic, se poate detensiona prin tratament termic si are punctul de inmuiere ridicat. La termometrele folosite in domeniul 600750o C tubul este confectionat din cuart.
Fig. 1.20 Termometre de sticla cu lichid
a-cu lichid; b-manometric; c-cu rezistente electice legate in punte Wheatstone
b. Termometre metalice care folosesc pentru masurarea temperaturii deplasarea produsa de dilatarea unei tije metalice. Se utilizeaza de regula ca aparat semnalizator la atingerea unei anumite temperaturi.
Principiul de functionare are la baza dilatarea liniara a corpurilor solide la cresterea temperaturii conform relatiei:
L = L0 ( 1 + aT )
relatie in care a [K-1] se numeste coeficient de dilatare liniara si pentru principalele materiale utilizate are valorile din tabelul 1.2.
Tab 1.2
Valorile coeficientilor de dilatare liniara pentru unele metale si aliaje
|
Materialul |
Coeficientul de dilatare liniara a |
|
|
a 106[K-1] |
La temperatura t [o C] |
|
|
Alama (60% Cu, 38% Zn) |
16,65 |
-190...20 |
|
Aluminiu |
24 |
0...100 |
|
Constantan (40% Ni) |
14,8 |
0...500 |
|
Cupru |
15,9 |
20...800 |
|
Otel |
14,5 |
400...500 |
|
Molibden |
5,5 |
0...500 |
|
Platina |
8,7 |
0...1000 |
|
Staniu |
27 |
20...100 |
c. Termometre bimetalice care folosesc pentru masurarea temperaturii deplasarea capatului liber al unei lamele bimetalice, formata din materiale cu coeficienti de dilatare diferiti. Aceste termometre au aceleasi utilizari ca si termometrele metalice (figura 1.21):

Fig. 1.21 Termometru bimetalic
2 .Termometre bazate pe variatia cu temperatura a presiunii corpurilor mentinute la volum constant (gaze, vapori sau lichide). Aceste termometre se compun dintr-un rezervor care se introduce in sistemul a carui temperatura se masoara, legat printr-un tub flexibil la un manometru (figura 1.22):

Fig. 1.22 Termometru manometric
Intregul sistem este umplut cu un lichid (mercur, alcool metilic, etc.), vapori (de clorura de metil, alcool metilic sau freoni) sau cu un gaz inert (azot, heliu, etc.). Presiunea lichidului termometric creste proportional cu cresterea temperaturii, conform legii lui Charles, si prin intermediul unei membrane se transmite aparatului indicator care este un manometru, etalonat direct in grade.
In functie de fluidul de lucru folosit, acest tip de termometre, cunoscute si sub denumirea de termometre manometrice, sunt utilizate pentru masurarea temperaturilor intre 200...600o C. Ele prezinta urmatoarele avantaje:
simplitate constructiva;
permit transmiterea indicatiilor la distante pana la 60 m;
sunt robuste in exploatare ceea ce permite masurarea temperaturii mediilor aflate in vibratie (ex: apa in sistemele de racire ale motoarelor cu ardere interna) sau in locuri unde, din cauza pozitiei, scara unui termometru cu sticla nu ar putea fi urmarita;
pot indeplini functii de inregistrare, semnalizare sau reglare.
3. Termometre bazate pe variatia cu temperatura a rezistentei electrice a corpurilor metalice.
Dupa materialul folosit pentru masurarea rezistentei electrice, acestea pot fi:
a. Termometre cu rezistenta electrica (figura 1.23):
Pentru confectionarea acestui tip de termometre se utilizeaza materialele prezentate in tabelul 1.3.
Tab. 1.3
Materiale utilizate ca rezistente electrice
|
Materialul termorezistentei |
Domeniu de utilizare |
|
Platina |
-200.850o C |
|
Cupru |
-50.180o C |
|
Nichel |
-50.180o C |
Cel mai folosit element pentru constructia rezistentelor pentru termometre este platina, care permite masurari in intervalul de temperatura de la -200oC.850oC. In domeniul temperaturilor pozitive, rezistenta unui rezistor de platina depinde de temperatura conform relatiei:
Rt = Ro (1 + a t + b t2) (1.18)

Fig. 1.23 Termometru electric
Pentru a se elimina influenta firelor de legatura, de obicei elementele termorezistentei se confectioneaza cu rezistenta de 100 W la 0o C. Masurarea se efectueaza folosind scheme cu logometru sau cu punte Wheatstone. (figura 1.24c -De scanat).
In cazul acestor termometre se va urmari ca intensitatea curentului sa nu provoace incalzirea termorezistentei, iar rezistenta totala a firelor de legatura sa nu fie mai mare de 10W. Se folosesc in general pentru masurarea de la distanta, indicatoarele fiind amplasate in cadrul panourilor de automatizari.
b. Termometre cu termistori care sunt utilizate pe o scara tot mai larga in ultimul timp. Termistorii sunt materiale semiconductoare confectionate din amestecuri bine dozate de oxizi metalici sinterizati intr-un regim termic definit riguros si in atmosfera controlata. Ei au proprietatea de a-si modifica mult rezistenta electrica in raport cu temperatura, in special in domeniul temperaturilor negative. Acest tip de termometru prezinta urmatoarele avantaje:
- au dimensiuni foarte mici din care cauza se pot efectua masurari aproape punctiforme si cu inertie redusa;
- au rezistente electrice mari in comparatie cu termorezistentele electrice ceea ce elimina influenta conductorilor de legatura.
De regula termistorii se folosesc in aceleasi scheme de masurare ca si termorezistentele metalice.
4. Termometre bazate pe aparitia unei tensiuni electromotoare intr-un circuit format din doua conductoare din materiale diferite atunci cand punctele lor de legatura se afla la temperaturi diferite (efectul Seebeck).
Aparatele utilizate se numesc termocuple si sunt confectionate din doua sarme din metale sau aliaje diferite sudate la un capat (figura 1.25).
In tabelul 1.4 sunt prezentate principalele cupluri metalice folosite pentru confectionarea termocuplelor.
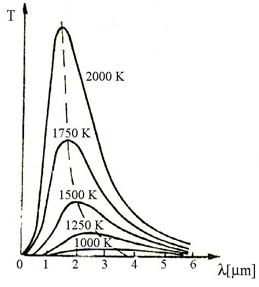
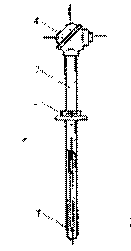
Fig. 1.25 Termocupla Fig. 1.26 Variatia intensitatii radiatiei
termice cu lungimea de unda si
temperatura
Tab. 1.4
Cuplurile de materiale utilizate mai frecvent la confectionarea termocuplelor
|
Termocuplul |
Domeniul de functionare continua [o C] |
Functionare intermitenta tmax [o C] |
t.e.m. max [mV] |
|
Pt-Pt-Rd 10% |
-100..1400 |
1800 |
16,62 |
|
Fe-Constantan |
-200..600 |
800 |
45,18 |
|
Cromel-Alumel |
-200..900 |
1200 |
48,07 |
|
Cu-Constantan |
-20..450 |
550 |
24,14 |
|
Cromel-Copel |
-200..600 |
800 |
66,42 |
Ca aparat de masura se foloseste un minivoltmetru indicator cu scara marcata in grade de temperatura. Pentru o masurare corecta trebuie ca unul din capete (sudura rece) sa fie mentinuta pe cat posibil la aceeasi valoare la care s-a facut etalonarea aparatului (0oC sau 20oC) iar celalalt capat al imbinarii (sudura calda) sa fie instalat in sistemul caruia dorim sa-i masuram temperatura.
Acest tip de termometre prezinta urmatoarele avantaje:
permit transmiterea indicatiilor la distanta;
permit conectarea mai multor elemente de masura, cu ajutorul unui comutator, la un aparat de masura.
5. Aparate bazate pe masurarea energiei emise prin radiatie sau a luminozitatii corpurilor aflate la temperaturi superioare (peste 700o C). Aceste aparate se numesc pirometre si se utilizeaza pentru masurarea temperaturii in interiorul unor sisteme in care datorita mediului foarte fierbinte nu pot fi utilizate celelalte tipuri de termometre fara masuri speciale de protectie a elementului sensibil.
Dupa principiul care sta la baza functionarii lor, pirometrele pot fi:
a. Pirometre de radiatie care masoara temperatura unui sistem prin masurarea energiei emisa prin radiatie in domeniul infrarosu al spectrului de catre corpul respectiv. Intensitatea radiatiei creste odata cu temperatura si in acelasi timp, radiatia de intensitate maxima se deplaseaza catre lungimi de unda din ce in ce mai mici (figura 1.26).
Din aceasta cauza, corpurile isi modifica culoarea pe masura ce temperatura creste, incepand de la rosu spre galben si apoi la temperaturi foarte mari la albastru-cenusiu.
Aceste aparate pot masura temperaturi de la -40o C in sus, dar de regula se folosesc pentru temperaturi cuprinse intre 700.3500o C.
Fata de termometrele de contact, pirometrele de radiatie prezinta urmatoarele avantaje:
- nu vin in contact direct cu corpul a carui temperatura se masoara si nu modifica campul termic al acestuia;
- au inertie foarte mica, ceea ce permite masurarea temperaturilor in zone cu gradienti mari de temperatura.
Deoarece radiatia termica depinde de natura corpului si de starea suprafetei lui, iar aparatele sunt etalonate in raport cu radiatia emisa de corpul negru (care radiaza integral energia), la utilizarea pirometrelor de radiatie se folosesc tabele sau diagrame de corectie care insotesc aparatura.

Fig. 1.27 Pirometru de radiatie OMEGA
Pirometru fara contact, portabil, in domeniul infrarosu. Masoara temperaturi in intervalul -18538 C cu o precizie de 1,5% din valoarea masurata
b. Pirometrele de radiatie totala sesizeaza cresterea cu temperatura a energiei radiata de tot spectrul de emisie al corpului. Pentru aceasta ele concentreaza energia emisa de mediul a carui temperatura se masoara cu ajutorul unui sistem optic, pe un receptor de energie de radiatie format din foite de platina innegrite. Temperatura se masoara cu ajutorul unui termocuplu.
La unele pirometre receptorul de energie este o celula fotoelectronica. Curentul fotoelectric produs fiind proportional cu fluxul luminos emis constituie o masura a temperaturii corpului care emite energia.

Fig. 1.28 Pirometru in infrarosu cu iesire programata
Masoara temperaturi in intervalul -401200 C cu o precizie de 1% din valoarea masurata

Fig. 1.29 Pirometru cu senzor pirometric inteligent, cu iesire, in spectrul infrarosu
Masoara temperaturi in intervalul -452500 C cu o precizie de 1% din valoarea masurata
c. Pirometrele optice vizuale se bazeaza pe compararea luminozitatii obiectului incandescent cu luminozitatea unui radiator etalon, la lungimea de unda de 0,65 mm (radiatia rosie a spectrului vizibil). Acest fapt limiteaza utilizarea lor numai la temperaturi mai mari de 700o C.
Comparatia luminozitatilor se poate face pe doua cai:
- se modifica luminozitatea unui fir metalic incalzit electric, prin variatia intensitatii curentului care trece prin el, pana ce devine egala cu luminozitatea obiectului. In acest caz intensitatea curentului devine o masura a temperaturii obiectului;
- se slabeste pe cale optica (filtre) radiatia emisa de obiectul incandescent, pana ce luminozitatea lui este egala cu luminozitatea unui radiator de comparatie. Gradul de reducere a luminozitatii este o masura a temperaturii obiectului.
Utilizarea pirometrelor optice este afectata de erori subiective, presupunand un discernamant cromatic normal din partea utilizatorului.
d. Pirometrele optice de culoare pot sesiza, prin diferite procedee, modificarea culorii corpului cu temperatura.

Fig. 1.30 Pirometru cu fibra optica
Masoara temperaturi intre -181046 C
1.2.6 Presiunea
Presiunea este un parametru fizic egal cu raportul dintre marimea fortei F care apasa normal si uniform pe o suprafata si aria S a acestei suprafete:
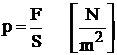
Intr-un sistem termodinamic in echilibru, presiunea este aceeasi in orice punct si in orice directie. Aceasta justifica natura de parametru a presiunii, ca o marime care poate caracteriza in mod univoc o stare de echilibru intr-un sistem termodinamic.
In conceptia teoriei cinetice, presiunea este un parametru intern, a carui valoare depinde de energia medie a moleculelor, de concentratia particulelor si de temperatura asa cum rezulta din relatia (1.20):
![]() (1.20)
(1.20)
in care: n = N/V reprezinta concentratia particulelor;
k = R/NA = 1,38 10-23 [J/K] este constanta lui Boltzmann;
T - temperatura sistemului aflat in echilibru.
Unitatea de masura pentru presiune in sistemul international este pascalul (Pa):
1Pa = 1 N/m2
Aceasta unitate de masura fiind foarte mica, in practica se utilizeaza obisnuit alte unitati de masura preluate din alte sisteme de unitati (sistemul tehnic, C.G.S., etc.): atmosfera tehnica (at), barul, torrul, inaltimea unei coloane de apa sau de mercur, etc. Cu relatiile de transformare prezentate in tabelul 1.5.
Aparatele uzuale pentru masurarea presiunii unui fluid nu indica presiunea fluidului, ci diferenta de presiune fata de presiunea atmosferica. Daca presiunea fluidului este mai mare decat presiunea atmosferica exista suprapresiune care se masoara cu manometrul, iar in caz contrar este depresiune care se masoara cu vacumetrul. Presiunea atmosferica se masoara cu barometrul si din aceasta cauza mai este cunoscuta sub denumirea de presiune barometrica.
La fel ca si temperatura, presiunea se poate masura numai indirect folosindu-se proprietatea unor corpuri de a-si modifica unii parametri (dimensiuni, pozitie, sarcina electrica, etc.) proportional cu variatia presiunii in cadrul unui sistem.
Tab. 1.5
Relatiile de conversiune pentru transformarea unor unitati de masura utilizate pentru presiune
|
Nr. Crt. |
Unitatea de masura |
Relatia de conversiune |
|
|
Denumire |
Simbol |
||
|
1 |
Pascalul |
Pa |
1 Pa = 1 N/m2 |
|
2 |
Torrul |
Torr |
1 Torr = 1 mm Hg = 133,3 Pa |
|
3 |
Milimetri coloana de mercur |
Mm Hg |
1 mm Hg = 1 Torr = 133,3 Pa |
|
4 |
Atmosfera tehnica |
at |
1 at = 1 kgf/cm2 = 0,98.105 Pa = 735 torr |
|
5 |
Kilogramul forta pe metrul patrat |
Kgf/m2 |
1 kgf/m2 = 10-4 at = 1 mm H2O = 9,81 Pa |
|
6 |
Milimetri coloana de apa |
Mm H2O |
1 mm H2O = 9,81 Pa |
|
7 |
Atmosfera fizica |
atm |
1 atm = 760 torr = 105 Pa |
|
8 |
Barya |
barye |
1 barye = 0,1 Pa |
|
9 |
Barul |
bar |
1 bar = 106 barye = 105 Pa = 1,019 at |
In functie de principiul care sta la baza efectuarii masuratorilor, aparatele pentru masurarea presiunii se clasifica astfel:
Aparate bazate pe deplasarea unei coloane de lichid datorita diferentei de presiune
Toate aceste aparate se bazeaza pe principiul vaselor comunicante. Ele prezinta urmatoarele avantaje:
simplitate constructiva;
precizie de masurare ridicata;
domeniu elative mare de presiuni care pot fi masurate.
Totusi, utilizarea lor este limitata datorita urmatoarelor dezavantaje:
nu rezista in medii cu socuri sau vibratii;
exista posibilitatea aparitiei erorilor de citire.
In functie de forma lor, valorile diferentei de presiune care se masoara si precizia de masurare ele pot fi:
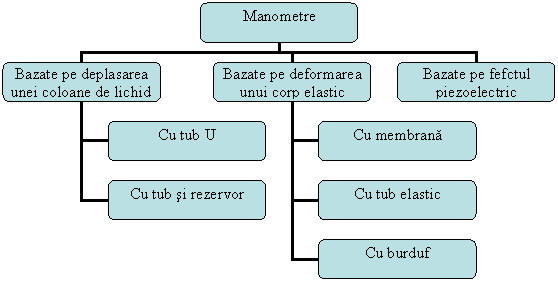
Fig. 1.31 Tipuri de manometre
a. Aparate pentru masurarea diferentelor de presiune cu tub U. Acestea folosesc ca lichid de lucru apa sau mercurul. Aparatul are un capat legat la sistemul a carui presiune se masoara, celalalt capat fiind deschis si in legatura cu atmosfera. Cele doua ramuri ale tubului avand sectiuni egale, diferenta dintre presiunea care trebuie masurata si presiunea atmosferica este tinuta in echilibru de presiunea hidrostatica a coloanei de lichid:
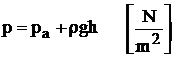
in cazul suprapresiunilor (figura 1.6a),respectiv:
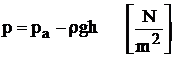 (1.22)
(1.22)
in cazul depresiunilor (figura 1.29b).
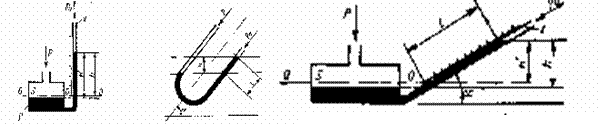
Fig. 1.32 Aparate pentru masurarea diferentelor de presiune cu tub U
a) manometru cu rezervor; b) aparat cu tub U inclinat; c) aparat cu rezervor si tub drept
In termodinamica se lucreaza cu presiunile absolute, insa in practica se lucreaza cu presiunile relative (cele indicate direct de aparatele de masura).
b. Aparate pentru masurarea diferentelor de presiune cu rezervor
Deoarece in cazul aparatelor cu tub U deplasarea coloanei de lichid, in special a coloanei de apa este foarte mare si acest fapt limiteaza domeniul diferentelor de presiune care pot fi masurate, s-a inlocuit ramura tubului U legata la sistemul a carui presiune vrem sa o masuram cu un rezervor care are sectiunea S mult mai mare decat sectiunea S a ramurei aflata in legatura cu atmosfera.
In aceste conditii, deplasarea lichidului in rezervor este foarte mica si citirea indicatiilor se poate face numai de-a lungul bratului subtire (figura 1.32c).
Valoarea presiunii absolute masurata cu acest aparat se determina cu relatia:
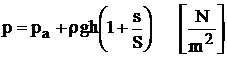 (1.23)
(1.23)
relatie in care:
r - densitatea lichidului de lucru;
g - acceleratia gravitationala;
h - diferenta de nivel a lichidului din cele doua ramuri.
Intrucat, pentru un anumit aparat, sectiunile rezervorului si a tubului subtire sunt constante, termenul din paranteza se numeste constanta aparatului.
c. Aparate pentru masurarea diferentelor de presiune cu tub inclinat se folosesc pentru masurarea unor diferente de presiune mici sau pentru marirea preciziei de masurare.
Deosebirea constructiva a acestor aparate fata de cele prezentate anterior consta in faptul ca tubul U sau bratul subtire al aparatului cu rezervor se inclina sub un unghi a (figura 1.32d,e), presiunea de masurat putand fi determinata cu relatia:
 (1.24)
(1.24)
in cazul tubului U inclinat,
respectiv:
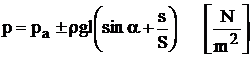 (1.25)
(1.25)
in cazul rezervorului cu tub inclinat.
d. Micromanometrul este un aparat cu
rezervor si tub inclinat mobil care poate fi fixat la anumite unghiuri a asfel incat coeficientul 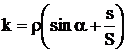 sa capete valori precise: 1/10; 1/25; 1/50; sau 1/100. Presiunea masurata cu
aceste aparate are valoarea:
sa capete valori precise: 1/10; 1/25; 1/50; sau 1/100. Presiunea masurata cu
aceste aparate are valoarea:
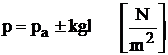 (1.26)
(1.26)
Prin folosirea ca lichid de lucru a alcoolului etilic pur care are densitatea mai mica decat apa sau mercurul (r = 800 kg/m3) se pot masura diferente de presiune extrem de mici, pana la 0,1 Pa.
2. Aparatele pentru masurarea presiunii bazate pe deformarea unui corp elastic au cea mai mare raspandire practica datorita avantajelor pe care le prezinta:
pot fi folosite pentru masurari la distanta;
au o fiabilitate ridicata;
permit masurarea unor presiuni mari.
Totodata folosirea lor presupune si unele dezavantaje cum ar fi:
precizie de masurare mai scazuta;
datorita elementelor cu legaturi mecanice prezinta o anumita inertie care impiedica folosirea lor pentru urmarirea gradientilor mari de presiune.
a) Manometre cu membrana (bold-italic) (fig. 1.33)
Principiul de functionare consta in transmiterea deformarii elastice a unui material (arc, tub, capsula, membrana, burduf), produsa sub actiunea fortei de presiune, prin intermediul unui mecanism cu parghii, catre un ac indicator care cu ajutorul unui cadran gradat le transforma in indicatii de presiune.

Fig. 1.33 Manometru cu membrana elastica

Fig. 1.34 Sonda manometrica
b) Aparate cu tub elastic (Tub Bourdon). Se bazeaza pe deformarea unui tub elastic in forma semicirculara, inchis la unul din capete, sub actiunea fortei de presiune din interior.
Clasa de precizie a aparatului depinde de calitatile elastice ale materialului tubului si precizia de executie a mecanismului cu parghii. Manometrele cu tub elastic pot fi construite si ca aparate semnalizatoare sau regulatoare.
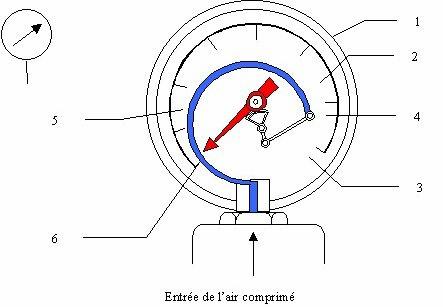
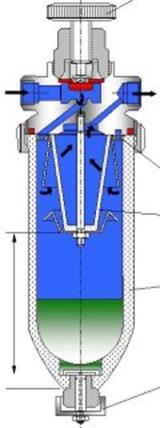
Fig. 1.35 Manometru cu tub Bourdon
c) Manometru cu burduf se bazeaza pe masurarea deplasarii produsa sub actiunea fortei de presiune, de deformatia unui burduf elastic. Un mecanism cu parghii indica pe o scala gradata direct valorile presiunii.
3. Aparatele bazate pe efectul piezoelectric sunt aparate indicatoare lipsite de inertie, ceea ce permite folosirea lor pentru urmarirea variatiilor rapide de presiune.
Functionarea lor se bazeaza pe fenomenul piezoelectric care consta in aparitia unor sarcini electrice pe fetele slefuite ale unui cristal de cuart cand este supus unor variatii de presiune.
Un exemplu de utilizare a unor astfel de aparate il constituie urmarirea evolutiei valorilor presiunii din interiorul unui cilindru al motoarelor cu ardere interna pe timpul unui ciclu de functionare (figura 1.36).
Dispozitivul care transforma variatiile de presiune in semnale electrice, numit traductor piezoelectric, este introdus in camera de ardere (la fel ca bujia sau injectorul). Semnalul electric emis este amplificat si apoi trimis pentru vizualizare si inregistrare la un osciloscop. Pentru a se putea localiza in cadrul ciclului variatiile de presiune, concomitent un alt aparat (traductor de cursa) urmareste rotatia arborelui cotit emitand semnale electrice care amplificate sunt trimise la acelasi oscilator catodic unde se suprapun cu indicatiile traductorului piezoelectric.
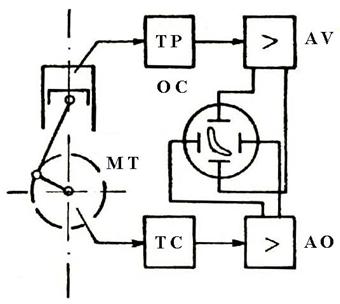
Fig. 1.36 Utilizarea traductorilor piezoelectrici la urmarirea variatiei presiunii
in motoarele cu ardere interna
4. Aparatele cu piston se bazeaza pe echilibrarea fortelor produse de presiunea fluidului intr-un cilindru, cu ajutorul unor greutati amplasate pe un piston etans. Presiunea masurata este data de raportul dintre greutatea pistonului cu greutatile de incarcare si suprafata pistonului.
1.2.7 Caldura
Caldura este conceptul de baza in termodinamica. Ea se transmite intre doua corpuri cu temperaturi diferite, fiind o forma de transfer de energie care se poate manifesta fara modificarea granitelor sistemului deci fara prezenta lucrului mecanic. Schimbul energetic sub forma de caldura se datoreste tendintei naturale a sistemelor de a-si uniformiza nivelele energetice, atunci cand acestea sunt diferite. Uniformizarea are loc pe baza unui schimb energetic intre acestea, schimb care inceteaza numai cand intre sisteme se atinge echilibrul termic.
Pana in secolul XIX se credea ca in corpuri exista o substanta fluida purtatoare de caldura, numita caloric, iar la recerea acesteia de la un corp la altul se realizeaza echilibrul termic.
Carnot si apoi Joule, au aratat experimental ca lucrul mechanic poate determina incalzirea unei substante, ajungand la concluzia ca exista o echivalenta intre lucrul mechanic si caldura, ca forme de energie care se transforma reciproc, respectand principiul transformarii si conservarii energiei.
Caldura nu este o marime de stare ci o marime de proces si are sens numai cand sistemul evolueaza intre doua stari:
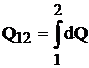 (1.27)
(1.27)
Caldura masoara energia transmisa de la un corp la altul prin procese microscopice.
Conventional caldura cedata de sistem se considera negativa. Un proces in decursul caruia, un sistem marginit de un invelis nu permite trecerea caldurii se numeste proces adiabatic (dQ = 0).
Sistemul nu poseda caldura, dar aceasta strabate limitele sistemului cand el evolueaza intre doua stari. Caldura se poate transfera prin: conductie, convectie si radiatie termica.
Caldura schimbata de un sistem cu mediul ambiant intr-un proces termodinamic elementar poate fi exprimata prin relatia:
![]() (1.28)
(1.28)
unde factorul de proportionalitate C se numeste capacitate termica si este definit ca fiind caldura transferata la sau de la un corp corespunzatoare unei variatii a temperaturii acestuia cu un grad (Celsius sau Kelvin), in conditiile in care acesta nu-si schimba starea de agregare. In practica se utilizeaza capacitatea termica masica c = C/m si relatia (1.28) devine:
![]() (1.29)
(1.29)
Valorile capacitatilor termice masice ale gazelor perfecte pentru diferite temperaturi sunt prezentate in Anexa nr.3.
Schimbul de energie sub forma de caldura sau lucru mecanic implica variatii ale energiei interne a sistemului, asfel incat:
dU = dQ - dL (1.30)
1.2.8 Lucrul mecanic
Intre sistem si mediul exterior exista forte de interactiune mecanica. Aceste forte provoaca actiuni mecanice in urma carora starea de echilibru a sistemului nu se modifica, avand loc doar o deplasare mecanica a intregului sistem, sau sistemul paraseste starea de echilibru, suferind o transformare in urma careia parametrii se modifica.
Lucrul mecanic reprezinta interactiunea mecanica dintre un sistem si mediul ambiant.
Dupa tipul sistemului si modul in care are loc aceasta interactiune, distingem mai multe cazuri de lucru mecanic:
a) Lucrul mecanic exterior se manifesta in cazul interactiunii dintre un sistem inchis si mediul ambiant, caz in care nu se efectueaza schimb de substanta ci numai o transformare energetica concretizata prin modificarea energiei interne a sistemului si modificarea granitelor lui ca urmare a variatiei volumului.
In cazul proceselor termodinamice elementare reversibile (considerate etanse, reversibile si fara frecari), lucrul mecanic exterior este dat de relatia:
![]() (1.31)
(1.31)
Deoarece lucrul mecanic exterior se refera la o modificare a starii gazului, acesta se mai numeste si lucrul mecanic al transformarii.
Lucrul mecanic corespunzator trecerii unui sistem dintr-o stare 1 in alta stare 2 va fi:
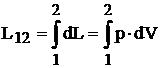 (1.32)
(1.32)
Relatiile (1.30) si (1.31) sunt valabile numai pentru transformarile reversibile. In cazul transformarilor ireversibile, o parte din energia gazului se consuma in unul din procesele secundare care au determinat caracterul ireversibil: frecarea, neomogenitatea gazului, etc.
Lucrul mecanic exterior poate fi nul in urmatoarele cazuri:
cand presiunea agentului de lucru este nula (p = 0);
cand transformarea este izocora (V = ct; dV = 0).
Prin conventie, lucrul mecanic cedat de sistem in exterior este considerat pozitiv, iar lucrul mecanic efectuat asupra sistemului este considerat negativ.
Deoarece lucrul mecanic exterior depinde de drumul parcurs, el nu este o marime de stare ci o marime de proces. Aceasta concluzie sta la baza functionarii masinilor termice, care functioneaza ciclic, producand sau consumand lucru mecanic, ceea ce permite clasificarea lor in doua mari categorii:
masini termice de forta - care functioneaza dupa cicluri pozitive, producatoare de lucru mecanic;
masini termice de lucru - care functioneaza dupa cicluri negative, consumatoare de lucru mecanic.
b) Lucrul mecanic de dislocare apare in cazul sistemelor deschise si reprezinta lucrul mecanic necesar pentru vehicularea unui volum de fluid intr-un sistem, dintr-o pozitie data pana in alta pozitie, in conditii de presiune constanta. Valoarea acestui lucru mecanic este data de relatia:
![]() (1.33)
(1.33)
Acest lucru mecanic este cedat fiecarei transe de gaz de catre masa de gaz din amonte care actioneaza ca un piston. El este o marime de stare, spre deosebire de lucrul mecanic exterior care este o marime de proces si in consecinta va avea valoarea:
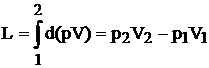
c) Lucrul mecanic tehnic reprezinta lucrul mecanic total pe care il dezvolta agentul de lucru in masina termica si include atat lucrul mecanic al transformarii intre doua stari cat si lucrul mecanic de dislocare pentru admisia si evacuarea agentului termic. Spre deosebire de lucrul mecanic exterior, lucrul mecanic tehnic este produs continuu si are valoarea:
![]()
Valoarea lucrului mecanic reprezentat in diagrama p-V este data de marimea ariei cuprinsa intre graficul transformarii respective si axa absciselor (axa volumelor).
1.2.9 Energia interna
Prin energie se intelege capacitatea unui sistem fizic, corp sau camp, de a efectua lucru mecanic. In general, un sistem poseda o energie formata din energia cinetica (Ec) a sistemului luat in ansamblu, din energia potentiala (Ep) cand sistemul se afla intr-un camp de forte si o energie interna U datorata formelor de energie ale particulelor sistemului (energia cinetica si energia de interactiune a moleculelor, energia miscarii oscilatorii a atomilor si energia interatomica la nivelul invelisului electroatomic,etc.), cu alte cuvinte energia conservata intr-un sistem intr-o stare termodinamica oarecare.
Deci:
![]() (1.36)
(1.36)
sau:
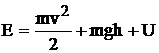
In termodinamica se neglijeaza in general energia exterioara si se considera ca energie a sistemului energia interna a acestuia compusa din suma algebrica a energiilor cinetice si potentiale ale particulelor la nivelul moleculelor. De obicei, pentru gazele ideale, suma energiilor potentiale este neglijabila in raport cu suma energiilor cinetice, astfel incat se poate aproxima:
E = S Ec (1.38)
In teoria cinetico-moleculara se face o legatura directa intre energia cinetica medie de translatie a moleculelor si temperatura:
Ec med = (3/2).k.T (1.39)
relatie in care k reprezinta constanta lui Boltzmann si are valoarea: k = 1,38054.10-23 J/K.
Energia interna a unui sistem termodinamic depinde numai de parametrii de stare, ceea ce face ca si ea sa fie o marime de stare. In consecinta, in orice proces termodinamic, variatia energiei interne depinde numai de starea initiala si starea finala, fiind independenta de starile intermediare.
Luand in considerare cele aratate mai sus, se poate trage concluzia ca energia interna a unui gaz ideal monoatomic este o marime de stare care depinde numai de temperatura:
U = f(T) (1.40)
Conform teoriei cinetico-moleculara, pentru un gaz ideal monoatomic, se poate scrie expresia:
U = (3/2).N.k.T (1.41)
si cum:
N = n.NA , iar: NA.k = R, unde R este constanta gazului ideal avand valoarea: R = 8314,33J/(kmol.K), iar n este egal cu numarul de moli, rezulta:
U = (3/2).n.R.T (1.42)
Practic nu intereseaza valoarea absoluta a energiei interne ci numai variatia sa atunci cand sistemul trece dintr-o stare in alta, adica schimbul de energie dintre sistem si mediul ambiant.
Variatia energiei interne pune in evidenta modificarile energetice ale sistemului, cand compozitia chimica a acestuia nu se schimba. Intr-un proces termodinamic, variatia energiei interne va fi:
![]() (1.43)
(1.43)
Daca dupa un sir de transformari, gazul ideal revine la starea initiala (proces ciclic), variatia energiei interne este nula.
DU = 0 (1.44)
Schimburile de energie dintre un sistem termodinamic si mediul ambiant se poate face prin intermediul lucrului mecanic sau a caldurii. Legatura dintre cele trei forme de energie care pot fi intalnite la schimburile dintre sistem si mediul inconjurator poate fi exprimata prin relatia:
![]()
Pentru o transformare finita, intre doua stari extreme 1 si 2:
![]() (1.46)
(1.46)
Aceasta relatie reprezinta ecuatia de definitie a caldurii si ea arata ca intr-un sistem inchis, caldura introdusa pe durata desfasurarii unui proces oarecare este egala cu suma dintre variatia energiei interne si a lucrului mecanic care se schimba cu mediul ambiant.
In relatia:
dU = dQ + dL
dU este o diferentiala totala exacta, desi dL si dQ nu sunt, in general, diferentiale totale exacte.
Daca un sistem sufera o transformare, variatia energiei interne a sistemului depinde numai de starea initiala si starea finala a lui, fiind independenta de drumul parcurs, deci energia interna este o marime de stare extensiva, asa cum rezulta din relatia (1.37).
1.2.10 Entalpia
Entalpia (I) este o marime extensiva de stare cu caracter energetic reprezentata prin relatia:
![]() (1.47)
(1.47)
sau prin integrare:
![]() (1.48)
(1.48)
deci reprezinta suma dintre energia interna U si lucrul mecanic de deplasare.
Deoarece notiunea de entalpie are loc in orice fel de transformare, relatia de baza este relatia (1.40). Practic entalpia se refera la nivelul energetic al unui sistem termodinamic. Entalpia nu are o interpretare fizica cu toate ca are dimensiunea unei energii. Ea nu trebuie privita ca o energie, ci ca o marime de stare utilizata in calculele termodinamice.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 6855
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved