| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
MACROMOLECULE
In definirea unei molecule se accepta drept criteriu greutatea moleculara. Se considera a fi macromolecule compusii a carui masa moleculara este mai mare de 5000 de unitati.
Macromoleculele sunt:
proteine (heteropolimer de aminoacizi)
acizi nucleici (heteropolimer de nucleotide)
polizaharide
lipide
Cu toate ca masele moleculare ale lipidelor individuale sunt mici comparativ cu alte clase moleculare, unele lipide se pot asocia spontan in structuri macromoleculare.
Macromoleculele pot fi sintetizate natural sau artificial proces numit polimerizare sau policondensare. De exemplu - prin prolimerizarea AA se obtin polipeptide; prin policondensarea glucozei se obtin polizaharide (celuloza sau amidon).
Polimer sunt compusi macromoleculari alcatuiti din grupe identice de monomeri (A-A-A...-A).
Copolimerii sunt compusi macromoleculari a caror grupe de monomeri nu sunt identice (A-B-C-D..-A).
Biopolimerii sintetizati artificial au un comportament diferit din punct de vedere biofizic fata de cei sintetizati natural. Acest comportament diferit confera biopolimerilor naturali proprietati biofizice diferite de cei artificiali.
A. Tipuri fundamentale de polimeri:
enzime hidrolitice - de transfer sa de oxidare;
proteine de structura
proteine respiratorii
proteine plasmatice
anticorpi
proteinele din lapte - cazeina
hormonii
B. Acizii nucleici - sunt reprezentati de ARN si ADN; acestia alcatuiesc suportul informatiei genetice.
C. Polizaharidele - servesc la stocarea glucozei (element de baza al celulei).
D. Lipidele - fosfolipidele membranei celulare.
Dupa forma geometrica polimerii pot fi: lineari, ramificati, spatiali. Dupa rolul biologic macromoleculele pot fi: biocoloizi (proteine circulante din plasma si unele solubile din citoplasma), macromolecule de structura, macromolecule purtatoare de informatii.
Proprietatile biofizice generale ale biopolimerilor
Macromoleculele participa structural la nivel de membrana celulara la realizarea opozitiei la difuzia libera.
Sub aspect morfologic macromoleculele stau la baza structurilor supramoleculare.
Reactiile chimice invivo au consum de energie mult mai mic decat in vitro datorita existentei enzimelor drept catalizator.
Macromoleculele au capacitate informationala.
Organizarea structurala si conformationala a macromoleculelor biologice
S-au pus in evidenta patru structuri de baza a proteinelor:
Structura primara se refera la secventa Aa in lantul polipeptidic. Proteinele sunt alcatuite din aminoacizi legati intre ei prin grupari COOH, NH2 cu eliminarea unei molecule de H2O.
Structura secundara consta in spiralarea sau plierea lantului polipeptidic primar. Legaturile intermoleculare se realizeaza prin punti de H2.
Structura tertiala rezulta din indoirile structurii secundare si da forma moleculei proteice.
Structura cuaternala este constituita din alipirea structurilor tertiale.
Configuratia acizilor nucleici
Acizii nucleici sunt macromolecule complexe si indeplinesc doua functii:
Depoziteaza informatia genetica.
Participa la sinteza unor molecule.
Sunt reprezentati de ADN care este suportul informasiei ereditare.
MOLECULA
Leninghes spune ca moleculele din organismele vii strudiate individual se suprapun principiilor fizice si chimice obisnuite ce guverneaza comportarea materiei inerte. Studiate in ansamblu aceste molecule interactioneaza intre ele conform unui alt grup de principii care alecatuiesc logica moleculara a starii vii. Aceste principii nu includ in mod necesar legii fizice noi nedescoperite inca. Ele trebuie privite ca un grup de reguli fundamentale care guverneaza natura, functia si interactiunile tipurile specifice de molecule din organismele vii.
Principiu = axiome ce nu pot fi demonstrate inca.
Compozitia chimica a materiei vii
Este cantitativ diferita fata de a mediului in care acesta se gaseste. Organismele vii au in constitutia lor:
Ioni de dimensiuni foarte mici - microioni - Na; K; Cl - implicati in excitabilitate; Ca - in contractia musculara; Mg - rol in bioluminiscenta; H2 - secretat de mucoasa gastrica si generator de tensiuni protomatrice in anumite organisme; ion carboxil; fosfat; oxidril.
Micromoleculele care pot fi neutre sau disociate reprezentate de aminoacizi, mononucleotide, monozaharide, acizi grasi
Macromoleculele si complexele macromoleculare.
Structura fizica a moleculelor
Molecula este o grupare de atomi ce formeaza o configuratie stabila datorita fortelor de interactiune dintre ei. Aceste forte de interactiune se numesc forte interatomice sau forte intramoleculare
O molecula se formeaza atunci cand fortele de atractie dintre atomi sunt egale cu cele de respingere si energia potentiala a ansamblului este minima.
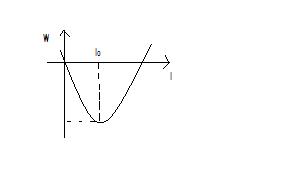
Forte interatomice - pot fi masurate cu metode specifice: rezonanta magnetica nucleara; rezonanta electronica de spin sau disfractia cu raze X. Aceste forte interatomice pot fi ionice si covalente.
Legea ionica: are natura electrostatica.
Legea lui Coulomb - specifica pentru ccorpurile macroscopice.
Legatura covalenta - se realizeaza prin punerea in comun a electronilor. Este o legatura de distanta mica, distanta dintre atomi fiind inferioara razei de interactiune interatomica. Are caracter de saturatie; odata formata legatura dintre doi atomi, perechile electronice nu mai permit alte legaturi.
Legatura coordinativa - punerea in comun de electroni (electronii provenind de la un singur atom ).
In legaturile covalente formate din atomi diferiti, perechea de electroni de legatura nu este repartizata simetric intre cei doi atomi, fiind atrasa spre atomul mai electronegativ, legatura capatand astfel un moment de dipol. Acest moment de dipol va fi cu atat mai mare cu cat diferenta de electronegativitate este mai mare.
MEMBRANA CELULARA
Orice tesut animal este format din celule si lichid interstitial care le scalda. Celula este formata din lichid intracelular, citoplasma, organite celulare. Limita dintre mediul intra si extra celular reprezinta bariera celulara.
Functiile membranei celulare - membrana trebuie privita ca un organ si nu ca pe o pelicula pasiva; de aici rezulta caracterul dinamic al functiilor ei .
Compozitia chimica a membranelor biologice
Este selectiva
In general membrana biologica contine: proteine, lipide, glucide, ioni, apa
Sunt trei categorii de membrane biologice:
a. Membrana mielinica - functia lor este de izolator si bariera de permeabilitate
b. Membranele citoplasmatice ale celulelor animale au functia enzimatica si de transport
c. Membranele citoplasmatice ale bacteriilor si membrana interna a mitocondriilor.
Functii - de sinteza de acizi nucleici, transport, fosforilare oxidativa. In cazul fosfolipidelor avem doua tipuri: hidrofob (acid fosforic) si hidrofil (acizii grasi). In cazul eliberarii apei din molecule are loc o crestere a entropiei sistemului. Tendinta structurilor bilipidice. Terminatiile hidrofobe fiind orientate catre interior, iar cele hidrofile catre mediul apos intra si extracelular.
O evidenta a faptului ca exista o fluiditate a proteinelor membranare s-a demonstrat prin experimente in care unele proteine intrinseci au fost mascate cu izotopi radioactivi si s-a demonstrat prin mecanismele reactiilor ce au loc ca acestea se misca liber inauntrul unui plan membranar. Aceste miscari in membrana proteinei nu includ miscarea de rotatie. Interactiunile dintre proteine si fosfolipide sunt foarte puternice iar energia ceruta pentru a roti o astfel de proteina este foarte mare. Uneori din cauza interactiunilor puternice proteinele intrinseci raman cuplate.
Fenomene de transport
Fenomenele de transport se refera la transportul de substanta in sisteme de dispersie datorita unor forte termodinamice, adica gradierii de concentratie, de presiune, in sensul cresterii entopiei, spre un echilibru al sistemului. Deci tinzand sa antreneze sistemul.
Dupa modul cum se realizeaza sunt doua tipuri de transport generale:
a. Difuzia - reprezinta transportul de solvit sub actiunea gradientului electrochimic.
b. Osmoza - reprezinta transportul de solvit datorita gradientului de presiune.
Difuzia
Reprezinta un transport de substanta intre zone de concentratie sau potential diferit.
Transportul pasiv este un proces de trecere a ionilor si moleculelor prin membrana.
Exista trei tipuri de transport pasiv:
Difuzia libera prin membrana sub actiunea gradientului de presiune si concentratie (dializa).
Filtrarea printr-o membrana sub actiunea gradientului de presiune si concentratie.
Osmoza sub actiunea gradientului de presiune.
Datorita structurii membranei ca strat bilipidic zona interna fiind o particula trebuie sa strabata intai zona hidrofila pentru a ajunge in zona hidrofoba. Dupa modelul cum moleculele sunt hidrofile sau hidrofobe mecanismul de difuziune va fi diferit. Solubilitatea unei solutii este diferit in mediul apos si in membrana. Raportul intre solubilitatea unui solvent in apa se noteaza cu β si se numeste coeficient de partitie (solvent - apa).
Legile difuziei
Difuzia pasiva sau transportul pasiv datorat agitatiei termice a unor particule din zonele de concentratie mai mare spre zonele de concentratie mai mica se supune la doua legi cunoscute sub numele de legile lui Fick.
Pentru prezentarea legilor difuze sunt necesari doi termeni: flux si gradient.
Flux - cantitate de substanta transportata printr-o suprafata in unitatea de timp.
Gradientul - variatia unei marimi (concentratii) intre doua puncte ale spatiului raportata la distanta dintre cele doua puncte.
Formula
Fluxul masic - dintr-o substanta printr-o substanta S este direct proportionala cu suprafata si cu gradientul de concentratie.
Formula
Δ = coeficient de difuziune
< Δ >SI = m2 . s-1
Formula
Legea a II a - este o lege de conservare. In procesul difuziei in intervalul de timp t (t+αt) si masa de solvit ce intra in volumul V= S . dx este egala cu masa ce raman in acest volum minus masa de lichid care iese din acest volum sau variatia temporala a concentratiei in orice punct al solutiei este proportionala cu variatia spatiala a gradientului de concentratie.
MACROMOLECULE BIOLOGICE
Datorita descoperirii ultracentrifugii, in 1933, de catre T.Svedberg s-a putut trece la studiul materiei vii la nivel molecular si macromolecular. Prin utilizarea unor metode moderne ale Biofizicii si Biochimiei, apare o noua stiinta, Biologia moleculara. Aceasta a deschis calea explicarii proceselor normale si patologice din organism, la nivel molecular.
In definirea unei macromolecule se accepta drept criteriu greutatea moleculara. Se considera compusi macromoleculari, substante a caror masa moleculara depaseste 5000u.
Macromoleculele sunt:
Proteine (heteropolimeri de aminoacizi)
Acizi nucleici (heteropolimeri de nucleotide)
Polizaharide
Lipide
Desi masele moleculare ale lipidelor individuale sunt mici (750 - 1500 daltoni) in comparatie cu celelalte clase de molecule, unele lipide se pot asocia spontan in structuri supramoleculare si uneori functioneaza in sisteme macromoleculare, putand fi considerate in mod arbitrar macromolecule.
Macromoleculele pot fi sintetizate natural (in celule) sau artificial, proces denumit polimerizare sau policondensare. De exemplu:
Prin polimerizarea sau policondensarea aminoacizilor se obtin polipeptidele;
Prin policondensarea glucozei rezulta polizaharide de tip celuloza sau amidon.
Se numesc polimeri compusii macromoleculari alcatuiti din grupe identicee de monomeri, care se repeta:
A-A-A-A-A..
Se numesc copolimeri compusii macromoleculari ai caror grupe de monomeri nu au o compozitie identica:
A-C-B-A-C-D-A-B-D-....
Biopolimerii sintetizati natural au aceeasi structura biochimica cu polimerii sintetizati artificial, dar se comporta diferit din punct de vedere biofizic. Acest comportament diferit confera biopolimerilor naturali proprietati biofizice diferite fata de polimerii artificiali, oferind posibilitatea mentinerii structurilor vii.
Tipuri fundamentale de biopolimeri:
Proteinele sunt macromolecule de mare complexitate alcatuite din aminoacizi. Cele mai importante proteine sunt:
Enzime: hidrolitice, de transfer, oxidaze, dehidrogenaze, etc.
Proteine de structura: keratina, colagen, fibre din testul conjunctiv.
Proteine respiratorii: hemoglobina, mioglobina
Proteine plasmatice: serumalbumine, globuline, fibrogen
Anticorpi: proteine formate ca reactie la antigeni
Hormoni
Proteinele din lapte: cazeina, lactoglobulina
Acizii nucleici sunt reprezentati de ADN ti ARN. Acestia alcatuiesc suportul informatiei genetice.
Polizaharidele servesc la stocarea glucozei, aliment de baza al celulei.
Lipidele ti in mod deosebit fosfolipidele membranelor celulare.
Clasificarea biopolimerilor
Dupa forma geometrica, polimerii pot fi:
Liniari
Ramificati
Spatiali
Dupa rolul biologic in organism, macromoleculele pot fi:
Biocoloizi: proteinele circulante din plasma si unele solubile din citoplasma
Macromolecule de structura
Macromolecule purtatoare de informatie.
Proprietati biofizice generale ale biopolimerilor
Macromoleculele participa structural la nivel de membrana celulara la realizarea opozitiei la difuzia libera.
Sub aspect morfologic, macromoleculele stau la baya structurilor supramoleculare.
Reactiile chimice in vivo au consum de energie mult mai mic decat in vitro datorita existentei enzimelor ca biocatalizatori.
Macromoleculele au capacitate ionformationala: cazul acizilor nucleici.
Organizarea structurala si conformationala a macromoleculelor biologice
Au fost puse in evidenta patru categorii de structura de baza a proteinelor:
structura primara se refera la secventa aminoacizilor in lantul polipeptidic (acizi aminati care se inlantuiesc in secvente bine determinate genetic. Proteinele sunt alcatuite din aminoacizi legati intre ei prin gruparile - COOH si -NH2 cu eliminarea unei molecule de apa pentru fiecare legatura).
structura secundara care consta in spiralarea sau plicaturarea lantului polipeptidic primar. Legaturile intermoleculare se realizeaza prin punti de hidrogen.
structura tertiara din indoirile structurii secundare si da forma moleculei proteice.
structura cuaternara este rezultatul asocierii specifice prin diferite tipuri de legaturi a mai multor structuri tertiare.
Configuratia acizilor nucleici
Acizii nucleici sunt macromolecule complexe. Indeplinesc in principal doua functii:
depoziteaza informatia genetica
participa la sinteza proteinelor
Acizii nucleici sunt reprezentati de:
ADN care este suportul informational ereditar
Conditii de formare a moleculelor
Molecula este o grupare de atomi ce formeaza o configuratie stabila datorita fortelor de interactiune dinte ei. Aceste forte de interactiune se numesc forte interatomice. Fortele care se exercita intre molecule poarta numele de forte intermoleculare. Fortele interatomice si intermoleculare deriva din faptul ca toti atomii contin sarcini electrice de semne contrare. Fortele de deyvoltare sunt de natura electrostatica.
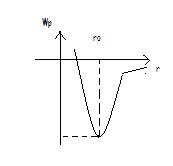
Conditiile de formare a moleculei se realizeaza cand fortele de atractie dintre atomi sunt egale cu cele de respingere, iar energia potentiala este minima.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3963
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved