| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
VITAMINELE, APA SI MINERALELE
1 Vitaminele
Vitaminele sunt substante organice pe care tesuturile umane nu le pot sintetiza si de aceea trebuie procurate din ratia alimentara.
Desi pentru implinirea tuturor rolurilor functionale ale vitaminelor organismul omului are nevoie de cantitati foarte mici (cateva miligrame sau chiar micrograme pe zi), ratia alimentara trebuie sa le procure regulat. Altfel, ajung sa se declanseze anumite stari patologice specifice, numite avitaminoze.
Vitaminele si derivatii lor au uneori rolul de cofactori pentru enzime si se numesc coenzime.
Clasificarea vitaminelor se face conventional, dupa o proprietate fizica, solubilitatea:
-vitamine hidrosolubile, cu molecule polare, solubile in apa (vitaminele din complexul B - B1 -tiamina, B2-riboflavina, B6-piridoxina, PP- niacina, B12- ciancobalamina, acidul folic, biotina, acidul pantotenic - si vitamina C- acidul ascorbic).
Ele sunt aproape toate cofactori ai sistemelor enzimatice sau precursori ai cofactorilor.Se sintetizeaza in plante si deci se procura din legume.
-vitamilele liposolubile cu molecule apolare, solubile in grasimi (vitaminele A, D, E, K); dupa absorbtie sunt transportate prin intermediul chilomicronilor (lipoproteine) in ficat (A,D,K) sau in tesutul adipos (E). Ele trec in sange prin intermediul lipoproteinelor si cu ajutorul bilei ajung in intestin.
vezi tabel 1. si 2. de la sfarsitul cursului.
2 Apa si mineralele
2.1 Apa
Apa este un compus chimic al hidrogenului si al oxigenului, avand formula chimica bruta H2O.
Din punct de vedere biologic, apa are numeroase proprietati indispensabile proliferarii vietii, care o deosebesc de celelalte substante.
Proprietatile fizico-chimice ale apei :
Apa are o serie de proprieteti fizico-chimice cu totul remarcabile si care o singularizeaza fata de celelalte fluide, facand-o un lichid aparte.
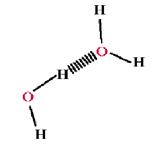
1. Polaritatea, legatura de hidrogen si asocierile moleculare:
Molecula de apa (H2O) este formata dintr-un atom de oxigen legat prin legaturi covalente de doi atomi de hidrogen.
Atomul de oxigen fiind puternic electronegativ va atrage electronii atomilor de hidrogen angajati in legatura electronica. Din punct de vedere electric, molecula de apa este neutra dar distributia electronica in cuprinsul ei se face neuniform. Intr-adevar, oxigenul - cu cei 8 protoni in nucleul sau - atrage mai puternic electronii de legatura decat atrage unicul proton din nucleul atomului de hidrogen.Altfel spus, regiunea oxigenului este relativ bogata in electroni (deci negativa), pe cand regiunea atomilor de hidrogen- practic, lipsiti de invelis electronic - este pozitiva. Datorita acestui caracter, mult mai electronegativ al oxigenului, legatura O−H este polara. Aceasta separare a sarcinilor da nastere unui dipol electric permanent.
La apropierea a doua molecule de apa ia nastere o atractie electrostatica intre sarcina negativa a oxigenului uneia din molecule si sarcina partial pozitiva a unui hidrogen al moleculei vecine.Astfel se produce o redistribuire a incarcaturii electronice a ambelor molecule, atractia dintre ele creste foarte mult, fenomene ce duc la formarea unei legaturi mai slabe decat cea covalenta, legatura de hidrogen. Legaturile de hidrogen sunt intra- si intermoleculare.
Desi, individual, legatura de hidrogen este o legatura slaba, ea participa- in numar mare si cu rol hotarator - la stabilitatea structurala a multor constituenti importanti ai organismului (proteine, acizi nucleici) precum si ai unor metaboliti.
Asa dar, apa devine cel mai bun si important dizolvant. Ea dizolva atat electrolitii (acizi, baze, saruri) cat si substante neionizate (anorganice sau organice).
2. Caldura specifica si caldura de vaporizare:
Apa poate primi sau ceda o cantitate apreciabila de caldura, fara a-si schimba simtitor propria sa temperatura.Aceasta se numeste caldura specifica sau capacitae termica.
Pentru organismul viu este foarte util faptu ca apa are capacitate termica mare. Intr-adevar, daca in mediul intern nu ar fi apa care sa inmagazineze o cantitae mare de caldura fara a-si schimba temperatura, caldura eliberata in numeroase reactii metabolice ar determina denaturarea multor macromolecule celulare (proteine, enzime, acizi nucleici), ceea ce ar antrena pierderea unor functii biologice importante.
Apa are si o mare caldura de vaporizare. Aceasta este cantitate de caldura necesara transformarii apei lichide in vapori, la o temperatura data(100ºC ).
Evaporarea apei prin piele si prin mucoasa cailor respiratorii face se piarda o anumita parte din caldura corpului. In caz de efort, pierderile de apa prin transpiratie sunt foarte importante. Prin urmare, supraincalzirea corpului este preintampinata de caldura mare de vaporizare a apei.Acest fapt contribuie la asigurare desfasurarii normale a proceselor biologice din organism.
3. Caldura de topire, punctul de topire si punctul de fierbere:
Apa are o caldura de topire apreciabila, aceasta se explica prin faptul ca la schimbarea starii fizice din solida in lichida (topirea ghetii) este nevoie de energie calorica (caldura) luata din mediul inconjurator.Punctul de topire al apei este 0ºC. Punctul de ferbere este 100 ºC. Deci apa la temperatura obisnuita se afla in stare lichida si nu in stare de vapori, ca ceilalti dihidrati analogi.(H2S, H2Se, H2Te). Insusirea de a fi lichida ii confera -in primul rand- rolul de mediu intern, in toate organismele.
4. Ionizarea, produsul ionic si pH-ul apei:
Conductibilitatea electrica a apei se datoreste faptului ca o parte din moleculele ei sunt ionizate. Deoarece in mediu apos ionul H+ nu este liber ci atasat unei molecule de apa - ionizarea apei poate fi scrisa conform ecuatiei:
2H2O ↔ H3O+ + OH-
Este de notat ca protonul hidratat se reprezinta in scris fie ca H3O+, fie ca H+ intelegandu-se ca ionul de hidrogen se afla in apa sub forma hidratata.
Ecuatiei reversibile de ionizare a apei ii corespunde o constanta de echilibru, data de expresia:
[H+] [OH-]
Kech = ――――― (prin ionizare apa nu-si schimba concentratia)
[H2O]
10-14 == [H+] [OH-]
Kw= [H+] [OH-] = 10-14 (aceasta expresie se numeste produsul ionic al apei)
Deoarece la temperatura de 25 ºC produsul ionic al apei are valoarea 10-14 , inseamna ca in apa pura la de 25 ºC concentratia ionilor de hidrogen, egala cu cea a ionilor hidroxil, este 10-7 ion gram/litru:
[H+] = [OH-]=10-7
Aciditatea unei solutii este caracterizata cantitativ de concentratia ionilor de H+ din solutie iar alcalinitatea (bazicitatea) de concentratia ionilor de OH- .
Insa datorita relatiei data de produsul ionic al apei se poate caracteriza si bazicitatea tot cu ajutorul concentratiei ionilor H+. Si anume:
in solutii acide : [H+]>10-7
in solutii neutre: [H+]=10-7
in solutii alcaline: [H+]<10-7
S-a convenit pentru precizarea reactiei solutiilor in locul concentratiei [H+] sa se foloseasca logaritmul sau cu semn schimbat, desemnat cu simbolul: pH. ("produs hidrogenii" = puterea hidrogenului).
Asa dar: pentru solutii acide pH<7
pentru solutii neutre pH=7
pentru solutii bazice pH>7
Multe procese biochimice din organism depind de concentratia ionilor de pH. Astfel, transportul oxigenului in sange, reactiile chimice catalizate de enzime, generarea energiei metabolice in cursul respiratiei sunt numai cateva exemple din multitudinea fenomenelor si proceselor biochimice care depind de pH-ul mediului intern.
Apa este principalul constituent al tuturor fiintelor vii si implineste roluri fundamentale:
-rol structural :intra in structura tesuturilor.Apa si produsii ei de ionizare determina structura si proprietatile biologice ale multor macromolecule din celule ca: proteine, acizi nucelici, ale membranelor, ribozomilor si altele.O parte din apa este distribuita in spatiile libere dintre moleculele mari (in genere proteice) iar o parte este retinuta la suprafata macromoleculelor, ca "apa legata".
-participa la reactiile biochimice fundamentale (digestie, reactii redox, reactii in urma carora se elibereaza enerie, etc.), fie avand rol de reactant, fie rol de produs de reactie
-este mediu transportor al proceselor intra- si extra- celulare, fiind solventul multor ioni si molecule, transportand in organism atat substantele nutritive cat si produsii de excretie ai diverselor metabolisme;
-echilibreaza temperatura corpului prin eliminarea sa;
-este aliment indispensabil ce asigura desfasurarea normala a metabolismului tuturor celorlalte principii nutritive..
2.2
Mineralele
Organismul uman contine multe elemente chimice dar dintre ele doar unele prezinta importanta fiziologica sau biochimica demonstarata pana in prezent. In afara componentilor majoritari ai moleculelor corpului ce apar in organism prin ingerarea apei si alimentelor continand glucide, proteine si lipide, se mentioneaza si mineralele nutritionale importante structural si functional, cerute zilnic in ratia alimentara si anume:Ca, P,Mg, Na, K, Cl.
In organism mai exista si alte elemente (oligoelemente) aflate in cantitate mica in hrana, necesare nutritiei omului dar fara functii esentiale si elemente toxice.
Mineralele organismului formeaza, cu exceptia Na, si K, saruri sau alti compusi putin solubili. Absorbtia lor se face astfel dificila si in acest scop se implica proteine specifice de transport. Acestea sunt utile atat pentru transportul mineralelor in sange, cat si pentru depozitarea lor in organism. Excretia mineralelor se face prin urina, sucuri digestive, bila si prin scaun.
Cantitatea de elemente minerale necesara zilnic este acoperita in majoritatede alimentatie. Valoarea concentratiei unui element in sange nu reflecta totdeauna cantitatea ingerata deoarece absorbtia si excretiaacestuia sunt dependente de o serie de factori. Totusi, evaluarea nivelului uinui element mineral permite cunoasterea echilibrului intre cantitatea sa absorbita, consumata si depozitata.
Deficientele unui element mineral sunt de obicei secundare si au drept cauza afectarea absorbtiei sale sau pierderi excesive. Ingerarea in exces a unui element conduce la simptome toxice.
vezi tabel 3.si 4.de la sfarsitul cursului
Nevoia organismului de apa si saruri
Aportul zilnic al unei cantitati de apa este indispensabil vietii.
Nevoile sunt evaluate in functie de eliminare care variaza si ea in functie de conditiile exterioare, sau de conditiile patologice.
Nevoia (in medie) de apa la un adult este de 2 litri/24 ore, adica in jur de 30 ml/kg corp.
Este mai ridicata la un copil:
-180 ml/kg corp pentru nou nascut
-125 ml/kg corp la 6 luni
-100 ml/kg corp la 1 an.
Nevoia de saruri este de ordinul:
-4 la 6 g/24h pentru sodiu si cloruri;
-3 la 4 g/24h pentru potasiu.
Aportul de saruri:
Pe langa sarea utilizata in bucatarie si alte asezonari, apa potabila aduc:
-saruri minerale alcaline (NaCl, KCl);
-saruri alcalinoteroase (bicarbonat de calciu si magneziu);
-iod sub forma de ioduri.
Vegetalele, fructele, laptele aduc si ele un aport de numerosi anioni si cationi.
In practica, alimentatia normala aduce un aport suficient de sare (9 la 15 g/24h) si n-ar fi necesara sararea alimentelor.Anumite alimente sunt sarace in NaCl, ca de exemplu orezul, si sunt utilizate in regimurile desodate (fara sare).
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1019
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved