| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Caldura de reactie. Legea lui Hess
Sistemele in care decurg reactii chimice se conformeaza conditiei ca lucrul (de presiune) schimbat sa fie nul la volum constant, sau sa admita un potential la presiune constanta. Cantitatea de caldura in aceste doua procese nu depinde de drumul urmat, adica de natura reactiilor si combinatiilor intermediare, de transformarile lor fizice sau de timpul de reactie, ci numai de starea initiala si finala a sistemului (legea lui Hess).
Pentru V = const, W = 0 si QV = ∆U (XII.1)
Pentru p = const, W = - p ∆V si Qp = ∆H = ∆U + p ∆V (XII.2)
In cazul cand in sistem are loc o reactie chimica, pe linga T, p si V trebuie sa se introduca o noua variabila de stare, gradul de avansare al reactiei λ (v. cap. IV). Astfel, in variabile normale:
U = U(T, V, λ) si H = H(T, p, λ)
de unde, prin diferentiere, se obtine:
![]()
si
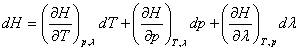
Caldurile de reactie la volum constant, respectiv presiune constanta, sunt definite deci, prin relatiile:
![]() si
si ![]()
si au semnififcatia unor "calduri latente", deci reprezinta caldura schimbata necesar pentru ca temperatura sa ramana constanta, la volum sau presiune constanta. In reactiile exoterme ∆H si ∆U < 0, iar in reactii endoterme ∆H si ∆U > 0. Valoarea se refera la unitatea de reactie (variatia cu o unitate a gradului de avansare al reactiei).
In acest manual se utilizeaza notatia exemplificata prin urmatoarea ecuatie termochimica:
C(grafit)
+ O2(g) = CO2(g); ![]()
care arata ca entalpia de reactie (caldura de reactie la presiune constanta) este -94,03 kcal pentru combinarea a 1 mol O2 gaz perfect la 1 at cu 1 atom-g grafit pentru a forma 1 mol CO2 gaz perfect la 1 at, la 298,16 K.
In general, pentru o reactie:
![]()
caldura de rectie se obtine prin diferenta:
![]() (XII.3)
(XII.3)
si deoarece se pot masura numai variatiile de entalpie, se alege conventional ca stare standard pentru elemente, starea de element in forma stabila la 1 at si temperatura obisnuita careia, prin conventie, i se atribuie o entalpie nula. Toate combinatiile vor fi caracterizate prin entalpia standard de formare din elemente in starea lor standard. Prin conventie, pentru toate gazele, starea standard este starea de gaz perfect la 1 at
Temperatura de referinta a datelor termodinamice este 25 ºC = 298,16 K.
Entalpiile de formare ale ionilor se refera la solutii apoase cu activitate egala cu unitatea (v. cap. XIX) si se determina fata de entalpia de formare a ionului hidrogen in solutie apoasa diluata H+ (aq) careia, prin conventie, i se atribuie valoarea zero.
Pornind de la entalpiile de formare ∆HA si ∆HB ale substantelor A si B care iau parte la reactie, se calculeaza entalpia de reactie potrivit legii lui Hess:
![]() (v. si ecuatia
(XII.3)) (XII.4)
(v. si ecuatia
(XII.3)) (XII.4)
Exemplul 1. La 20 ºC
si la 1 at, ∆H pentru C + O2
= CO2 este -94,20 kcal si pentru ![]() este -67,65 kcal.
este -67,65 kcal.
Sa se calculeze entalpia de formare, in aceste conditii,
a oxidului de carbon, conform reactiei: ![]() .
.
Rezolvare:
Primele doua reactii sunt studiate in calorimetru, pe cand reactia a treia, din cauza excesului de oxigen, nu se poate studia.
Considerand transformarea C + O2 = CO2 realizata in doua moduri:
a) direct C + O2 = CO2; ΔH1 = -94,20 kcal;
b) in doua etape:
![]() ; ΔH2 = x
; ΔH2 = x
si
![]() ; ΔH3 = -67,65 kcal
; ΔH3 = -67,65 kcal
conform legii lui Hess rezulta ΔH1 = ΔH2 + ΔH3, de unde ΔH2 = x = ΔH1 - ΔH3 = -94,20 + 67,65 = -26,55 kcal.
Exemplul 2 Caldurile de neutralizare ale acizilor HA si HB sunt 13,650 kcal mol-1, respectiv 11,200 kcal mol-1 la 25 oC. Prin adaugare de 1 mol NaOH in solutia diluata ce contine 1 val (echivalent-gram) HA si 1 val HB se degaja 12,960 kcal.
Sa se compare cei doi acizi.
Rezolvare:
Notand cu n fractiunea de NaOH care s-a repartizat acidului HA, se poate scrie ecuatia:
nHA(aq) + nNaOH(aq) = nNaA(aq) + nH2O(l);
ΔH1 = -n 13,650 kcal
De asemenea:
(1 - n)HB(aq) + (1 - n)NaOH(aq) = (1 - n)NaB(aq) + (1 - n)H2O(l);
ΔH2 = -(1 - n) 11,200 kcal
Rezulta:
n 13,650 + (1 - n) 11,200 = 12,960
de unde n = 0,72 si 1 - n = 0,28.
Repartizarea bazei in cei doi acizi HA si HB se face in
raportul ![]() .
.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4123
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved