| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Apa
Sursa vietii
Stare naturala. Apa este una din cele mai raspandite substante in natura, gasindu-se in toate cele trei stari de agregare: solida (gheata, zapada, grindina, chiciura), lichida (apa de ploaie, ape subterane, oceane, mari, fluvii, rauri, lacuri, balti etc.) si gazoasa (vaporii de apa din atmosfera si emanatiile vulcanice).
In natura nu exista apa pura. Apele naturale contin dizolvate cantitati variate de diferite substante.
APA, H2O, masa mol. 18,02, lichid incolor, de culoare albastra-verzuie in straturi groase. Are structura unghiulara (A 104,5), care in realitate este pseudo-tetraedrica, rezultata prin hibridizare sp3, molecula de apa dispunand de doi orbitali hibrizi ocupati cu cate o pereche de electroni neparticipanti.
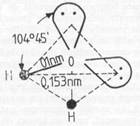 Compozitia a
fost stabilita in perioada 1871-1905 prin experientele lui
Macquer, Cavendish, Lavoisier, Laplace si altii.
Compozitia a
fost stabilita in perioada 1871-1905 prin experientele lui
Macquer, Cavendish, Lavoisier, Laplace si altii.
Hidrogenul si oxigenul avand mai multi izotopi, apa obisnuita contine in proportie mica si combinatiile reciproce ale acestora : H216O ; H217O ; H218O ; HD16O ; HD17O ; HD18O; D216O ; D217O ; D218O si T2O. Prezinta un pronuntat moment electric de dipol 1,84, fiind un bun solvent, capabil sa functioneze ca donor de electroni. Daca in stare de vapori apa este formata din molecule neasociate, in stare lichida si in gheata, ele sunt asociate prin legatura de hidrogen. Gheata cristalina are o structura afinata, cu simetrie hexagonala, analoga cu a β-tridimitului, in care orice molecula de apa este coordinata de alte patru molecule de apa, respectiv fiecare atom de oxigen este inconjurat tetraedric de alti patru atomi de oxigen intocmai ca atomii de carbon in diamant.
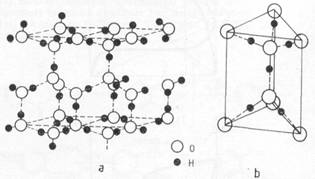
Structura cristalina cu simetrie hexagonala a ghetii (a) si coordinarea tetraedrica a atomilor de oxigen in gheata (b).
Totodata, fiecare atom de oxigen al unei molecule de apa este legat covalent de doi atomi de hidrogen ai moleculei proprii si de alti atomi de hidrogen proveniti din doua molecule diferite, prin legaturi de hidrogen. Apa prezinta o serie de proprietati anormale datorita asocierii moleculelor prin legaturi de hidrogen. Astfel, densitatea apei in loc sa scada continuu cu temperatura, asa cum se intampla la celelalte lichide, are valoarea maxima la 4C si anume egala cu unu. La 0 C, apa se solidifica marindu-si volumul (d.0,9168) cu 9% fiind mai usoara decat apa lichida, pe care pluteste. Valoarea mica a densitatii ghetii este atribuita structurii afinate a retelei cristaline. Drept consecinta, sub 4C, apa racita ingheata, se ridica la suprafata sub forma unui strat protector fata de temperatura exterioara, facand posibila viata acvatica. Apa trece in stare de vapori la 100C marindu-si volumul de ~1700 ori. Intervalul de temperatura anormal de mare in care apa se afla in faza lichida (0C - 100C) este atribuit, de asemenea, asocierii moleculelor de apa, respectiv legaturilor de hidrogen. Cele doua puncte extreme ale apei, de solidificare, respectiv de fierbere la presiune normala, constituie temperaturile 0C si 100C in scara termometrica in grade Celsius. Caldura specifica mare a apa (4,18 J-g-1) are un rol regulator asupra temperaturii apa, deoarece temperatura lacurilor si marilor se schimba mai lent decat a solului. Caldura latenta de vaporizare este anormal de mare : 40,7 kj mol. Apa se dovedeste un lichid putin compresibil, prezentand un minim la presiuni joase. In stare pura, ca urmare a unei ionizari proprii extrem de reduse, apa are o conductibilitate electrica mica :
![]()
H20 ![]() H+ + OH- ; K =
1,04-10-11 la 25C
H+ + OH- ; K =
1,04-10-11 la 25C
Din aceasta cauza, apa pura este greu de electrolizat in schimb, ea are o constanta dielectrica mare ( ε 81), fapt care-i confera excelente proprietati ionizante si de dizolvant, fiind unul din cei mai importanti dizolvanti pentru electroliti si chiar pentru combinatii nepolare anorganice si organice.
Solubilitatea substantelor in apa se datoreste fie existentei in molecula acestora de grupe OH capabile sa formeze legaturi de hidrogen cu moleculele de apa, fie caracterului polar al unor ioni apti a se inconjura cu molecule de apa prin forte ion-dipolice. Conductibilitatea termica a apei este mica, de cca 100 ori mai mica decat a argintului, apa fiind totusi un conductor termic mai bun decat multe lichide organice. Molecula de apa, datorita caracterului puternic exoterm, este atat de stabila, incat abia se disociaza 10% prin ridicarea temperaturii la 2500C. Spre deosebire de oxigen, azot, iod, seleniu, telur, arsen si stibiu, care nu reactioneaza cu apa, numeroase elemente nemetalice sau metalice descompun apa la diferite temperaturi. Astfel, clorul reactioneaza la intuneric, bromul la lumina, sulful la fierbere, fosforul la 250C, borul, carbonul si siliciul la rosu. Corespunzator cu pozitia lor in seria tensiunilor electrochimice, metalele reactioneaza foarte diferit cu apa asemanator reactiei acestora cu acizii minerali. Spre deosebire de metalele alcaline care reactioneaza violent cu apa la rece, cu degajare de hidrogen, magneziul reactioneaza numai la 100C, iar fierul la 800C. in contact cu oxizii unor nemetale sau cu oxizi ai unor metale plurivalente in stari de oxidare superioare, apa formeaza acizi, iar cu oxizii metalelor alcaline si alcalino-pamantoase (exceptie beriliul), baze. Unele carburi, siliciuri, azoturi, fosfuri, arseniuri, sulfuri, selenuri, telururi reactioneaza cu apa cu formare de hidroxizi metalici si degajare de compusi hidrogenati corespunzatori. Sarurile provenite dintr-un acid tare cu o baza slaba hidrolizeaza sub actiunea apei, cu caracter acid, iar cele ale unui acid slab cu o baza tare, cu caracter bazic. Apa are proprietatea de a cataliza numeroase reactii, cum sunt cele ale halogenurilor cu oxigenul, a hidrogenului sulfurat cu oxizii de azot, a hidrogenului cu clorul la lumina si altele. Substantele capabile sa fixeze un numar de molecule de apa si avand o compozitie chimica definita se numesc hidrati
Apa ca solvent Apa este cel mai important dintre toti solventii utilizati in tehnica sau aparand in natura. Apa dizolva electroliti (acizi, baze si saruri), formand solutii in care acesti compusi sunt ionizati. De asemenea apa dizolva numeroase substante, atat anorganice cat si organice, care contin atomi capabili de a forma legaturi de hidrogen cu moleculele H2O.
Numeroase reactii au loc in solutie apoasa. Printre acestea au o deosebita, insemnatate reactiile biochimice din organismele vii, care la un loc constituie viata.
Solvatare. Hidratare. Solubilitatea se datoreste formarii unor legaturi slabe, intre moleculele schitului si ale solventului. Fenomenul se numeste solvatare, iar cand solventul este apa, hidratare. Hidratarea se datoreste fie formarii unor legaturi de hidrogen, in cazul substantelor neionizate, fie unor atractii ion-dipoli; cand solutul este compus din ioni.
In solutiile compusilor ionici, ionii de semn contrar raman, intr-o mare masura, despartiti (nu formeaza perechi sau asociatii de ioni), in primul rand din cauza constantei dielectrice mari a apei. Acesta nu este insa singurul factor care determina solubilitatea mare a electrolitilor in apa. Unele lichide a caror constanta, dielectrica este mai mare decat a apei nu sunt solventi buni pentru electroliti. Solubilitatea in apa a compusilor ionici este determinata de puterea mare a acesteia de a solvata ionii. Fiecare ion se inconjoara de-o atmosfera de molecule de apa. Moleculele apei, datorita momentului lor electric (μ = l,84 D) sunt orientate, in cazul cationilor, cu oxigenul (polul negativ) spre ion, iar in cazul anionilor cu un atom de hidrogen spre ion, in aceste interactiuni solut-solvent, se degaja calduri de hidratare considerabile; de acelasi ordin de marime cu energiile de retea .
Un ion se solvateaza cu atat mai puternic (numarul de molecule legate si caldura degajata sunt cu atat mai mari) cu cat volumul ionului este mai mic si sarcina electrica mai mare.
Numarul de molecule de apa, legate de fiecare ion dizolvat, poate fi evaluat cu oarecare aproximatie din experiente de transport al ionilor in electrolize. Urmatoarele date sunt bazate pe masuratori de acest fel:
Ionul: Li+, Na+, K+, NH4+, OH3+, Mg2+, Ca2+, Sr2+, Ba2+, Cl-, Br-, I-
Molecule H2O
legate de un ion: 8 4 4 14 10 8 2 2 3
Hidratii. Apa de cristalizare. Metoda curenta pentru purificarea substantelor solide consta in cristalizarea dintr-un solvent. Din apa substantele se depun fie anhidre, fie sub forma de cristale continand apa de cristalizare. Asemenea substante se numesc hidrati. Din apa cristalizeaza anhidre relativ putine substante (de ex. unele halogenuri, ca NaCl, NaBr, KI, CsI, substante organice ca zaharoza etc.). Majoritatea electrolitilor si chiar multe substante neionice, anorganice si organice, formeaza hidrati.
Se disting trei mari categorii de hidrati: hidratii electrolitilor (acizi, baze, saruri); hidratii gazelor (stabili de obicei numai sub presiune; v. mai departe) si hidratii compusilor formati din ioni de dimensiuni foarte mari (anioni sau amfioni macromoleculari). Hidratii din primele doua clase (singurii de care ne ocupam aici) au compozitie stoechiometrica definita si constanta. Acesti hidrati sunt compusi chimici stabili numai in stare solida. Prin indepartarea apei, reteaua cristalina se prezinta; se formeaza substante anhidre a caror retea nu are nici o legatura cu reteaua cristalina a hidratului.
Moleculele de apa de cristalizare fac parte integranta din retelele cristaline ale hidratilor. Hidratii compusilor macromoleculari (cum sunt unii silicati si proteinele) includ apa in interstitiile retelei lor, care in unele cazuri se dilata, fara a se modifica esential.
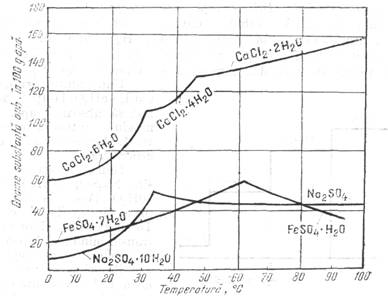 Hidratii ca
substante definite, Sulfatul de
sodiu cristalizeaza din solutii saturate, la temperaturi mai joase
decat 32,383, cu zece molecule de apa de cristalizare: Na2SO4
. 10 H20. Deasupra acestei temperaturi cristalizeaza Na2S04
anhidru. La temperatura indicata mai sus decahidratul, sulfatul anhidru,
solutia saturata si vaporii de apa sunt in echilibru. Solubilitatea sulfatului
de sodiu creste cu temperatura, fiind maxima; anume 33,2% (cea. 50g substanta
anh. in 100 g H2O) la 32,383; ea scade apoi incet cat temperatura.
Punctul de solubilitate maxima, intr-o diagrama solubilitate-temperatura,
reprezinta o discontinuitate ce delimiteaza domeniul de stabilitate al
decahidratului si cel al sulfatului anhidru
Hidratii ca
substante definite, Sulfatul de
sodiu cristalizeaza din solutii saturate, la temperaturi mai joase
decat 32,383, cu zece molecule de apa de cristalizare: Na2SO4
. 10 H20. Deasupra acestei temperaturi cristalizeaza Na2S04
anhidru. La temperatura indicata mai sus decahidratul, sulfatul anhidru,
solutia saturata si vaporii de apa sunt in echilibru. Solubilitatea sulfatului
de sodiu creste cu temperatura, fiind maxima; anume 33,2% (cea. 50g substanta
anh. in 100 g H2O) la 32,383; ea scade apoi incet cat temperatura.
Punctul de solubilitate maxima, intr-o diagrama solubilitate-temperatura,
reprezinta o discontinuitate ce delimiteaza domeniul de stabilitate al
decahidratului si cel al sulfatului anhidru
O comportare similara cu a sulfatului de sodiu prezinta sulfatul feros cu deosebirea ca faza stabila peste punctul de transformare nu este sulfatul anhidru, ci monohidratul, FeSO4 . H2O. Clorura de calciu, CaCl2, formeaza hidrati cu 6, 4, 2 si l molecula H2O, fiecare din ei fiind stabil intr-un anumit domeniu de temperatura.
In natura, atmosfera contine vapori de apa in concentratii ce variaza cu temperatura si presiunea. Acestia provin in majoritate din evaporarea marilor si oceanelor si in mica parte, din evaporarea ghetarilor. Vaporii de apa din atmosfera se condenseaza sub forma de nori, ceata, ploaie, grindina sau zapada, cand este atinsa presiunea de saturatie la temperatura respectiva si sub forma de roua, bruma sau chiciura, cand condensarea apei are loc heterogen, pe suprafete reci (apa meteorica).
Hidrosfera. Din suprafata totala (de 5,1 . 108 km2) a globului
pamantesc 71% (sau 3,62 . 108
km2) este ocupata de mari si oceane. Din suprafata
uscatului (1,48 . 108 km2),
putin mai mult de 10% (1,58 . 107 km2) este acoperita cu ghetari.
Volumul marilor si oceanelor este evaluat la 1,37 . 109 km3.(cca. 1/800 din volumul planetei). Volumul ghetarilor din regiunea arctica si antarctica este apreciat la 2,9 . 107 km3. La polul sud grosimea ghetii este de 2700 m, iar in punctul cel mai adanc al continentului antarctic atinge 4200 m. S-a sapat acolo, intr-un loc, o sonda pana la roca de baza la 2187 m, gasindu-se la fund apa lichida. Daca toti ghetarii s-ar topi, nivelul oceanelor s-ar ridica cu cca. 80 m.
Prin cantitatea mare de apa din straturile sale exterioare pamantul se deosebeste fundamental de celelalte planete, care sunt sarace in apa sau lipsite de apa.
Apa oceanelor contine in medie 35 g saruri la litru (din care 27 g sunt NaCl). Marile interioare au concentratii in saruri fie mai mari (Marea Mediterana) fie mai mici (Marea Neagra, cu cca. 17,7 g saruri la litru, din care 14 g NaCI) decat apa oceanelor, in tabelul este redata lista celor 20 elemente mai abundente din apa de ocean. Afara de acestea au mai fost identificate in apa de mare cca. 50 elemente, in concentratii mici sau foarte mici. Cu alte cuvinte toate elementele continute in scoarta pamantului apar si in apa de mare.
Tabel Elemente in apa de ocean (in mg/l)
Clor Bor
Sodiu Siliciu
Magneziu l 300 Fluor
Sulf Azot
Calciu Argon
Potasiu Litiu
Brom Rubidiu
Carbon. Fosfor
Oxigen 8 Iod
Strontiu 8 Bariu
In afara de cele enumerate mai sus, oceanul contine si aproape toate celelalte elemente chimice, dar in cantitati si mai mici. De exemplu, intr-o tona de apa de mare, sunt continute 0,000004 g de aur. Dupa cum se vede din tabela, in apa oceanului sunt putine saruri de potasiu in comparatie cu cele de sodiu. Acest lucru este determinat de faptul ca primele sunt mult mai puternic retinute de sol. Aceasta din urma circumstanta este de o mare importanta pentru viata plantelor de pe suprafata solului, deoarece sarurile de potasiu le sunt mult mai necesare decat cele de sodiu. Partile cele mai greu solubile ale apei de mare sedimenteaza permanent pe fundul oceanului.
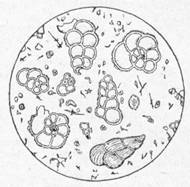 S-a calculat ca in fiecare an sedimenteaza, in acest fel,
aproape 2300 milioane tone de saruri, din care partea principala revine
carbonatului de calciu. De aceea se formeaza zacaminte masive de calcar si
creta, care reprezinta o aglomeratie de ramasite microscopice, cochiliile
infuzorilor de mare, care si-au cladit locuinta din carbonatul de calciu
dizolvat in apa (fig. alaturata). Aceste zacaminte se pot forma
insa numai in partile putin adanci ale oceanului, deoarece la adancimi
mari, ca urmare a cresterii continutului de gaz carbonic dizolvat, CaCO3
g precipitat, se dizolva din nou. In locuri adanci, fundul oceanului este
acoperit cu o specie de argila rosie, care s-a format probabil din cenusa
eruptiilor vulcanice, cat si a prafului cosmic care cade pe pamant din spatiul
interstelar. In urma cutremurelor si altor cataclisme geologice, marile si-au
schimbat de multe ori configuratia in decursul istoriei pamantului.
S-a calculat ca in fiecare an sedimenteaza, in acest fel,
aproape 2300 milioane tone de saruri, din care partea principala revine
carbonatului de calciu. De aceea se formeaza zacaminte masive de calcar si
creta, care reprezinta o aglomeratie de ramasite microscopice, cochiliile
infuzorilor de mare, care si-au cladit locuinta din carbonatul de calciu
dizolvat in apa (fig. alaturata). Aceste zacaminte se pot forma
insa numai in partile putin adanci ale oceanului, deoarece la adancimi
mari, ca urmare a cresterii continutului de gaz carbonic dizolvat, CaCO3
g precipitat, se dizolva din nou. In locuri adanci, fundul oceanului este
acoperit cu o specie de argila rosie, care s-a format probabil din cenusa
eruptiilor vulcanice, cat si a prafului cosmic care cade pe pamant din spatiul
interstelar. In urma cutremurelor si altor cataclisme geologice, marile si-au
schimbat de multe ori configuratia in decursul istoriei pamantului.
Metalele sunt continute in apa de mare sub forma de cationi (Na+, Mg2+, Ca2+ etc.) halogenii sub forma de anioni (Cl-, Br- etc.), sulful ca ioni de sulfat (SO42-), iar carbonul sub forma de CO2 si de ioni de carbonat acid (HCO3-).
Apa izvoarelor si a marilor. Apa meteorica,
o data ajunsa pe pamant,
poate strabate prin straturi permeabile (humus, nisip) pana ajunge la o patura
impermeabila
(argila), deasupra careia formeaza o panza de apa subterana
(apa
freatica). Apa subterana reapare, la suprafata, in izvoare, sau este
extrasa,
prin
fantani, puturi sau sonde.
Compozitia chimica a acestei ape variaza cu natura rocilor cu care a fost in contact. Cel mai scazut continut in, substante minerale dizolvate il are apa izvoarelor de munte (cca. 50 mg materii solide la litru) si aceea provenita din topirea ghetarilor. Apele freatice au de obicei un continut mai mare in substante minerale (normal cca. 2 g/1), iar in apele raurilor se mai gasesc si substante minerale suspendate si materii organice.
Apa izvoarelor si a raurilor contine, dizolvate, gazele din aer: oxigen, azot si bioxid de carbon; cationi: calciu, magneziu si sodiu si anioni de bicarbonat, sulfat si clorura. O apa cu un continut mare de bicarbonat de calciu, o apa dura, nu face spuma cu sapunul si depune carbonat de calciu la fierbere (formarea de cruste in cazanele de aburi). O apa subterana bogata in bicarbonat de calciu degaja, cand iese la aer, CO3 si depune carbonat de calciu (formarea stalactitelor; despre echilibrul: carbonat bicarbonat de calciu). Apa raurilor este din ce in ce mai mult poluata, cu deseuri industriale. Acestea au o influenta nociva asupra animalelor si plantelor acvatice. Purificarea apelor reziduale industriale este una din problemele importante ale vremurilor noastre.
Apa buna de baut trebuie sa indeplineasca urmatoarele conditii: sa fie limpede, incolora, fara miros; sa fie bine aerata; sa aiba o temperatura de 7-15C; sa contina dizolvate mici cantitati de saruri, mai ales clorura de sodiu si bicarbonat de sodiu; sa nu contina bacterii patogene.
Centrele populate folosesc ca apa de spalat si baut apa din rauri, purificata in instalatii speciale. Apa de rau este adusa cu pompa 1 in vasul cu agitator 2, in care se introduc cantitati mici de sulfat
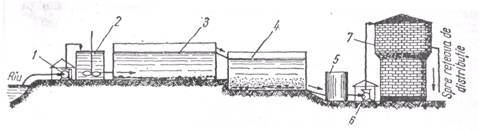
Schema instalatiilor de purificarea apei de rau.
de aluminiu, care reactioneaza cu apa, cand un precipitat voluminos de hidroxid de aluminiu 3 De aici, apa este filtrata prin filtrul 4, constituit din straturi de pietris. Hidroxidul de aluminiu antreneaza suspensiile ce se gasesc in apa si le depune in bazinul de sedimentare si nisip, si apoi trecuta in vasul de clorurare 5, pentru distrugerea bacteriilor patogene. Cu ajutorul pompei 6, apa este acumulata in castelul de apa 7.
Apele minerale sunt ape naturale subterane, mai rar superficiale, termale sau atermale, cu un continut variabil de saruri, de gaze sau de substante minerale radioactive, caracterizate prin proprietati terapeutice.
Dupa natura substantelor continute, apele minerale pot fi: carbonice, sarate, amare, feruginoase, sulfuroase, iodurate etc.
Apele industriale sunt apele destinate diferitelor exploatari industriale: pentru alimentarea cazanelor de abur, ca mediu hidraulic, ca materie prima in diverse procese de fabricatie.
Conditiile ce se cer apei industriale depind de specificul procesului tehnologic in care este folosita. Apele folosite la alimentarea cazanelor de abur nu trebuie sa contina substante care sa corodeze partile metalice si nici sa depuna saruri ce ar impiedica transmiterea caldurii si deci ar mari consumul de combustibil necesar vaporizarii apei si ar putea da nastere la fisuri sau chiar explozii ale cazanului. De aceea se iau masuri ca inainte de intrarea apei in cazan sa se inlature din ea substantele daunatoare, operatie numita dedurizare.
Duritatea si purificarea apelor. Totalitatea sarurilor de calciu si magneziu, exprimata in grade de duritate, ce se gasesc dizolvate in apa constituie duritatea apei. Se deosebesc: duritatea temporara si duritatea permanenta. Duritatea temporara se datoreste bicarbonatilor de calciu si magneziu Ca (HCO3)2, Mg(HCO3)2, iar duritatea permanenta, clorurilor si sulfatilor de calciu si magneziu. Suma duritatilor temporara si permanenta formeaza duritatea totala.
Duritatea temporara se indeparteaza prin fierberea apei, cand bicarbonatii se descompun si depun carbonatii respectivi, sau prin tratare cu var:
Ca(HCO3)2+Ca(OH)2 = 2CaCO2+2H2O (Carbonatul de calciu se indeparteaza periodic.)
Duritatea permanenta se indeparteaza prin tratare cu soda (carbonat de sodiu).
CaSO4+Na2CO3=CaCO3+Na2SO4
Procedeul este ieftin, se preteaza la epurarea apelor foarte dure si operatia dureaza putin. Prezinta dezavantajul ca dedurizarea nu este completa si ca excesul de var se poate depune sub forma de crusta.
In ultimul timp, pentru dedurizarea apelor industriale se intrebuinteaza rasini sintetice de ioni.
Ape minerale. Multe izvoare au prilejul sa dizolve din straturile scoartei pamantului cu care vin in contact, substante solide sau gazoase, in cantitati anormal de mari, sau substante neobisnuite. Se disting urmatoarele categorii de ape minerale: izvoare acide simple, cu un continut mare de CO2 si putine substante minerale; izvoare carbonice, cu CO2 si b
icarbonat de sodiu, calciu si magneziu: izvoare alcaline, continand mult bicarbonat si putin CO2; izvoare sarate, cu un continut de p 33 ts 15 g/l NiCl; izvoare antare, continand sulfati de sodiu si magneziu ; izvoare sulfuroase, continand sulfuri alcaline si H2S liber; izvoare iodurate, continand ioni I si izvoare arsenicale, continand,trioxid de arsen sau arseniti.
Apa pura se obtine din
apa obisnuita, prin distilare, eventual repetata,
in
conditii in care sa nu poata dizolva gaze din aer sau substante solide
din
recipientele in care este conservata (de ex. alcalii din sticla obisnuita).
Apa curata nu conduce aproape deloc curentul electric. Ea se caracterizeaza prin caldura ei specifica, care este mai mare decat la toate substantele lichide si solubile adica pentru incalzirea apei trebuie cheltuita mai multa caldura decat pentru incalzirea cu un acelasi numar de grade, a unei cantitati egale de lichid sau solid oarecare. Dimpotriva, la racirea cu cateva grade, ea da mai multa caldura decat o cantitate egala dintr-o substanta solida sau lichida oarecare.
Rolul apei in natura. In faza initiala a pamantului, cand temperatura de la suprafata sa atingea cateva mii de grade, a inceput sa se formeze apa din hidrogen si oxigen. Istoria ulterioara a intregii scoarte solide pamantesti, este in modul cel mai strans legata de apa. Minereurile care apareau intr-o masa lichida si topita, includeau partial apa in compozitia lor chimica si intarindu-se sub o presiune mare, retineau vaporii de apa (pe langa alte gaze), sub forma de solutie. Daca incalzim, de exemplu, o bucata de granit la peste 1000, ea degaja gaze, al caror volum depaseste cu mult volumul ei propriu, iar cea mai mare parte a volumului gazos degajat apartine vaporilor de apa.
La o racire ulterioara a scoartei pamantesti, apa care a ramas nelegata a trecut in stare lichida, si a acoperit aproape 3/4 din intreaga suprafata a pamantului (510 milioane km2). Marile calde care s-au format atunci au servit drept mediu pentru nasterea vietii; tocmai in aceste mari au aparut, dupa toate probabilitatile, in decursul lungilor epoci geologice si s-au dezvoltat primele celule ale materiei vii.
Pe urma, viata a trecut partial pe uscat, totusi apa a ramas substanta de baza necesara intretinerii ei.
Cantitatea totala de apa pe pamant este evaluata la 2 . 1018 tone. Aproape 3/5 din aceasta cantitate este concentrata in mari si oceane. Din cele 2/5 ramase, o parte, relativ mica, revine apelor si gheturilor de pe uscat, cat si vaporilor de apa din aer, iar o parte mai mare intra in compozitia substantelor solide ale scoartei pamantesti.
Din apele dulci ale suprafetei pamantului, partea principala (circa 23 milioane km3) revine maselor de gheata ale continentelor, in primul rand a Antarcticei si Groenlandei. Raurile si apele solului formeaza impreuna numai cea 250 000 km3. Cam aceeasi parte revine lacurilor. Atmosfera contine aproape 13000 km3 de apa sub forma de vapori. Daca s-ar insuma toate apele dulci ale pamantului, atunci s-ar capata aproximativ 24 milioane km3, adica o cantitate care echivaleaza numai 2% din masa apelor oceanelor.
In decursul perioadelor geologice cunoscute, cantitatea de apa libera a ramas aproximativ aceeasi. Cu toate ca actualmente au loc procese la care ea intra in combinatii stabile, totusi exista si procese inverse, care echilibreaza aceasta pierdere. In straturile adanci ale scoartei pamantesti, in urma reactiilor chimice care au loc la temperaturi si presiuni mari, se formeaza asa numitele ape "juvenile', care ies apoi la suprafata sub forma de izvoare calde si reci. Si unele si altele se pot forma de asemenea pe socoteala apelor subterane obisnuite si contin deseori saruri si gaze dizolvate. Atunci ele sunt numite izvoare minerale si sunt folosite in parte pentru scopuri medicinale si industriale.
Caldura specifica mare a apei (care intrece aproximativ de 3300 de ori caldura specifica a unui volum egal de aer), determina influenta climaterica a oceanelor. Puternicii curenti calzi si reci determina climatul partilor de uscat pe langa care trec. De exemplu, clima Europei este strans legata de curentul oceanic cald Golfstrom, care incepe langa Ecuator, trece pe langa malurile Floridei (America de Nord), apoi pe langa Anglia si Norvegia si se pierde in Marea Polara de Nord. Sfarsitul lui cuprinde peninsula sovietica Kola. Gratie acestuia, Murmansc este un port ce nu ingheata, in timp ce, de exemplu portul Leningradului, care este situat mult mai la Sud, iarna ingheata. Blandetea climatului Europei occidentale este determinata mai ales de influenta Golfstromului, care in tot timpul anului poarta pe langa malurile ei, mase mari de ape incalzite, care indulcesc variatiile brusce de temperatura. In opozitie cu climatul "umed', climatul "continental' al tarilor indepartate de ocean se caracterizeaza prin schimbari brusce de temperatura, in diferite anotimpuri. In urma aceleiasi cauze - a marei calduri specifice a apei - diferenta de temperatura intre zi si noapte este foarte brusca pentru tarile cu clima continentala si devine aproape imperceptibila pe insulele oceanului.
Dizolvand gazele din atmosfera si ducandu-le prin curenti la distante mari, oceanul odata cu vanturile are rolul de regulator al compozitiei atmosferei. In aceasta directie, rolul lui este deosebit de important, in ce priveste gazul carbonic.
Bibliografie:
Chimie Experiente si principii - Paul R. O'Connor, Joseph E. Davis, Jr., Edward L. Haenisch, W. Keith MacNab, A.L. McClellan; Ed. Stiintifica si Enciclopedica, 1983
Chimie Generala - C.D. Nenitescu; Ed. Didactica si Pedagogica, Bucuresti
Enciclopedia de Chimie Vol. I - Ed. Stiintifica si Enciclopedica, Bucuresti, 1983
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2224
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved