| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Echilibru chimic. Principiul lui Le Chatelier
Principiul lucrarii:
Principiul Le Chatelier: Daca asupra unui sistem aflat in echilibru chimic se exercita o actiune din exterior, echilibrul se deplaseaza in sensul diminuarii sau anularii actiunii exercitate.
Factorii care influenteaza deplasarea echilibrului chimic sunt:
- variatia concentratiei reactantilor sau a produsilor de reactie din amestecul aflat in echilibru; cresterea concentratiei reactantilor deplaseaza echilibrul chimic in directia formarii produsilor de reactie, in timp ce cresterea concentratiei produsilor de reactie deplaseaza echilibrul chimic in directia produsilor initiali.
- variatia temperaturii in functie de caracterul exoterm sau endoterm al celor doua reactii (reactia directa si reactia inversa); cresterea temperaturii va deplasa echilibrul chimic in sensul favorizarii reactiei endoterme (-Q), iar micsorarea temperaturii va deplasa echilibrul chimic in sensul favorizarii reactiei exoterme (+Q).
- variatia presiunii, in cazul echilibrelor care implica substante gazoase si in care are loc variatia numarului de moli de gaz; cresterea presiunii va deplasa echilibrul chimic in directia in care se afla mai putini moli de gaz, iar micsorarea presiunii deplaseaza echilibrul chimic in directia in care se afla mai multi moli de gaz.
Starea de echilibru se stabileste cand vitezele cu care se desfasoara cele doua reactii opuse si simultane sunt egale.
Pentru reactia chimica reversibila de forma:
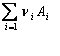
![]()
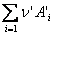
Viteza reactiei directe este:
![]() Viteza reactiei inverse este:
Viteza reactiei inverse este:
![]()
la echilibru v1 = v2, deci ![]()
rezulta:  unde: k1 si k2
reprezinta constanta de viteza pentru reactia molara a reactantului (Ai)
si produsului de reactie (A'i); Kc, constanta de
echilibru a reactiei exprimata in unitati de concentratii molare.
unde: k1 si k2
reprezinta constanta de viteza pentru reactia molara a reactantului (Ai)
si produsului de reactie (A'i); Kc, constanta de
echilibru a reactiei exprimata in unitati de concentratii molare.
Pentru reactiile chimice care decurg in solutii lichide exista urmatoarele relatii de legatura intre valorile constantei de echilibru exprimate prin activitati termodinamice, K, prin numar de moli Kn, prin fractii molare Kx si prin concentratii molare Kc:
K = Kx = Kn∙n-Dn ![]()
S-a notat cu n, numarul total de moli la echilibru, V, volumul total al solutiei, Dn S n'i - ni
Scopul lucrarii: in aceasta lucrare se studiaza influenta concentratiei asupra echilibrului chimic, efectuand urmatoarea reactie, care decurge in solutie:
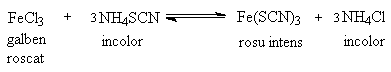 (3.20.7)
(3.20.7)
Aparatura si substante:
Aparatura: pahar Berzelius, eprubete, cilindru gradat, pipete, termometru
Substante solutii de clorura ferica (FeCl3), sulfocianura de amoniu (NH4SCN), clorura de amoniu (NH4Cl) solida
Modul de lucru:
- intr-un pahar Berzelius se introduc 39 mL apa distilata masurati cu un cilindru gradat, la care se adauga cate 0,5 mL solutie de FeCl3 si NH4SCN masurate cu o pipeta gradata; se noteaza temperatura T a solutiei;
- solutia obtinuta se toarna in volume egale (10 mL) in patru eprubete;
- eprubeta 1 se pastreaza ca etalon de comparatie;
- in eprubeta 2 se introduc 4.5 picaturi solutie de FeCl3. Se agita continutul eprubetei si se noteaza observatia referitoare la modificarea intensitatii culorii in comparatie cu eprubeta etalon;
- in eprubeta 3 introduc cate 45 picaturi solutie NH4SCN si un varf de spatula NH4Cl; se procedeaza la fel ca in primul caz, notandu-se variatia de culoare observata;
- in eprubeta 4 se introduc cateva picaturi de solutie de NH4Cl si se procedeaza la fel.
Calcule si rezultate:
Se completeaza tabelul urmator:
Tabelul 3.20.1
|
Nr. |
Culoare initiala |
Se adauga in exces |
Culoare finala |
Sensul de deplasare al echilibrului chimic |
||
|
FeCl3 |
NH4SCN |
NH4Cl |
||||
|
2 | ||||||
|
3 |
| |||||
|
4 | ||||||
Sa se discute deplasarea echilibrului chimic pentru cele 3 cazuri studiate, conform principiului lui Le Chatelier.
Sa se calculeze compozitia de echilibru, pe baza bilantului material,
cunoscand: concentratiile initiale ale reactantilor ![]() si stiind ca la
echilibru in cei 40 mL solutie (rezultata prin amestecarea reactantilor cu apa)
se formeaza 0,0005 mol Fe(SCN)3.
si stiind ca la
echilibru in cei 40 mL solutie (rezultata prin amestecarea reactantilor cu apa)
se formeaza 0,0005 mol Fe(SCN)3.
Se completeaza schema de bilant material:
Tabelul
|
Concentratie |
FeCl3 |
NH4SCN |
FeSCN |
NH4Cl |
|
Moli initiali, no | ||||
|
Moli consumati | ||||
|
Moli la echilibru, nech | ||||
|
Concentratii molare la echilibru, cech |
-Se calculeaza constanta de echilibru Kc :
-Se calculeaza entalpia libera de reactie DG cu relatia:
DG = - R T ln K (3.20.8)
Tema de casa:
In ce sens se deplaseaza echilibrul chimic al reactiei daca:
0,5N2(g) + 1,5H2(g) NH3(g) + 45,95 KJ
a) creste presiunea totala a echilibrului
b) scade temperatura sistemului
c) creste concentratia N2
d) creste concentratia NH3
e) creste concentratia N2 si NH3
Se considera reactia in faza gazoasa, la t = 1500C:
A2B4 2AB2
Daca la echilibru s-au gasit 4 molL-1 AB2, iar initial s-au luat in lucru 3 molL-1 A2B2, sa se determine:
a) constanta de echilibru Kc;
b) valoarea lui Kp corespunzator; R= 0,082 atmLK-1
Pentru reactiile
![]() si
si ![]()
Sa se arate:
a) cum influenteaza cresterea concentratiei fiecarui component al reactiei;
b) cum influenteaza cresterea presiunii echilibrului chimic.
Pentru reactia A + B ![]() 2C + D s-a lucrat cu un amestec echimolecular
de A si B (2 mol/L din fiecare reactant). Stiind ca se consuma 50% din fiecare
reactant, sa se calculeze constantele Kc si Kp, daca la
echilibru exista o presiune de 2 atm.
2C + D s-a lucrat cu un amestec echimolecular
de A si B (2 mol/L din fiecare reactant). Stiind ca se consuma 50% din fiecare
reactant, sa se calculeze constantele Kc si Kp, daca la
echilibru exista o presiune de 2 atm.
Pentru reactia SO2 (g) + ½ O2
(g) ![]() SO3 (g), la temperatura de 5000C,
constanta Kp = 85 atm-1/2. Se cere:
SO3 (g), la temperatura de 5000C,
constanta Kp = 85 atm-1/2. Se cere:
a) scrierea expresiilor lui KP, KC si Kx;
b) sa se calculeze Kp in mm Hg;
c) sa se calculeze Kc la 5000C.
. In reactia de esterificare catalizata dintre acidul acetic si etanol constanta de echilibru Kc= 4 la t=250C.
![]() . Ce cantitati de ester se for forma in amestecul final daca
se porneste de la urmatoarele amestecuri: a) 1 mol acid si 2 moli alcool, b) 1
mol acid, 2 moli de alcool, 2 moli de apa, c) 1 mol acid, 2 moli alcool, 1 mol
ester. Interpretati rezultatele prin principiul lui Le Chatelier.
. Ce cantitati de ester se for forma in amestecul final daca
se porneste de la urmatoarele amestecuri: a) 1 mol acid si 2 moli alcool, b) 1
mol acid, 2 moli de alcool, 2 moli de apa, c) 1 mol acid, 2 moli alcool, 1 mol
ester. Interpretati rezultatele prin principiul lui Le Chatelier.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4008
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved