| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Ecuatii cinetice
Studiul experimental al vitezelor de reactie a aratat ca acestea depind de diferiti factori experimentali. Dintre acestia, concentratiile componentilor, Cj, si temperatura, T, sunt comuni tuturor transformarilor chimice. In functie de specificul reactiei, exista si alti factori care pot influenta viteza de reactie. Pentru reactiile in faza gazoasa, viteza de reactie poate sa depinda si de presiunea totala, de prezenta unor componenti inerti, de prezenta catalizatorilor sau a inhibitorilor etc. Pentru reactiile care au loc in solutie, viteza de reactie poate depinde de natura solventului, de prezenta componentilor ionici (taria ionica), de pH-ul solutiei, de presiunea externa, de prezenta catalizatorilor sau a inhibitorilor etc.
Pentru reactiile care au loc in sisteme eterogene, viteza de reactie poate depinde si de marimea suprafetei de separatie interfazica. O astfel de dependenta poate fi formulata cu ajutorul unei ecuatii, numita ecuatie cinetica, ecuatia vitezei de reactie sau, mai pe scurt, ecuatie de viteza. In cele ce urmeaza vom adopta prima denumire. Forma cea mai generala a unei ecuatii cinetice trebuie sa evidentieze factorii specifici sistemului. Daca ne referim la concentratiile componentilor si la temperatura si daca notam toti ceilalti factori cu o singura litera, de exemplu Ω, ecuatia cinetica poate fi exprimata in forma:
![]() (34)
(34)
Deseori se considera numai dependenta de concentratii si de temperatura, obtinand forma mai simpla:
vR f (Cj ,T ) (35)
valabila atunci cand toti ceilalti factori sunt mentinuti constanti.
Unul dintre principalele obiective ale cineticii chimice este stabilirea formei explicite a acestei ecuatii cinetice, atat pentru reactiile elementare, cat si pentru cele complexe. Este de asteptat ca reactiile elementare sa fie descrise de cele mai simple ecuatii cinetice. Dupa cum se va vedea in continuare, exista si procese complexe care pot fi descrise de legi cinetice simple.
Stabilirea formei ecuatiei cinetice pentru reactiile simple s-a facut atat pe cale empirica (din date experimentale) cat si pe cale teoretica, pe baza unor modele moleculare.
Metoda empirica, bazata pe legea actiunii maselor aplicata vitezei de reactie, considera ca viteza unei reactii simple trebuie sa fie proportionala cu concentratiile reactantilor ridicate la puteri egale cu coeficientii lor stoichiometrici. Daca ne referim la reactiile elementare, aceasta afirmatie este justa. Orice extindere la alte reactii complexe nu are nici o justificare si poate conduce la discordante flagrante cu experimentul. Presupusa relatie de proportionalitate conduce la o ecuatie de forma:
![]()
in care functia f (Cj ,T ) a fost inlocuita cu un produs de doua functii, f (T ) f (Cj ) , una dependenta numai de temperatura si cealalta dependenta numai de concentratii. S-a presupus asadar ca functia f (Cj ,T ) este factorizabila. Primul factor a fost notat cu k si a fost numit constanta de viteza sau viteza specifica de reactie. Denumirea de constanta se refera evident la independenta de concentratiile componentilor. Denumirea de viteza specifica de reactie provine de la valoarea pe care o ia viteza de reactie cand
f (Cj ) 1. Ecuatia cinetica ia forma:
vR k f (Cj (37)
O forma convenabila, cu o mare capacitate de a reda comportarile experimentale gasite, pentru functia f (Cj ) este un produs de puteri:
![]()
unde
puterile ![]() au fost numite ordine partiale de reactie. Prin insumarea acestora, se
obtine ordinul global de reactie:
au fost numite ordine partiale de reactie. Prin insumarea acestora, se
obtine ordinul global de reactie:
![]()
Ecuatia cinetica ia forma finala:
![]()
Nu exista nici o justificare pentru extinderea acestei forme de ecuatie cinetica la reactiile complexe.
Metodele teoretice abordeaza problema formei ecuatiei cinetice pe baza notiunii de reactie elementara. Stabilirea formei ecuatiei cinetice pentru o reactie elementara se bazeaza pe conceptul de ciocnire intermoleculara. In urma ciocnirilor dintre doua molecule reactante identice, numai una sau ambele particule sufera transformari chimice, conducand la reactii monomoleculare sau bimoleculare. In urma ciocnirilor dintre doua molecule reactante diferite, se poate produce o reactie bimoleculara. Aceste modele simple conduc la obtinerea ecuatiilor cinetice ale reactiilor elementare, care au forme factorizabile si vor fi discutate in continuare. Cunoasterea formelor ecuatiilor cinetice ale reactiilor elementare da posibilitatea deducerii ecuatiilor cinetice ale reactiilor complexe. Astfel, metodele teoretice reprezinta in prezent principalul instrument de deducere a ecuatiilor cinetice pentru retelele de reactii.
Deseori, o ecuatie stoichiometrica simpla poate constitui o tentatie de a o considera reactie elementara si de a-i atribui astfel o ecuatie cinetica corespunzatoare. Un exemplu binecunoscut este reactia dintre H2 si I2, comparata cu reactia dintre H2 si Br2.
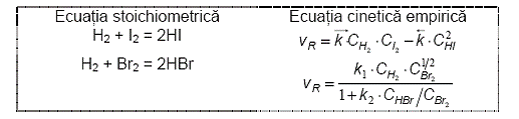
Exemplul arata clar ca, in cinetica chimica, forma ecuatiei cinetice nu poate sa fie confirmata decat pe cale experimentala.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1132
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved