| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Conform principiului lui Le Chatelier, cresterea de temperatura va favoriza deplasarea echilibrului in sensul reactiei endoterme si scaderea temperaturii va actiona favorabil asupra reactiei exoterme.
Exemplu:
2NO + O2 Û 2NO2 H < 0
Reactia este favorizata de scaderea temperaturii (à deplasarea echilibrului) deoarece este exoterma ( H < 0).
Relatia care exprima legatura dintre constanta de echilibru si variatia de temperatura se obtine, pornind de la expresia entalpiei libere standard (6.12). Pentru a urmari deplasarea echilibrului chimic cu temperatura, se inlocuieste entalpia libera standard (relatia 6.12) in ecuatia lui Gibbs-Helmholtz (4.183):
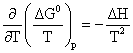
obtinandu-se:
![]() (6.26)
(6.26)
Ecuatia (6.26) se numeste izobara de reactie a lui van't Hoff. Analizand aceasta ecuatie se constata o concordanta perfecta cu principiul lui Le Chatelier. Daca reactia este endoterma ( H > 0), constanta de echilibru creste cu cresterea temperaturii, cu deplasarea echilibrului inspre formarea produsilor de reactie. Daca reactia este exoterma ( H < 0), constanta de echilibru scade cu cresterea temperaturii.
Scriind ecuatia lui van't Hoff (6.26) sub forma:
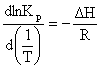 (6.27)
(6.27)
se observa ca
reprezentarea grafica a lui lnKp in functie de 1/T duce la o curba a
carei panta este egala cu - H/R. D
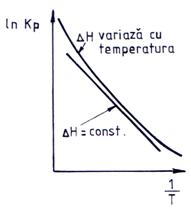
Fig. 6.1. Variatia lui lnKp in functie de 1/T
Pentru a fi utila in calcule termodinamice, ecuatia lui
van't Hoff (6.26) trebuie integrata. Integrarea se f
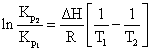 (6.28)
(6.28)
unde: ![]()
![]() = constanta de echilibru
corespunzatoare temperaturii T1, respectiv T2.
= constanta de echilibru
corespunzatoare temperaturii T1, respectiv T2.
D
![]() (6.29)
(6.29)
d
Constanta de integrare din ecuatia (6.29) se poate
determina d
D
![]() (6.30)
(6.30)
Integrand ecuatia (6.30) intre limitele T1 si T2 se obtine:
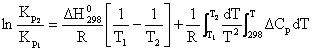 (6.31)
(6.31)
unde: ![]() = entalpia de re
= entalpia de re
Cp se inlocuieste cu relatia (4.100).
In
cazul re
Din ecuatia (6.19) ![]() rezulta prin logaritmare:
rezulta prin logaritmare:
![]() (6.32)
(6.32)
Derivand relatia (6.32) in raport cu temperatura, se obtine:
![]() (6.33)
(6.33)
Inlocuind relatia (6.33) in ecuatia izobarei (6.26) rezulta:
![]() (6.34)
(6.34)
respectiv
![]() (6.35)
(6.35)
Stiind ca la presiune constanta, exista relatia (4.69):
ΔU = H - p V = H - nRT
ecuatia (6.35) devine:
![]() (6.36)
(6.36)
Ecuatia (6.36) se numeste izocora de re
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3789
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved