| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Solutii apoase cu un singur electrolit
In teoria lui Pitzer, [33] [41], proprietatile solutiilor de electroliti pot fi exprimate printr-un termen "electrostatic" plus o serie de coeficienti viriali in care coeficientii viriali sunt dependenti de taria ionica a solutiei. Se sugereaza in mod particular ca cel de-al doilea coeficient virial variaza cu taria ionica (vezi cap.3). De asemenea, s-a propus o forma alternativa imbunatatita pentru termenul "electrostatic" , fata de teoria D-H.
Dependenta celui de-al doilea coeficient virial de taria ionica apare implicit si in teoria mai complexa a lui Mayer [22].
In forma generala, sistemul de ecuatii pentru proprietatile termodinamice ale electrolitilor puri sau ale amestecurilor acestora se poate scrie pornind de la expresia energiei libere Gibbs de exces:
![]() (A-1)
(A-1)
In aceste conditii coeficientul osmotic si coeficientul mediu ionic de activitate capata formele:
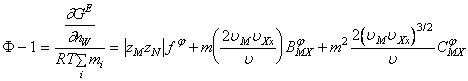 (A-2)
(A-2)
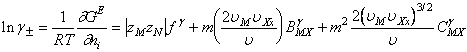 (A-3)
(A-3)
unde:
![]() si
si ![]() sunt numerele ionilor M si X, iar zM si zX sunt sarcinie electrice
respective, n nM nX , iar nW este numarul de Kg solvent
si m este molalitatea.
sunt numerele ionilor M si X, iar zM si zX sunt sarcinie electrice
respective, n nM nX , iar nW este numarul de Kg solvent
si m este molalitatea.
In ecuatiile (A-1), (A-2) si (A-3) s-au considerat trei functii pentru termenul electrostatic f:
![]() (A-4)
(A-4)
![]() (A-5)
(A-5) 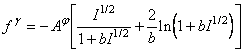 (A-6)
(A-6)
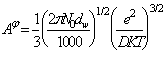 (A-7)
(A-7)
unde: ![]() este taria ionica,
este taria ionica, ![]() este
este
Pentru cel de-al doilea coeficient virial desemnat prin parametri b, s-au definit trei forme:
![]() (14-8)
(14-8) ![]() (A-9)
(A-9)
![]() (A-10)
(A-10)
unde parametri ![]() si
si ![]() dau seama de interactiile pe distanta mica dintre perechile de ioni.
dau seama de interactiile pe distanta mica dintre perechile de ioni.
Pentru parametri C au fost stabilite urmatoarele forme:
![]() ; (A-11)
; (A-11) ![]() (A-12)
(A-12)
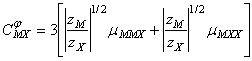 (A-13)
(A-13)
Parametrul ![]() defineste
al treilea coeficient virial care, in mod uzual, este mic si uneori, complet
neglijabil. Acesta da seama de interactiile triple: MMX, respectiv MXX.
defineste
al treilea coeficient virial care, in mod uzual, este mic si uneori, complet
neglijabil. Acesta da seama de interactiile triple: MMX, respectiv MXX.
Pentru obtinerea parametrilor, in cele mai multe cazuri aceste ecuatii au fost fitate dupa datele de coeficienti osmotici recomandate de Robinson si Stockes [27] sau dupa datele proprii [33]
Evaluarea parametrilor a fost discutata de asemenea in functie de structura solventului si de fortele interionice. Valorile cele mai bune pentru coeficientii viriali au fost obtinute prin metoda celor mai mici patrate. Din analiza facuta trebuie retinut ca al doilea coeficient virial poate lua fie valori pozitive fie negative, in functie de fortele predominante pe distanta mica, atractive sau repulsive.
In literatura de specialitate se gasesc parametri Pitzer de interactie inter-ionica pentru 304 solutii apoase de electroliti singulari la concentratii mari, pana la molalitati apropiate de saturatie, la calculul acestora contribuind diversi colaboratori, ca: J. J. Kim, si W. J. Frederick Jr. [127], Harvie, Moller si Weare [128], [139], [140].
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1480
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved